白念珠菌是一种肠道共生性和机会致病性真菌[1],是人类侵袭性疾病的主要病原体,白念珠菌感染在免疫受损的个体中尤为严重,例如艾滋病患者、接受免疫抑制治疗的移植患者以及植入医疗设备的患者[2],在2019年底暴发的新型冠状病毒肺炎患者中也发现了继发性白念珠菌侵袭性真菌感染[3]。肠道菌群与人体的健康有着密不可分的联系,其与宿主间存在着复杂而微妙的动态平衡,各种原因导致的肠道稳态失衡将会影响人体的健康,导致各种疾病的发生[4]。肠道菌群在抵抗白念珠菌定植和保护宿主免受病原微生物感染方面发挥着重要作用[5-6]。
近年来,肠道菌群在疾病中的作用越来越受到大家的关注,成为了许多抗病原体感染领域的研究热点[7-8]。本文从肠道益生菌、共生菌和肠道微生物代谢物短链脂肪酸三个方面综述肠道微生物抵御白念珠菌侵袭性感染的研究进展。
1 益生菌几十年来,全身和局部抗真菌药物如三唑类氟康唑、多烯类两性霉素B、棘白菌素类卡泊芬净等已被成功地用于白念珠菌感染的治疗和预防,以避免白念珠菌定植及侵袭性真菌感染的发生[9]。然而,由于药物的副作用(恶心、呕吐、腹泻),以及耐药念珠菌在世界范围内的急剧增长,使用药物抗真菌的措施仍有其局限性[10]。鉴于目前抗菌药物的局限性,益生菌被提出作为预防和治疗白念珠菌感染的替代或辅助药物[11]。益生菌是一类摄入充足活菌后有利于维护宿主体内微生态平衡,有益于机体健康的微生物[12],现已知的益生菌有近20种,可大致分为5类:乳杆菌属、双歧杆菌属、酵母菌属、链球菌属以及其他细菌。近些年来,益生菌抵御白念珠菌感染的作用得到了广泛研究,其在对抗白念珠菌泌尿生殖系统感染、胃肠道感染和口腔感染方面均发挥了一定的作用[13-14]。
益生菌潜在的杀菌或抑菌机制可能包括减少菌株定植[15-16];产生具有抗菌活性的次生代谢物和抑菌物质[17-18];改变微环境以及对黏附部位的竞争[19-20];对免疫系统的调节[21];抑制菌株丝状化和生物膜的形成;下调念珠菌生物膜形成相关基因水平[22-23];降低耐药基因表达等[24-25]。
在接受广谱抗菌药物治疗的胃肠道白念珠菌感染的危重症儿童中,益生菌组合辅助治疗能有效减少白念珠菌在胃肠道中的定植[15],鼠李糖乳杆菌的预防治疗可抑制白念珠菌在免疫抑制小鼠体内的定植与生长,有效阻止念珠菌病的发展[16]。乳酸杆菌和链球菌可产生一类具有细菌素样抑制活性的未知物质(BLISs),对外阴阴道炎患者分离的念珠菌具有良好的抗菌活性,防止生物膜的形成[17]。研究[18]表明,乳酸杆菌在实验室培养条件下分泌的一种天然产物1-乙酰基-β-咔啉(1-ABC)可以通过抑制双特异性酪氨酸磷酸化调节激酶(DYRK)家族的Yak1来阻止白念珠菌从酵母到菌丝状的转变和生物膜的形成。阴道内的卷曲乳酸杆菌BC1(Lactobacillus crispatus BC1)能产生一种具有良好乳化和附着能力的非均相脂肽生物表面活性剂,从而抑制白念珠菌在黏膜表面的黏附和定植[19]。部分益生菌还具有较高的表面疏水性,可增强自身与结肠上皮细胞的黏附能力,以此影响白念珠菌的定植能力[20]。枯草杆菌R0179(Bacillus subtilis R0179)与小鼠单核巨噬细胞白血病细胞(RAW 264.7)共培养12 h后,可显著下调磷酸化核因子κB抑制蛋白(P-Iκ-Bα)的蛋白水平,诱导核因子κB抑制蛋白(Iκ-Bα)降解,Iκ-Bα磷酸化降低导致核因子κB(NF-κB)活化降低,从而导致促炎细胞因子白细胞降介素(IL)-6、IL-12、IL-1β和肿瘤坏死因子(TNF)-α的下调,并且上调抗炎细胞因子IL-10的水平,通过树突状细胞相关性C型植物凝集素1(Dectin-1)途径调节巨噬细胞的细胞免疫功能,可预防白念珠菌感染过程中过度的促炎反应所致的组织损伤[21]。除此之外,益生菌还可以抑制白念珠菌的丝状化和生物膜的形成这两个关键的毒力因素,酵母型的白念珠菌比菌丝型更易受到巨噬细胞吞噬作用的影响,益生菌可以通过抑制白念珠菌菌丝化特异性基因TEC1和UME6的表达[22],减少生物膜形成相关基因ALS3、HWP1、CPH1和EFG1的表达[23],以及下调与氟康唑耐药性相关的CDR1、CDR2和MDR1基因[24-25],从而抑制白念珠菌的丝状化和生物膜的形成,提高耐药菌株对抗菌药物的敏感性,以此帮助宿主更有效地抵御白念珠菌的侵袭性感染。
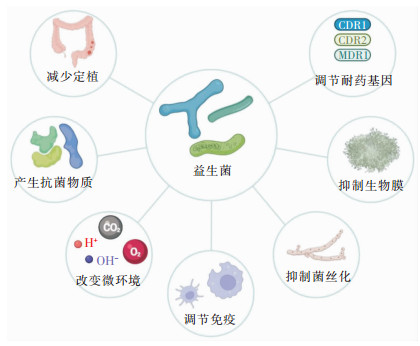 |
| 图 1 益生菌抵御白念珠菌侵袭性感染简要机制图 |
依据对机体的作用,肠道菌群大致可分为共生菌、条件致病菌和致病菌三类。共生菌一般为专性厌氧菌,占据肠道菌群所有细菌数量的99%以上,是肠道菌群的主体。共生是指两种不同生物之间所形成的紧密互利关系,机体为共生菌提供生存场所和营养,而这些细菌则为机体产生有益的物质,保护机体健康,主要包括拟杆菌、梭菌、双歧杆菌、乳酸杆菌等,其中有益于机体健康的乳酸杆菌属、双歧杆菌属、酵母菌属、链球菌属以及其他细菌又称为益生菌。条件致病菌在肠道菌群内数量较少。在正常条件下,由于大量共生菌的存在,条件致病菌并不容易大量繁殖以致对机体造成危害,主要包括肠球菌、肠杆菌等。致病菌一般不常驻在肠道内,但机体若不慎摄入则可能在肠道内大量繁殖,导致疾病的发生,主要包括沙门氏菌、致病性大肠埃希菌等[26]。
除益生菌以外的其他非益生共生菌和部分条件致病菌对防治白念珠菌感染也有一定作用。肠道菌群的稳态是维持机体健康的重要标志之一,具有成熟完整肠道菌群的小鼠可以防止白念珠菌在肠道微生物区的定植,而无菌小鼠、特殊抗菌药物处理小鼠以及免疫抑制剂治疗的小鼠则很容易被白念珠菌侵袭性感染[27]。研究[28]表明,经过抗菌药物处理后,肠道中共生菌的数量与白念珠菌的定植水平呈负相关,且粪菌移植可预防白念珠菌在小鼠胃肠道的定植;此外,某些特定共生菌的存在可以刺激机体的免疫反应,增加抗菌物质的产生,增强黏膜屏障的保护能力,为机体提供一定的定植抗性,保护机体免受白念珠菌的损伤[28]。
早在1993年,Samonis等[29]发现小鼠胃肠道中的共生厌氧菌对抵抗白念珠菌在肠道的定植有重要作用。Fan等[28]进一步证明小鼠肠道中的共生厌氧菌梭菌属厚壁菌门(Clostridial firmicutes)和拟杆菌门(Bacteroidetes)是维持小鼠对白念珠菌定植抗性的关键,并且使用多形拟杆菌(Bacteroides thetaiotamicron)口服补充治疗可激活小鼠结肠缺氧诱导因子-1α(HIF-1α)的表达,从而诱导cathelicidins相关抗菌肽(cathelicidins-related antimicrobial peptide, CRAMP)的生成,显著减少抗菌药物诱导的白念珠菌肠道定植,使小鼠白念珠菌侵袭性感染的死亡率降低50%。
酵母和菌丝是白念珠菌最常见的细胞类型,酵母向菌丝的细胞形态转变与白念珠菌的毒力有关[30]。白念珠菌普遍以酵母的形态与机体共生,菌丝形态通常与其侵袭性感染机体的能力密切相关[31]。来自不同物种的分泌型细菌产物可以抑制白念珠菌的丝状化,同样作为条件致病菌的铜绿假单胞菌可以通过产生细胞与细胞之间的信号分子来抑制白念珠菌的丝状化,还可释放具有氧化还原活性的吩嗪,高浓度的吩嗪对白念珠菌具有毒性。在低浓度时,其可特异性抑制白念珠菌的呼吸作用而不利于白念珠菌的菌丝化,阻止生物膜的形成;除此之外,铜绿假单胞菌还会影响白念珠菌的代谢途径,降低白念珠菌获取铁和锌相关基因的表达,上调其转录过程中组蛋白去乙酰化酶复合物SET3的表达,控制白念珠菌的扩散和菌丝化[32]。粪肠球菌作为常见的条件致病菌,对白念珠菌也有一定的抵御作用。粪肠球菌可分泌一种细菌素(EntV),EntV不直接杀死白念珠菌,也未抑制其生长,但EntV可在低浓度下抑制白念珠菌的菌丝化和生物膜的形成,可完全保护线虫免受白念珠菌的感染,并增加小鼠巨噬细胞对真菌的清除能力[33]。
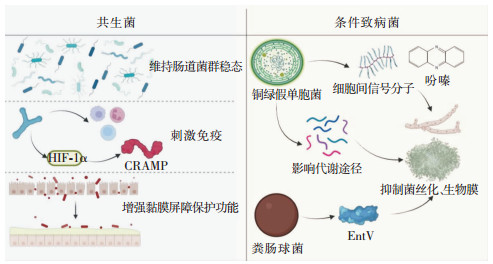 |
| 图 2 共生菌和条件致病菌抵御白念珠菌侵袭性感染简要机制图 |
短链脂肪酸(short chain fatty acids,SCFAs)是指碳原子小于6个的有机脂肪酸,主要由不消化的碳水化合物在结肠内经厌氧菌酵解而成,主要包括乙酸、丙酸和丁酸,约占SCFAs总量的90%~95%[34]。小鼠和人类的抗菌药物治疗改变了其肠道微生物的组成,最终导致微生物衍生的肠道代谢物SCFAs水平的改变,SCFAs正常水平的改变与白念珠菌、艰难梭菌等肠道病原体的生长、定植和致病有关[35-36]。
研究[35]表明,SCFAs对白念珠菌的生长繁殖、芽管形成、菌丝形成和生物膜的功能均有抑制作用。抗菌药物诱导的盲肠内SCFAs水平的降低促进了白念珠菌在肠道中的生长和定植。SCFAs还可以通过调节MIG1基因,降低白念珠菌细胞内铁和rRNA水平,使白念珠菌进入类似饥饿的代谢状态,降低其转录、翻译和生长的速度,从而限制菌株的生理机能[37-38]。其次,低浓度的甲酸还可以激活Caspase蛋白酶,以此诱导白念珠菌程序性死亡,并且对哺乳动物细胞的影响很小[39]。
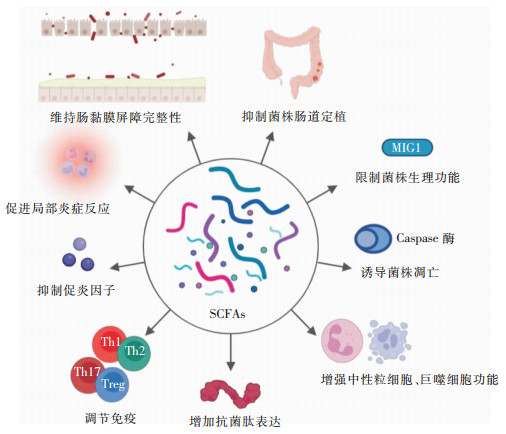 |
| 图 3 SCFAs抵御白念珠菌侵袭性感染简要机制图 |
中性粒细胞和巨噬细胞的功能在抵御白念珠菌感染中具有至关重要的作用,中性粒细胞缺少症患者及巨噬细胞功能低下患者容易遭受侵袭性念珠菌感染,导致感染后病死率的增高[40-41]。SCFAs能通过增加中性粒细胞表面L-selecyin的表达,促进细胞因子诱导的中性粒细胞趋化因子-2(cytokine-induced neutrophil chemoattractant-2, CINC-2αβ)的释放,刺激中性粒细胞迁移至炎症部位[42]。此外,丁酸可调节中性粒细胞的吞噬功能,减少TNF-α、CINC-2αβ和一氧化氮(NO)的产生,同时能抑制组蛋白去乙酰酶和NF-κB的活性,从而起到缓解炎症反应的作用[42]。另有动物试验研究[43]表明,丁酸可以通过诱导Ca2+流动、促进ERK1/2和p38 MAPK磷酸化、中性粒细胞脱颗粒和胞外诱捕网的形成,实现对中性粒细胞的功能调节,进而影响固有免疫应答效应。在炎症部位,当中性粒细胞和巨噬细胞通过活性氧(reactive oxygen species, ROS)途径将进入机体的细菌、真菌等病原体消灭时,SCFAs就可能会参与其中,影响ROS的产生和巨噬细胞的吞噬能力[44-47]。其次,SCFAs还具有其他免疫调节作用:增加抗菌肽的表达,调节免疫介质的产生;调节Th1/Th2和Th17/Treg的平衡;在炎症状态下抑制促炎因子的分泌;促进局部炎症反应的发生;维持肠道黏膜屏障的完整性[46-50]。
4 小结肠道菌群与人体的健康有着密不可分的联系,其与宿主之间多方面深层次的相互作用对宿主各方面的生理、病理状态都产生了深远的影响。随着微生物组学、代谢组学、蛋白质组学的不断发展,肠道微生物区系在抵御白念珠菌侵袭性感染中的重要作用已被广泛接受,但肠道微生物区系如何对白念珠菌侵袭性感染作出贡献的机制还需要更深入的研究。肠道共生菌、益生菌和SCFAs通过不同的机制、靶点和效应物对宿主产生了局部或全身的抗白念珠菌感染作用,揭示了健康肠道菌群具有维持和调节免疫稳态,维护宿主健康的重要作用,了解其与宿主相互作用的机制,有助于抵御病原微生物的侵袭性感染,并为临床治疗提供理论依据。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Witchley JN, Penumetcha P, Abon NV, et al. Candida albicans morphogenesis programs control the balance between gut commensalism and invasive infection[J]. Cell Host Microbe, 2019, 25(3): 432-443. DOI:10.1016/j.chom.2019.02.008 |
| [2] |
Dadar M, Tiwari R, Karthik K, et al. Candida albicans-biology, molecular characterization, pathogenicity, and advances in diagnosis and control-an update[J]. Microb Pathog, 2018, 117: 128-138. DOI:10.1016/j.micpath.2018.02.028 |
| [3] |
Chen NS, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395(10223): 507-513. DOI:10.1016/S0140-6736(20)30211-7 |
| [4] |
张晓波, 孙辉. 肠道菌群对人体健康的作用及其应用[J]. 生物医学转化, 2021, 2(2): 39-45. Zhang XB, Sun H. Role and application of intestinal flora in human health[J]. Biomedical Transformation, 2021, 2(2): 39-45. |
| [5] |
Matsuo K, Haku A, Bi BB, et al. Fecal microbiota transplantation prevents Candida albicans from colonizing the gastrointestinal tract[J]. Microbiol Immunol, 2019, 63(5): 155-163. DOI:10.1111/1348-0421.12680 |
| [6] |
Blander JM, Longman RS, Iliev ID, et al. Regulation of inflammation by microbiota interactions with the host[J]. Nat Immunol, 2017, 18(8): 851-860. DOI:10.1038/ni.3780 |
| [7] |
Hameed S, Hans S, Monasky R, et al. Understanding human microbiota offers novel and promising therapeutic options against Candida infections[J]. Pathogens, 2021, 10(2): 183. DOI:10.3390/pathogens10020183 |
| [8] |
Panwar RB, Sequeira RP, Clarke TB. Microbiota-mediated protection against antibiotic-resistant pathogens[J]. Genes Immun, 2021, 22(5-6): 255-267. DOI:10.1038/s41435-021-00129-5 |
| [9] |
刘琳, 王慧, 刘宁宁. 侵袭性念珠菌感染在免疫力低下人群中的流行病学和治疗进展[J]. 上海交通大学学报(医学版), 2021, 41(4): 525-529. Liu L, Wang H, Liu NN. Advances in epidemiology and treatment of invasive Candida infection in the immunocompromised population[J]. Journal of Shanghai Jiaotong University(Medical Science), 2021, 41(4): 525-529. |
| [10] |
张伶玲, 刘泉波. 侵袭性念珠菌病耐药机制的研究进展[J]. 现代医药卫生, 2021, 37(9): 1511-1515. Zhang LL, Liu QB. Advances in the study of drug resistance mechanisms in invasive candidiasis[J]. Journal of Modern Medicine & Health, 2021, 37(9): 1511-1515. |
| [11] |
Hu HH, Merenstein DJ, Wang CW, et al. Impact of eating probiotic yogurt on colonization by Candida species of the oral and vaginal mucosa in HIV-infected and HIV-uninfected women[J]. Mycopathologia, 2013, 176(3-4): 175-181. DOI:10.1007/s11046-013-9678-4 |
| [12] |
李浩然. 益生菌发酵乳的研究及产业化进展[J]. 食品安全导刊, 2021(3): 36-37. Li HR. Research and industrialization progress of probiotic fermented milk[J]. China Food Safety Magazine, 2021(3): 36-37. |
| [13] |
李佳桐, 周学东, 徐欣, 等. 益生菌防治口腔感染性疾病的研究进展[J]. 口腔疾病防治, 2019, 27(9): 598-602. Li JT, Zhou XD, Xu X, et al. Research progress of probiotics in the prevention and treatment of oral infectious diseases[J]. Journal of Prevention and Treatment for Stomatological Diseases, 2019, 27(9): 598-602. |
| [14] |
Paniágua AL, Correia AF, Pereira LC, et al. Inhibitory effects of Lactobacillus casei Shirota against both Candida auris and Candida spp. isolates that cause vulvovaginal candidiasis and are resistant to antifungals[J]. BMC Complement Med Ther, 2021, 21(1): 237. DOI:10.1186/s12906-021-03405-z |
| [15] |
Kumar S, Bansal A, Chakrabarti A, et al. Evaluation of efficacy of probiotics in prevention of Candida colonization in a PICU-a randomized controlled trial[J]. Crit Care Med, 2013, 41(2): 565-572. DOI:10.1097/CCM.0b013e31826a409c |
| [16] |
Leão MVP, Tavares TAA, Gonçalves E Silva CR, et al. Lactobacillus rhamnosus intake can prevent the development of candidiasis[J]. Clin Oral Investig, 2018, 22(7): 2511-2518. DOI:10.1007/s00784-018-2347-8 |
| [17] |
Hefzy EM, Khalil MAF, Amin AAI, et al. Bacteriocin-like inhibitory substances from probiotics as therapeutic agents for Candida vulvovaginitis[J]. Antibiotics (Basel), 2021, 10(3): 306. DOI:10.3390/antibiotics10030306 |
| [18] |
MacAlpine J, Daniel-Ivad M, Liu ZL, et al. A small molecule produced by Lactobacillus species blocks Candida albicans fila-mentation by inhibiting a DYRK1-family kinase[J]. Nat Commun, 2021, 12(1): 6151. DOI:10.1038/s41467-021-26390-w |
| [19] |
De Gregorio PR, Parolin C, Abruzzo A, et al. Biosurfactant from vaginal Lactobacillus crispatus BC1 as a promising agent to interfere with Candida adhesion[J]. Microb Cell Fact, 2020, 19(1): 133. DOI:10.1186/s12934-020-01390-5 |
| [20] |
Kang CH, Kim Y, Han SH, et al. In vitro probiotic properties of vaginal Lactobacillus fermentum MG901 and Lactobacillus plantarum MG989 against Candida albicans[J]. Eur J Obstet Gynecol Reprod Biol, 2018, 228: 232-237. DOI:10.1016/j.ejogrb.2018.07.005 |
| [21] |
Zhao WW, Wang X, Zhao C, et al. Immunomodulatory mechanism of Bacillus subtilis R0179 in RAW 264.7 cells against Candida albicans challenge[J]. Microb Pathog, 2021, 157: 104988. DOI:10.1016/j.micpath.2021.104988 |
| [22] |
de Barros PP, Scorzoni L, Ribeiro FDC, et al. Lactobacillus paracasei 28.4 reduces in vitro hyphae formation of Candida albicans and prevents the filamentation in an experimental model of Caenorhabditis elegans[J]. Microb Pathog, 2018, 117: 80-87. DOI:10.1016/j.micpath.2018.02.019 |
| [23] |
Rossoni RD, de Barros PP, de Alvarenga JA, et al. Antifungal activity of clinical Lactobacillus strains against Candida albicans biofilms: identification of potential probiotic candidates to prevent oral candidiasis[J]. Biofouling, 2018, 34(2): 212-225. DOI:10.1080/08927014.2018.1425402 |
| [24] |
Suchodolski J, Derkacz D, Bernat P, et al. Capric acid secreted by Saccharomyces boulardii influences the susceptibility of Candida albicans to fluconazole and amphotericin B[J]. Sci Rep, 2021, 11(1): 6519. DOI:10.1038/s41598-021-86012-9 |
| [25] |
Dube Y, Khan A, Marimani M, et al. Lactobacillus rhamnosus cell-free extract targets virulence and antifungal drug resistance in Candida albicans[J]. Can J Microbiol, 2020, 66(12): 733-747. DOI:10.1139/cjm-2019-0491 |
| [26] |
邵加庆. 代谢性疾病防控的新大陆——肠道菌群[J]. 医学研究生学报, 2016, 29(1): 16-20. Shao JQ. Gut microbiota: a new world for the prevention and control of metabolic disease[J]. Journal of Medical Postgradua- tes, 2016, 29(1): 16-20. |
| [27] |
Hirayama T, Miyazaki T, Ito Y, et al. Virulence assessment of six major pathogenic Candida species in the mouse model of invasive candidiasis caused by fungal translocation[J]. Sci Rep, 2020, 10(1): 3814. DOI:10.1038/s41598-020-60792-y |
| [28] |
Fan D, Coughlin LA, Neubauer MM, et al. Activation of HIF-1α and LL-37 by commensal bacteria inhibits Candida albicans colonization[J]. Nat Med, 2015, 21(7): 808-814. DOI:10.1038/nm.3871 |
| [29] |
Samonis G, Gikas A, Anaissie EJ, et al. Prospective evaluation of effects of broad-spectrum antibiotics on gastrointestinal yeast colonization of humans[J]. Antimicrob Agents Chemother, 1993, 37(1): 51-53. DOI:10.1128/AAC.37.1.51 |
| [30] |
Noble SM, Gianetti BA, Witchley JN. Candida albicans cell-type switching and functional plasticity in the mammalian host[J]. Nat Rev Microbiol, 2017, 15(2): 96-108. DOI:10.1038/nrmicro.2016.157 |
| [31] |
Verma-Gaur J, Traven A. Post-transcriptional gene regulation in the biology and virulence of Candida albicans[J]. Cell Microbiol, 2016, 18(6): 800-806. DOI:10.1111/cmi.12593 |
| [32] |
Fourie R, Cason ED, Albertyn J, et al. Transcriptional response of Candida albicans to Pseudomonas aeruginosa in a polymicrobial biofilm[J]. G3 (Bethesda), 2021, 11(4): jkab042. DOI:10.1093/g3journal/jkab042 |
| [33] |
Graham CE, Cruz MR, Garsin DA, et al. Enterococcus faecalis bacteriocin EntV inhibits hyphal morphogenesis, biofilm formation, and virulence of Candida albicans[J]. Proc Natl Acad Sci U S A, 2017, 114(17): 4507-4512. DOI:10.1073/pnas.1620432114 |
| [34] |
李素彦, 徐鑫, 杨运强, 等. 不同时期应用益生菌对脓毒症患者肠道菌群及短链脂肪酸的影响[J]. 河北医药, 2015, 37(23): 3567-3571. Li SY, Xu X, Yang YQ, et al. Effect of probiotics applied at different periods on intestinal flora and short-chain fatty acids in patients with sepsis[J]. Hebei Medical Journal, 2015, 37(23): 3567-3571. |
| [35] |
Guinan J, Wang SH, Hazbun TR, et al. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans[J]. Sci Rep, 2019, 9(1): 8872. DOI:10.1038/s41598-019-45467-7 |
| [36] |
Theriot CM, Koenigsknecht MJ, Carlson PE Jr, et al. Antibio- tic-induced shifts in the mouse gut microbiome and metabolome increase susceptibility to Clostridium difficile infection[J]. Nat Commun, 2014, 5: 3114. DOI:10.1038/ncomms4114 |
| [37] |
Cottier F, Tan ASM, Xu XL, et al. MIG1 regulates resistance of Candida albicans against the fungistatic effect of weak organic acids[J]. Eukaryot Cell, 2015, 14(10): 1054-1061. DOI:10.1128/EC.00129-15 |
| [38] |
Cottier F, Tan ASM, Chen JM, et al. The transcriptional stress response of Candida albicans to weak organic acids[J]. G3 (Bethesda), 2015, 5(4): 497-505. DOI:10.1534/g3.114.015941 |
| [39] |
Lastauskienė E, Zinkevicč ienė A, Girkontaitė I, et al. Formic acid and acetic acid induce a programmed cell death in pathogenic Candida species[J]. Curr Microbiol, 2014, 69(3): 303-310. DOI:10.1007/s00284-014-0585-9 |
| [40] |
Desai JV, Lionakis MS. The role of neutrophils in host defense against invasive fungal infections[J]. Curr Clin Microbiol Rep, 2018, 5(3): 181-189. DOI:10.1007/s40588-018-0098-6 |
| [41] |
Austermeier S, Kasper L, Westman J, et al. I want to break free-macrophage strategies to recognize and kill Candida albicans, and fungal counter-strategies to escape[J]. Curr Opin Microbiol, 2020, 58: 15-23. DOI:10.1016/j.mib.2020.05.007 |
| [42] |
Vinolo MAR, Rodrigues HG, Hatanaka E, et al. Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils[J]. J Nutr Biochem, 2011, 22(9): 849-855. DOI:10.1016/j.jnutbio.2010.07.009 |
| [43] |
Carretta MD, Hidalgo AI, Burgos J, et al. Butyric acid stimulates bovine neutrophil functions and potentiates the effect of platelet activating factor[J]. Vet Immunol Immunopathol, 2016, 176: 18-27. DOI:10.1016/j.vetimm.2016.05.002 |
| [44] |
Vinolo MAR, Hatanaka E, Lambertucci RH, et al. Effects of short chain fatty acids on effector mechanisms of neutrophils[J]. Cell Biochem Funct, 2009, 27(1): 48-55. DOI:10.1002/cbf.1533 |
| [45] |
Maslowski KM, Vieira AT, Ng A, et al. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43[J]. Nature, 2009, 461(7268): 1282-1286. DOI:10.1038/nature08530 |
| [46] |
Bilotta AJ, Cong YZ. Gut microbiota metabolite regulation of host defenses at mucosal surfaces: implication in precision medicine[J]. Precis Clin Med, 2019, 2(2): 110-119. DOI:10.1093/pcmedi/pbz008 |
| [47] |
Zhang DC, Frenette PS. Cross talk between neutrophils and the microbiota[J]. Blood, 2019, 133(20): 2168-2177. DOI:10.1182/blood-2018-11-844555 |
| [48] |
蒙丹丽, 梁列新, 宋怀宇. 短链脂肪酸在肠道中的生理作用[J]. 中国临床新医学, 2018, 11(2): 198-202. Meng DL, Liang LX, Song HY. Physiological function of short-chain fatty acids in the intestine[J]. Chinese Journal of New Clinical Medicine, 2018, 11(2): 198-202. |
| [49] |
Corrêa-Oliveira R, Fachi JL, Vieira A, et al. Regulation of immune cell function by short-chain fatty acids[J]. Clin Transl Immunology, 2016, 5(4): e73. DOI:10.1038/cti.2016.17 |
| [50] |
Park J, Kim M, Kang SG, et al. Short-chain fatty acids induce both effector and regulatory T cells by suppression of histone deacetylases and regulation of the mTOR-S6K pathway[J]. Mucosal Immunol, 2015, 8(1): 80-93. DOI:10.1038/mi.2014.44 |



