2. 云南省第一人民医院 昆明理工大学附属医院肝胆胰外科, 云南 昆明 650041;
3. 云南省第一人民医院 昆明理工大学附属医院疾病预防控制科, 云南 昆明 650034
2. Department of Hepatopancreatobiliary, The First People's Hospital of Yunnan Province, Kunming 650041, China;
3. Department of Disease Control and Prevention, The First People's Hospital of Yunnan Province, Kunming 650034, China
丙型肝炎病毒(hepatitis C virus,HCV)感染是全球性公共卫生问题,据2019全球疾病负担研究(Global Burden of Disease Study 2019, GBD 2019)在线分析,2019年全球已有约1.13亿HCV感染者(包括急性丙型病毒性肝炎、丙型病毒性肝炎相关肝硬化或肝癌等慢性肝病),年龄标准化患病率约1 426/10万。HCV感染的显著特点之一为其隐匿性强[1],一般人群的感染风险也较高[2],70%~80%的急性HCV感染者进展为慢性携带者,经20~30年,10%~20%的慢性HCV感染者会出现并发症,如肝硬化、终末期肝病或肝细胞癌[3-4]。值得关注的是,直接抗病毒药物(Direct Antiviral Agents,DAA)的问世与快速发展,使丙型病毒性肝炎治愈率从干扰素时代的不足50%提高到95%以上[5],推动了世界卫生组织(WHO)提出的2030年消除丙型病毒性肝炎公共卫生威胁的倡议[6],同时,我国政府积极响应,制定多项政策并付诸行动,推行“消除丙型病毒性肝炎公共卫生危害行动工作”,促进形成多部门联合防治的综合机制[7-10]。本文分析1990—2019年我国丙型病毒性肝炎的疾病负担变化趋势,以及不同特征人群的现状,为助力消除丙型病毒性肝炎行动的实施提供科学依据。
1 资料与方法 1.1 数据来源本研究数据来源于美国健康指标与评估研究所(Institute for Health Metrics and Evaluation,IHME)定期公布的全球健康交流数据(Global Health Data Exchange,GHDx),其中,GBD 2019数据库采用标准化分析方法,按年龄、性别对204个国家和地区1990—2019年的369种疾病和伤害、87种风险因子的全因和具体原因的发病、患病、死亡和伤残情况进行全面评估,将健康损失进行量化,为决策者认识疾病的流行程度及其所造成的健康损害提供数据支持。该数据库中的丙型病毒性肝炎相关数据来自于全国法定传染病报告监测系统、科学文献、卫生统计年鉴、官方调查报告等。
1.2 研究方法本研究将丙型病毒性肝炎相关疾病分为急性丙型病毒性肝炎、丙型病毒性肝炎相关慢性肝病(即丙型病毒性肝炎相关肝硬化及其他慢性肝病)、丙型病毒性肝炎相关肝癌,丙型病毒性肝炎总负担为三者合计的疾病负担。GBD 2019对急性丙型病毒性肝炎的研究覆盖全年龄段人群,丙型病毒性肝炎相关慢性肝病的研究为1岁及以上人群,丙型病毒性肝炎相关肝癌则为10岁及以上人群;文中“<1岁婴儿”包括新生儿(即出生28 d以内者)。疾病负担指标纳入了发病数、患病数、伤残调整生命年(disability-adjusted life year,DALY,单位:人年)、寿命损失年(years of life lost,YLL,单位:人年),以及以上4个指标的率、年龄标准化率(简称标化率)。
1.3 数据分析疾病负担指标的估计使用贝叶斯Meta回归模型(DisMod-MR 2.1)[11]。年龄标化率则以全球人口为基准进行标准化,根据我国当年人口数计算获得。采用GraphPad Prism 8.0作图。
2 结果 2.1 2019年中国丙型病毒性肝炎疾病负担2019年,我国全人群急性丙型病毒性肝炎发病人数478 123例,年龄标化发病率约47/10万。慢性丙型病毒性肝炎发病人数113 123例,男性多于女性;而女性的患病例数(约997万VS约906万)和标化患病率(1 322/10万VS 1 175/10万)则多于男性,超1 900万人患有慢性丙型病毒性肝炎,DALY约132万人年、其中YLL约129万人年;男性的标化DALY率(106/10万VS 26/10万)和标化YLL率(105/10万VS 25/10万)远高于女性。丙型病毒性肝炎相关肝癌发病人数约3万,患病人数约4万,而DALY则高达71.4万人年,YLL达70.6万人年。见表 1。
| 表 1 2019年中国丙型病毒性肝炎的疾病负担状况 Table 1 Disease burden of hepatitis C in China, 2019 |
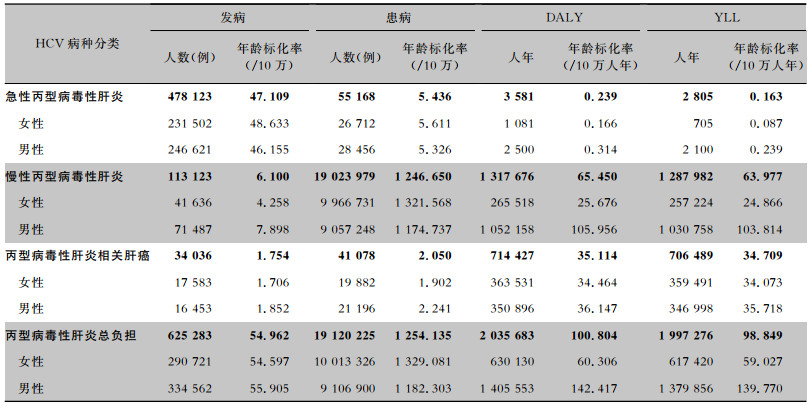
|
2019年,我国因HCV引起的急性丙型病毒性肝炎、慢性肝病和肝癌的总发病例数为625 283例,患病例数超1 912万,DALY超过203万人年,其中YLL接近200万人年。
2.2 2019年不同年龄段丙型病毒性肝炎疾病负担由表 1可知,急性丙型病毒性肝炎、慢性丙型病毒性肝炎、丙型病毒性肝炎相关肝癌导致的DALY均以YLL为主,为更清晰地展示疾病负担在不同年龄、性别组人群的分布特征及30年的变化趋势,作图时仅使用发病率、患病率、DALY率及相应的年龄标化率。1岁内婴儿(尤其是新生儿)丙型病毒性肝炎相关疾病的发病率最高,>10岁发病率较低,再次波峰出现在40~44岁组和>80岁组;患病率则随着年龄增长显著升高;DALY率在20岁后明显增高。见图 1。
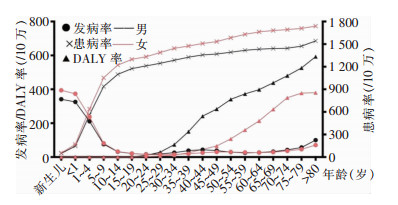 |
| 图 1 2019年不同年龄段丙型病毒性肝炎疾病负担 Figure 1 Disease burden of hepatitis C in different age groups, 2019 |
2019年,我国急性丙型病毒性肝炎在新生儿中发病率最高,<1岁婴儿次之,随后快速下降至10~14岁组(32/10万),35~39岁组约11/10万,之后随着年龄增长再次升高。见图 2。
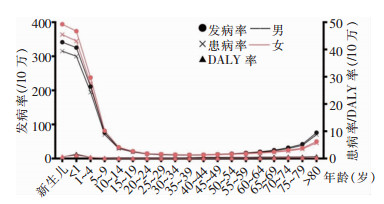 |
| 图 2 2019年不同年龄段急性丙型病毒性肝炎疾病负担 Figure 2 Disease burden of acute hepatitis C in different age groups, 2019 |
丙型病毒性肝炎相关慢性肝病的发病率在35~49岁出现高峰,尤其是40~44岁,约23/10万。患病率随着年龄的增加呈上升趋势,尤其是1~14岁年龄段极速上升;>80岁组患病率约1 636/10万;2019年全人群丙型病毒性肝炎相关慢性肝病患病率约1 338/10万。DALY率自25~29岁后快速增加,50~54岁后达到平台期,男性上升速度及其水平明显高于女性,50~54岁组DALY率(276/10万)约为女性(57/10万)的5倍。见图 3。
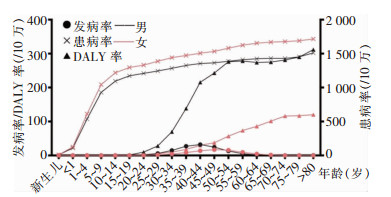 |
| 图 3 2019年不同年龄段丙型病毒性肝炎相关慢性肝病疾病负担 Figure 3 Disease burden of hepatitis C-related chronic liver disease in different age groups, 2019 |
我国丙型病毒性肝炎相关肝癌发病率、患病率、DALY率超过1/10万的年龄组为:30~34岁组、40~44岁组、45~49岁组,且均随着年龄增长而升高,见图 4。
 |
| 图 4 2019年不同年龄段丙型病毒性肝炎相关肝癌疾病负担 Figure 4 Disease burden of hepatitis C-related liver cancer in different age groups, 2019 |
1990年以来,我国丙型病毒性肝炎相关疾病的标化发病率从88/10万逐年下降至2015年的波谷(38/10万),其后4年连续上升,2019年约55/10万;标化患病率变化趋势与标化发病率类似,1990、2015、2019年分别为2 153/10万、762/10万、1 254/10万,且女性均高于男性。标化DALY率从1990年的254/10万逐年下降至2019年的101/10万,男性均高于女性。见图 5。
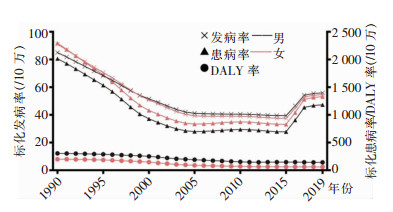 |
| 图 5 1990—2019年中国丙型病毒性肝炎疾病负担变化趋势 Figure 5 Changing trends of disease burden of hepatitis C in China, 1990-2019 |
1990年,我国急性丙型病毒性肝炎标化发病率约77/10万,随后逐年下降,2015年降至谷底(约31/10万),而后快速升高,2019年约47/ 10万;标化患病率变化趋势类似,1990、2015、2019年分别为9/10万、4/10万、5/10万,女性高于男性;标化DALY率从1990年的5/10万持续下降至2019年的0.2/10万,男性均高于女性。见图 6。
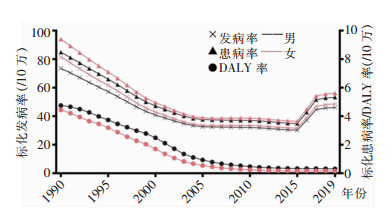 |
| 图 6 1990—2019年中国急性丙型病毒性肝炎疾病负担变化趋势 Figure 6 Changing trends of disease burden of acute hepatitis C in China, 1990-2019 |
丙型病毒性肝炎相关慢性肝病的标化发病率在30年间为(5~6)/10万,标化患病率则波动较大,从1990年的2 139/10万下降至2005年的759/10万,之后进入10年波动不明显的平台期;随后从2015年的753/10万迅速升高至2019年的1 247/10万,女性均高于男性;标化DALY率则呈总体下降趋势,1990、2019年分别为143/10万、65/10万,男性均高于女性。见图 7。
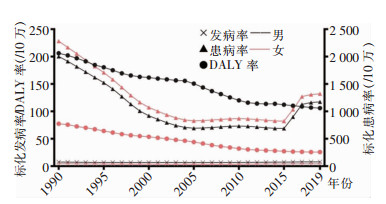 |
| 图 7 1990—2019年中国丙型病毒性肝炎相关慢性肝病疾病负担变化趋势 Figure 7 Changing trends of disease burden of hepatitis C-related chronic liver disease in China, 1990-2019 |
丙型病毒性肝炎相关肝癌的标化发病率、标化患病率、标化DALY率在30年间的变化趋势较为一致,1990—1995年均逐年上升,之后10年明显下降,2005年后波动较为平缓,2019年,以上指标依次为1.8/10万、2.1/10万、35.1/10万。见图 8。
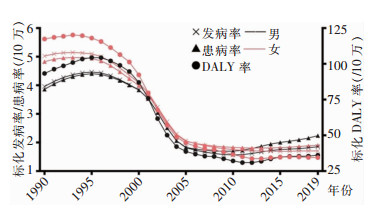 |
| 图 8 1990—2019年中国丙型病毒性肝炎相关肝癌疾病负担变化趋势 Figure 8 Changing trends of disease burden of hepatitis C-related liver cancer in China, 1990-2019 |
丙型病毒性肝炎主要通过血液和母婴传播。HCV感染后,多数人会处于一种长期、慢性感染状态,一般无自觉症状,而当症状出现时,常是肝病晚期的征兆,故HCV被称为“沉默杀手”[1, 4];另外,HCV还可增加合并感染人类免疫缺陷病毒(HIV)[12]、促进多重感染者提早发生肝硬化、肝癌等的风险[13],但目前仍无针对HCV的疫苗。所以,预防HCV感染的最佳方法就是避免可能传播疾病的行为,同时治疗丙型病毒性肝炎现患者。
本研究结果可见,2019年我国急性丙型病毒性肝炎发病率接近全球平均水平[14],以新生儿为最高,据一项Meta分析显示,HCV的母婴传播率约5.8%[15];急性丙型病毒性肝炎如未及时治愈,则进展为慢性,故丙型病毒性肝炎相关慢性肝病患病率从<1岁组即开始上升,随着年龄的增长快速升高,15~19岁后增速放缓;DALY则从25~29岁开始迅速升高,可能因DALY是源于早死和失能程度的综合指标,而HCV感染的隐匿性使患者表现为无症状感染者,故并未对其生活与工作造成影响,失能权重系数为0;然而,HCV感染20~30年后,10%~20%患者进展为肝硬化,之后每年发生肝癌的风险为1%~5%、肝功能失代偿的风险为3%~6%,失代偿后,次年死亡风险则为15%~20%[4],55~59岁后,丙型病毒性肝炎相关慢性肝病发病率保持较低水平,但其患病率和DALY率却保持高位,这与慢性病的流行病学特征相一致。值得注意的是,女性慢性丙型病毒性肝炎患病率高于男性,与2010年美国调查[16]结论较为一致,而与丙型病毒性肝炎疾病自然史研究结果却不同,后者认为,与女性相比,男性是HCV发展为肝硬化的风险因素[4],可能与各研究资料来源不同有关,尚待更多证据支撑。
2019年,我国丙型病毒性肝炎相关肝癌的发病人数接近于患病人数,主要因肝癌患者生存期短。另外,我国学者曾对北方地区的肝癌研究表明,丙型病毒性肝炎相关肝癌占肝细胞癌比率不足10%[17],而本研究显示,其标化DALY率仍高达35/10万,提示丙型病毒性肝炎相关肝癌的疾病负担仍不容忽视。在丙型病毒性肝炎总负担中,标化YLL率占总标化DALY率的99%,表明丙型病毒性肝炎相关肝病所引起的疾病负担以缩短寿命为主。
从1990—2019年丙型病毒性肝炎相关肝病的总疾病负担变化趋势可知,标化发病率与标化患病率均在2015年达到波谷,之后4年连续升高,可能主要与DAA的推广应用有关,尤其是蛋白酶抑制剂索磷布韦联合NS5A抑制剂,改变了丙型病毒性肝炎患者的预后和治疗耐受性,将治愈率提高至95%以上[18],随后2种或3种DAA联合用药,进一步将丙型病毒性肝炎治愈率提高至98%[5],而且,不同靶点的抗病毒药物联合使用,将适应证从单基因型扩展至泛基因型[6, 19]。进而,因有效靶向药物的问世,诊疗机构对HCV感染的筛查力度增加,发现更多“沉默”患者,相应地,患者接受治疗的意愿提高,表现为标化发病率和标化患病率增加;另外,DAA可在8~12周内从病毒学上治愈大多数丙型病毒性肝炎患者[5],所以同期DALY表现为持续降低。
为此,国家九部门联合于2021年8月31日颁布了《消除丙型肝炎公共卫生危害行动工作方案(2021—2030年)》,明确了2030年丙型病毒性肝炎防治的工作要求和任务,与WHO目标一致[6]。本研究根据GHDx数据,评估了我国既往30年丙型病毒性肝炎的流行趋势,对于目前正在实施的丙型病毒性肝炎综合防控具有指导意义。我国学者制定了《中国丙型病毒性肝炎医院感染防控指南(2021年版)》[20];另外,笔者根据实践观察,认为还需要特别强调以下几点:①加大丙型病毒性肝炎诊疗方案的宣传力度,提高普通大众、尤其是重点人群(如吸毒人群)的知晓率;②提高基层(尤其是县、乡镇、村)卫生机构的药物可及性;③进一步降低药物费用,或开展专项项目,促进诊疗公平性。同时,笔者仍同意Stuart等[21]的观点,尽管DAA可以有效治疗多数丙型病毒性肝炎患者,但丙型病毒性肝炎作为传染病,要在世界范围内有效抑制其传播,仍需研制能够诱导对HCV感染产生保护性免疫的疫苗,尤其是对于接受DAA治疗后仍有再次复发风险的患者。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Cheney CP, Chopra S, Graham C. Hepatitis C[J]. Infect Dis Clin North Am, 2000, 14(3): 633-667. DOI:10.1016/S0891-5520(05)70125-2 |
| [2] |
李新芳, 张晓飞, 陈燕明, 等. 从我国HCV感染暴发事件探讨HCV经血传播感染的风险[J]. 中国感染控制杂志, 2017, 16(10): 969-970. Li XF, Zhang XF, Chen YM, et al. Evaluation on risk of blood-transmitted HCV infection through the outbreak of HCV infection in China[J]. Chinese Journal of Infection Control, 2017, 16(10): 969-970. DOI:10.3969/j.issn.1671-9638.2017.10.018 |
| [3] |
Roudot-Thoraval F. Epidemiology of hepatitis C virus infection[J]. Clin Res Hepatol Gastroenterol, 2021, 45(3): 101596. DOI:10.1016/j.clinre.2020.101596 |
| [4] |
Westbrook RH, Dusheiko G. Natural history of hepatitis C[J]. J Hepatol, 2014, 61(Suppl 1): S58-S68. |
| [5] |
Parlati L, Hollande C, Pol S. Treatment of hepatitis C virus infection[J]. Clin Res Hepatol Gastroenterol, 2021, 45(4): 101578. DOI:10.1016/j.clinre.2020.11.008 |
| [6] |
Lancaster K, Rhodes T, Rance J. "Towards eliminating viral hepatitis": examining the productive capacity and constitutive effects of global policy on hepatitis C elimination[J]. Int J Drug Policy, 2020, 80: 102419. DOI:10.1016/j.drugpo.2019.02.008 |
| [7] |
Mei X, Lu HZ. Prevalence, diagnosis, and treatment of hepatitis C in Mainland China[J]. Glob Health Med, 2021, 3(5): 270-275. DOI:10.35772/ghm.2021.01080 |
| [8] |
中联肝健康促进中心, 中华医学会肝病学分会, 中华医学会检验医学分会, 等. 中国丙型病毒性肝炎院内筛查管理流程(试行)[J]. 中华肝脏病杂志, 2021, 29(4): 319-325. China Liver Health, Chinese Society of Hepatology of Chinese Medical Association, Chinese Society of Laboratory Medicine of Chinese Medical Association, et al. In-hospital process for viral hepatitis C screening and management in China (draft)[J]. Chinese Journal of Hepatology, 2021, 29(4): 319-325. DOI:10.3760/cma.j.cn501113-20210401-00157 |
| [9] |
刘孟嘉, 陈文, 蒋虹丽. 消除丙型肝炎的全球进展[J]. 中国卫生资源, 2020, 23(1): 43-48. Liu MJ, Chen W, Jiang HL. Global progress in eliminating hepatitis C[J]. Chinese Health Resources, 2020, 23(1): 43-48. DOI:10.3969/j.issn.1007-953X.2020.01.009 |
| [10] |
Li MY, Zhuang H, Wei L. How would China achieve WHO's target of eliminating HCV by 2030?[J]. Expert Rev Anti Infect Ther, 2019, 17(10): 763-773. DOI:10.1080/14787210.2019.1675509 |
| [11] |
GBD 2019 Risk Factors Collaborators. Global burden of 87 risk factors in 204 countries and territories, 1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2020, 396(10258): 1223-1249. DOI:10.1016/S0140-6736(20)30752-2 |
| [12] |
Ramachandran S, Thai H, Forbi JC, et al. A large HCV transmission network enabled a fast-growing HIV outbreak in rural Indiana, 2015[J]. EBioMedicine, 2018, 37: 374-381. DOI:10.1016/j.ebiom.2018.10.007 |
| [13] |
Sebastiani G, Gkouvatsos K, Pantopoulos K. Chronic hepatitis C and liver fibrosis[J]. World J Gastroenterol, 2014, 20(32): 11033-11053. DOI:10.3748/wjg.v20.i32.11033 |
| [14] |
Zeng YD, Li JM, Lin S, et al. Global burden of acute viral hepatitis and its association with socioeconomic development status, 1990-2019[J]. J Hepatol, 2021, 75(3): 547-556. DOI:10.1016/j.jhep.2021.04.035 |
| [15] |
Benova L, Mohamoud YA, Calvert C, et al. Vertical transmission of hepatitis C virus: systematic review and Meta-analy-sis[J]. Clin Infect Dis, 2014, 59(6): 765-773. DOI:10.1093/cid/ciu447 |
| [16] |
Hall EW, Rosenberg ES, Sullivan PS. Estimates of state-level chronic hepatitis C virus infection, stratified by race and sex, United States, 2010[J]. BMC Infect Dis, 2018, 18(1): 224. DOI:10.1186/s12879-018-3133-6 |
| [17] |
Wang MJ, Wang YT, Feng XS, et al. Contribution of hepatitis B virus and hepatitis C virus to liver cancer in China north areas: experience of the Chinese National Cancer Center[J]. Int J Infect Dis, 2017, 65: 15-21. DOI:10.1016/j.ijid.2017.09.003 |
| [18] |
Pol S, Bourliere M, Lucier S, et al. Safety and efficacy of daclatasvir-sofosbuvir in HCV genotype 1-mono-infected patients[J]. J Hepatol, 2017, 66(1): 39-47. DOI:10.1016/j.jhep.2016.08.021 |
| [19] |
童叶萌, 李盏, 蔡昆, 等. 丙型肝炎治疗药物研究进展[J]. 药物流行病学杂志, 2019, 28(7): 468-471. Tong YM, Li Z, Cai K, et al. Progress in research on therapeutic drugs for hepatitis C[J]. Chinese Journal of Pharmacoepidemiology, 2019, 28(7): 468-471. |
| [20] |
中华预防医学会医院感染控制分会, 中华医学会感染病学分会, 中华预防医学会感染性疾病防控分会. 中国丙型病毒性肝炎医院感染防控指南(2021年版)[J]. 中国感染控制杂志, 2021, 20(6): 487-493. Healthcare-associated Infection Control Branch of Chinese Preventive Medicine Association, Infectious Disease Branch of Chinese Preventive Medicine Association, Infectious Disease Prevention and Control Branch of Chinese Preventive Medicine Association. Chinese guideline for the prevention and control of hepatitis C virus healthcare-associated infection (2021 edition)[J]. Chin J Infect Control, 2021, 20(6): 487-493. |
| [21] |
Stuart JD, Salinas E, Grakoui A. Immune system control of hepatitis C virus infection[J]. Curr Opin Virol, 2021, 46: 36-44. DOI:10.1016/j.coviro.2020.10.002 |



