2. 宁夏医科大学总医院医学实验中心, 宁夏 银川 750004;
3. 宁夏病原微生物重点实验室, 宁夏 银川 750004
2. Laboratory Medical Center, General Hospital of Ningxia Medical University, Yinchuan 750004, China;
3. Ningxia Key Laboratory of Clinical and Pathogenic Microbiology, Yinchuan 750004, China
肠杆菌目细菌主要存在于人类肠道中,是医院和社区获得性感染的重要病原菌,可引起尿路感染、呼吸道感染和脓毒症等多种疾病。近年来,随着抗菌药物的广泛使用,肠杆菌目细菌耐药率不断上升,其中耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales, CRE)的增加尤为明显。CRE指对亚胺培南、美罗培南、多利培南(MIC≥4 μg/mL)或厄他培南(MIC≥2 μg/mL)等任何一种碳青霉烯类药物耐药的肠杆菌目细菌,以肺炎克雷伯菌和大肠埃希菌为主,这些细菌能够产生不同种类的碳青霉烯酶,水解多种抗生素[1]。新德里金属-β-内酰胺酶(New Delhi metallo-β-lactamase,NDM)自2008年在印度首次发现至今已产生33种变异体[2-4]。携带blaNDM基因的细菌被称为“超级细菌”,其出现加大了临床治疗难度,引起公众关注,给公共卫生带来极大隐患与威胁。
本研究调查宁夏医科大学总医院2018年1月—2021年5月临床分离CRE的临床分布、标本来源、耐药率、耐药基因及传播情况等,并对分离获得的大肠埃希菌耐药性及同源性进行分析, 为临床患者的诊断和治疗提供参考依据。
1 材料与方法 1.1 材料 1.1.1 菌株来源收集2018年1月—2021年5月宁夏某医院住院患者感染的CRE非重复菌株158株。
1.1.2 仪器与试剂Vitek 2 Compact全自动微生物分析仪(法国生物梅里埃公司),二氧化碳培养箱(HEAL FORCE),梯度PCR仪(Eppendorf),多色荧光凝胶成像系统(BIO-RAD),生物安全柜(Telstar), 高性能干溶器(QBD4-Grant),药敏纸片(OXOID),Taq2 PCR Master Mix(Takara),DNA marker(Takara),电泳槽(BIO-RAD),高压水平电泳仪(BIO-RAD),LB液体培养基(Solarbio),MH琼脂平板(babio)。
1.2 方法 1.2.1 细菌培养与鉴定采用Vitek 2 Compact全自动微生物分析仪鉴定细菌并进行药敏试验,根据2020年美国临床和实验室标准化协会(CLSI)M100第30版标准筛选对亚胺培南或美罗培南耐药的肠杆菌目细菌。
1.2.2 耐药基因检测水煮法制备细菌DNA,聚合酶链式反应(PCR)扩增超广谱β-内酰胺酶(ESBLs)基因(blaSHV和blaTEM)和碳青霉烯酶基因(blaKPC、blaOXA-48、blaNDM、blaIMP)。
PCR反应条件:94℃预变性5 min; 94℃变性30 s, 退火30 s, 72℃延伸45 s(30个循环);72℃再延伸5 min。引物序列与退火温度见表 1。
| 表 1 耐药基因引物序列、退火温度及扩增产物片段大小 Table 1 Primer sequences, annealing temperature, and size of amplified products of drug resistance genes |

|
其中,NDM基因的PCR阳性扩增产物送上海生工生物工程公司测序,NCBI比对分析确认NDM基因亚型。
1.2.3 碳青霉烯酶表型检测根据CLSI 2020年M100第30版标准中改良碳青霉烯灭活试验操作流程,对耐碳青霉烯类大肠埃希菌进行改良碳青霉烯灭活试验(modified carbapenem inactivation method, mCIM)联合EDTA改良碳青霉烯灭活试验(EDTA-modified carbapenem inactivation me-thod,eCIM)。
1.2.4 质粒接合试验参考文献[5-6]的方法并对部分步骤改良:将大肠埃希菌J53AZR(受体菌)和产NDM酶的耐碳青霉烯类大肠埃希菌(供体菌)分别接种于MH琼脂平板,活化好菌株后振摇培养至一定浓度,之后将受、供体菌按4∶1的比例混合于LB液体培养基中,37℃静置过夜。16 h后取100 μL均匀涂布于含2 μg/mL美罗培南和100 mg/L叠氮钠的MH平板,CO2孵箱过夜,细菌生长即为接合试验成功。
1.2.5 多位点序列分型(MLST)依据MLST网站提供的引物序列扩增耐碳青霉烯类大肠埃希菌的7对管家基因(adk-fumC-gyrB-icd-mdh-purA-recA),扩增产物送华大测序,在MLST网站上比对结果,获得细菌相应的ST型,使用BioNumerics 8.0软件对耐碳青霉烯类大肠埃希菌进行亲缘关系分析。
2 结果 2.1 菌株的科室分布与标本类型共收集158株CRE,主要分离自ICU(36株,22.78%),其次是烧伤整形科(30株,18.99%),新生儿科(18株,11.39%),肝胆外科(18株,11.39%),急诊科(10株,6.33%),血液科(5株,3.16%)和其余21个科室(共41株,25.95%)。
菌株的标本类型主要为痰(43株,27.22%)、脓性分泌物(28株,17.72%)、引流液(21株,13.29%)、无菌中段尿(17株,10.76%)和静脉血(16株,10.13%),其余11种标本共33株(20.89%)。
2.2 菌种检出情况158株CRE主要为肺炎克雷伯菌61株(38.61%),其次是阴沟肠杆菌37株(23.42%),大肠埃希菌23株(14.56%), 摩氏摩根菌10株(6.33%),奇异变形杆菌和黏质沙雷菌各9株(5.69%),其他CRE共9株(5.69%)。
2.3 CRE药敏情况CRE对9种抗菌药物的耐药率≥50%,对亚胺培南耐药率达100%,对美罗培南耐药率达73.13%(98/134)。见表 2。
| 表 2 CRE对抗菌药物耐药率 Table 2 Antimicrobial resistance of CRE |
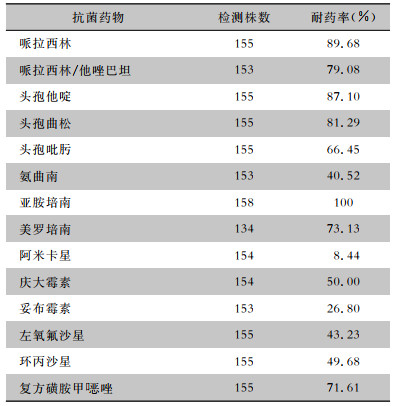
|
158株CRE中4种碳青霉烯酶基因blaNDM、blaOXA-48、blaKPC和blaIMP的检出率分别为78.48%、32.28%、8.23%、5.69%。携带blaNDM基因的菌株中,携带blaNDM-1、blaNDM-5和blaNDM-9基因的菌株分别为30、92、2株。51.90%的菌株携带ESBLs基因。同时携带blaNDM基因和其他耐药基因的菌株共77株,其中29株同时携带2种耐药基因,29株同时携带3种耐药基因,11株同时携带4种耐药基因,8株同时携带5种耐药基因。见表 3。
| 表 3 158株CRE耐药基因检出情况 Table 3 Detection result of drug resistance genes of 158 CRE strains |
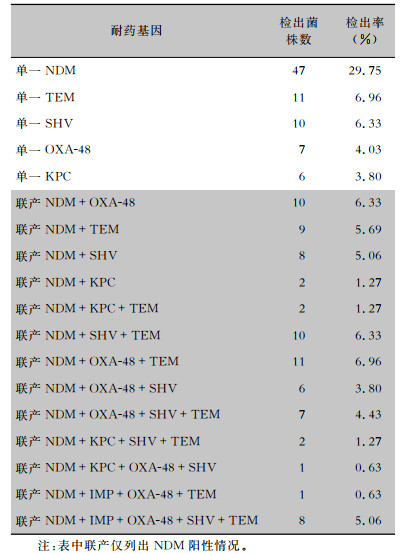
|
23株耐碳青霉烯类大肠埃希菌中22株(95.65%)产金属酶,1株(4.35%)碳青霉烯酶阴性。
2.6 blaNDM水平转移情况质粒接合试验显示,20株产NDM金属酶大肠埃希菌中共15株菌质粒成功转移,接合子经质谱鉴定为大肠埃希菌,采用PCR检测接合子blaNDM基因。K-B法药敏试验表明接合子对亚胺培南、美罗培南和头孢吡肟等具有耐药性。
2.7 大肠埃希菌MLST结果将管家基因测序结果提交至MLST数据库比对,结果显示23株大肠埃希菌依据MLST分析共鉴定出14种ST分型,以ST10和ST410型为主,分别为5株(21.74%)、4株(17.39%),其次为ST93(2株)和ST95(2株),ST90、ST162、ST167、ST209、ST648、ST693、ST848、ST2705、ST6050和ST12686各检出1株。聚类分析见图 1,最小生成树见图 2。
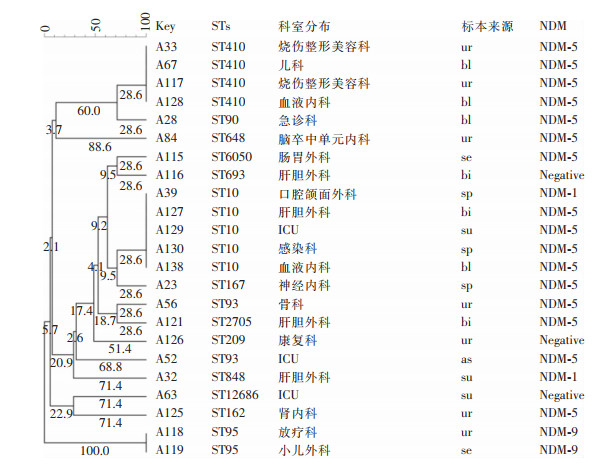 |
| 注:ur为尿,bl为静脉血,se为脓性分泌物,bi为胆汁,su为引流液,sp为痰,as为脓液。 图 1 23株大肠埃希菌MLST聚类分析图 Figure 1 MLST cluster analysis of 23 strains of Escherichia coli |
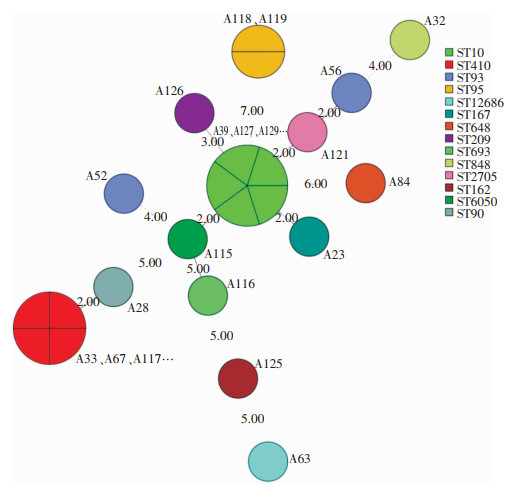 |
| 图 2 23株大肠埃希菌最小聚类树 Figure 2 Minimum cluster tree of 23 strains of Escherichia coli |
CRE因感染治疗难度大、病死率高、传播快和数量多等因素备受关注,其耐药问题已成为全球公共健康领域的重大挑战之一[7]。过去十年中,CRE已成为导致医院感染,尤其是ICU感染,最常见的病原体之一[8]。本研究显示,ICU和烧伤整形美容科患者是医院CRE感染的高危人群,长期住院、大量广谱抗菌药物的使用都可能是导致ICU患者CRE感染的主要原因。在本研究中,2018—2021年5月每年分别检出CRE 45株(28.48%)、15株(9.49%)、79株(50.00%)及19株(12.03%), 其中肺炎克雷伯菌是主要病原体,第二、三位分别是阴沟肠杆菌和大肠埃希菌,三者占所有CRE分离株的76.58%(121/158),与Zhang等[9]的结果一致。分离株标本来源以痰为主,其次为脓性分泌物与引流液。不同标本中检出的CRE种类有所不同,痰标本中主要为肺炎克雷伯菌,而脓性分泌物和引流液则以大肠埃希菌为主。158株CRE对亚胺培南敏感率为0,对头孢类抗生素耐药率均超过80%。
在肠杆菌目细菌中许多类型的碳青霉烯酶和ESBLs已广泛存在并传播,对公众健康造成极大威胁。CRE耐药性主要归因于产碳青霉烯酶,肠杆菌目中最常见的碳青霉烯酶基因有blaKPC、blaNDM、blaVIM、blaIMP和blaOXA-48等[10]。其中NDM金属酶属于B类β-内酰胺酶,能水解除氨曲南以外的几乎所有β-内酰胺类抗生素。自2008年首次分离并报道携带blaNDM的肺炎克雷伯菌以来,迄今为止已发现33种blaNDM基因变异体[4],分子流行病学研究发现其变异体中主要以NDM-1型金属酶为主,近年来,研究[11-15]显示,blaNDM-5在中国和印度等国家越来越常见。本研究中分离的158株CRE携带的碳青霉烯酶基因以blaNDM为主,其中blaNDM-5最多,blaNDM-1次之。研究结果表明,该院CRE中blaNDM基因的存在已非常普遍。除此之外,还首次在该地区检出产NDM-9金属酶的大肠埃希菌。2011年中国首次报道携带blaNDM-1的大肠埃希菌,随后发现耐碳青霉烯类大肠埃希菌中产NDM金属酶的菌株分离率较高[16]。本研究中的23株耐碳青霉烯类大肠埃希菌,20株检出blaNDM基因,分别为blaNDM-1、blaNDM-5和blaNDM-9。NDM-5金属酶和NDM-9金属酶在NDM-1金属酶的基础上分别通过第88位(缬氨酸→亮氨酸)和152位(甘氨酸→赖氨酸)氨基酸位点的突变,使其水解活性增强[2]。可能是由于突变的单个氨基酸会影响NDM蛋白的二级结构和三级结构, 从而改变NDM与底物即β-内酰胺类抗生素的结合特性, 进而表现出不同的水解能力[17],但具体机制有待进一步研究。研究[2, 18-19]表明,NDM-5酶和NDM-9酶对除氨曲南外的所有β-内酰胺类药物的酶活性均高于NDM-1酶,其对美罗培南、亚胺培南、头孢西丁和头孢噻肟的水解活性和亲和力略增高。该院NDM酶亚型逐渐变化,还应持续监测其耐药性变化,及时发现新亚型,防止某一亚型在CRE中传播与暴发。
质粒接合试验结果显示,三种类型的blaNDM基因均可通过质粒进行水平转移与传播。研究[20]发现,绝大多数blaNDM基因位于IncF、IncA/C、IncL/M、IncH、IncN和IncX3等20种不同类型的质粒上,能随着质粒的自我复制在细菌间接合转移,引起blaNDM基因快速而广泛地传播,产NDM酶的菌株愈发增多。在中国的几个地区已经发现了由携带blaNDM基因细菌引起的感染流行,表明blaNDM基因的高度可转移性和由blaNDM阳性微生物引起的感染严重性[21-23]。MLST结果表明,23株耐碳青霉烯类大肠埃希菌分别属于14种STs,其中以ST410和ST10为主要流行菌株,提示该院耐碳青霉烯类大肠埃希菌的克隆多样性。本研究中部分大肠埃希菌具有相同ST型,但其数量少,检出时间跨度大,未存在检出数显著增加的情况。此外,还发现科室分布距离远,标本类型不同,因此不满足临床感染流行的条件。但是医院仍应提高警惕,做好耐药菌的检测与监测工作,重视感染问题,合理治疗,避免造成更严重的后果。除ST209、ST693和ST12686外,多数大肠埃希菌携带blaNDM-5基因,仅ST95菌株携带blaBDN-9基因,1株ST10和ST848携带blaNDM-1基因,提示耐碳青霉烯类大肠埃希菌中NDM酶的多样性。医院应做好预防与检测工作,采取及时有效的措施,防止携带blaNDM基因的某一克隆株大肆流行。
CRE感染的发病率在世界范围内不断增加,携带blaNDM基因的细菌更是被称为“超级细菌”,因此医务人员应积极做好手卫生防止交叉感染,医院应加强感染防控措施的施行,严格执行医护人员与患者的卫生措施,做好消毒及防护管理[24]。同时,应对CRE和blaNDM基因进行监测,并采取有效的感染防控措施,给感染患者提供适当有效的治疗,以减缓各种CRE的流行和扩散。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
喻华, 徐雪松, 李敏, 等. 肠杆菌目细菌碳青霉烯酶的实验室检测和临床报告规范专家共识[J]. 中国感染与化疗杂志, 2020, 20(6): 671-680. Yu H, Xu XS, Li M, et al. Consensus statement on laboratory detection and clinical report of carbapenemases among Enterobacterales[J]. Chinese Journal of Infection and Chemothe-rapy, 2020, 20(6): 671-680. DOI:10.16718/j.1009-7708.2022.04.014 |
| [2] |
Wu WJ, Feng Y, Tang GM, et al. NDM metallo-β-lactamases and their bacterial producers in health care settings[J]. Clin Microbiol Rev, 2019, 32(2): e00115-18. |
| [3] |
Yong D, Toleman MA, Giske CG, et al. Characterization of a new metallo-beta-lactamase gene, blaNDM-1, and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India[J]. Antimicrob Agents Chemother, 2009, 53(12): 5046-5054. DOI:10.1128/AAC.00774-09 |
| [4] |
Wang T, Zhou Y, Zou CH, et al. Identification of a novel blaNDM variant, blaNDM-33, in an Escherichia coli isolate from hospital wastewater in China[J]. mSphere, 2021, 6(5): e0077621. DOI:10.1128/mSphere.00776-21 |
| [5] |
Yin CF, Yang WW, Lv YP, et al. Clonal spread of carbapene-mase-producing Enterobacteriaceae in a region, China[J]. BMC Microbiol, 2022, 22(1): 81. DOI:10.1186/s12866-022-02497-y |
| [6] |
Pecora N, Zhao XM, Nudel K, et al. Diverse vectors and mechanisms spread New Delhi metallo-β-lactamases among carbapenem-resistant Enterobacteriaceae in the greater Boston area[J]. Antimicrob Agents Chemother, 2019, 63(2): e02040-18. |
| [7] |
员静, 单斌, 孟雪斐, 等. 2018-2020年多中心耐碳青霉烯类肠杆菌目细菌的流行病学特征及耐药性分析[J]. 中国抗生素杂志, 2021, 46(11): 1038-1043. Yun J, Shan B, Meng XF, et al. Epidemiological characteristics and drug resistance analysis of multicenter carbapenem-resistant Enterobacterales from 2018 to 2020[J]. Chinese Journal of Antibiotics, 2021, 46(11): 1038-1043. DOI:10.3969/j.issn.1001-8689.2021.11.009 |
| [8] |
Gupta N, Limbago BM, Patel JB, et al. Carbapenem-resistant Enterobacteriaceae: epidemiology and prevention[J]. Clin Infect Dis, 2011, 53(1): 60-67. DOI:10.1093/cid/cir202 |
| [9] |
Zhang YW, Wang Q, Yin YY, et al. Epidemiology of carbapenem-resistant Enterobacteriaceae infections: report from the China CRE network[J]. Antimicrob Agents Chemother, 2018, 62(2): e01882-17. |
| [10] |
Albiger B, Glasner C, Struelens MJ, et al. Carbapenemase-producing Enterobacteriaceae in Europe: assessment by national experts from 38 countries, May 2015[J]. Euro Surveill, 2015, 20(45): 30062. |
| [11] |
Gajamer VR, Bhattacharjee A, Paul D, et al. Escherichia coli encoding blaNDM-5 associated with community-acquired urinary tract infections with unusual MIC creep-like phenomenon against imipenem[J]. J Glob Antimicrob Resist, 2018, 14: 228-232. DOI:10.1016/j.jgar.2018.05.004 |
| [12] |
Aung MS, San N, Maw WW, et al. Prevalence of extended-spectrum beta-lactamase and carbapenemase genes in clinical isolates of Escherichia coli in Myanmar: dominance of blaNDM-5 and emergence of blaOXA-181[J]. Microb Drug Resist, 2018, 24(9): 1333-1344. DOI:10.1089/mdr.2017.0387 |
| [13] |
Bi RR, Kong ZY, Qian HM, et al. High prevalence of blaNDM variants among carbapenem-resistant Escherichia coli in nor-thern Jiangsu province, China[J]. Front Microbiol, 2018, 9: 2704. DOI:10.3389/fmicb.2018.02704 |
| [14] |
Giufrè M, Errico G, Accogli M, et al. Emergence of NDM-5-producing Escherichia coli sequence type 167 clone in Italy[J]. Int J Antimicrob Agents, 2018, 52(1): 76-81. DOI:10.1016/j.ijantimicag.2018.02.020 |
| [15] |
Lee CR, Lee JH, Park KS, et al. Global dissemination of carbapenemase-producing Klebsiella pneumoniae: epidemiology, genetic context, treatment options, and detection methods[J]. Front Microbiol, 2016, 7: 895. |
| [16] |
Wang Q, Wang XJ, Wang J, et al. Phenotypic and genotypic characterization of carbapenem-resistant Enterobacteriaceae: data from a longitudinal large-scale CRE study in China (2012-2016)[J]. Clin Infect Dis, 2018, 67: S196-S205. DOI:10.1093/cid/ciy660 |
| [17] |
傅芬蕊, 张娅, 潘玉红, 等. 产新德里金属β-内酰胺酶大肠埃希菌耐碳青霉烯类药物相关机制研究和分子分型[J]. 中国人兽共患病学报, 2021, 37(1): 53-59. Fu FR, Zhang Y, Pan YH, et al. Carbapenem-resistance mechanisms and molecular typing of Escherichia coli producing New Delhi metal β-lactamase[J]. Chinese Journal of Zoonoses, 2021, 37(1): 53-59. |
| [18] |
Di DYW, Jang J, Unno T, et al. Emergence of Klebsiella variicola positive for NDM-9, a variant of New Delhi metallo-β-lactamase, in an urban river in South Korea[J]. J Antimicrob Chemother, 2017, 72(4): 1063-1067. |
| [19] |
Ali A, Gupta D, Srivastava G, et al. Molecular and computational approaches to understand resistance of New Delhi meta-llo β-lactamase variants (NDM-1, NDM-4, NDM-5, NDM-6, NDM-7)-producing strains against carbapenems[J]. J Biomol Struct Dyn, 2019, 37(8): 2061-2071. DOI:10.1080/07391102.2018.1475261 |
| [20] |
余艳, 刘淑敏, 杜艳. 携带blaNDM-1基因阴沟肠杆菌研究进展[J]. 中国感染与化疗杂志, 2021, 21(2): 225-229. Yu Y, Liu SM, Du Y. Research progress of Enterobacter cloacae carrying blaNDM-1 gene[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(2): 225-229. |
| [21] |
Wang XJ, Xu XL, Li ZW, et al. An outbreak of a nosocomial NDM-1-producing Klebsiella pneumoniae ST147 at a teaching hospital in mainland China[J]. Microb Drug Resist, 2014, 20(2): 144-149. DOI:10.1089/mdr.2013.0100 |
| [22] |
Jin Y, Shao CH, Li J, et al. Outbreak of multidrug resistant NDM-1-producing Klebsiella pneumoniae from a neonatal unit in Shandong Province, China[J]. PLoS One, 2015, 10(3): e0119571. DOI:10.1371/journal.pone.0119571 |
| [23] |
Yu J, Tan K, Rong ZH, et al. Nosocomial outbreak of KPC-2- and NDM-1-producing Klebsiella pneumoniae in a neonatal ward: a retrospective study[J]. BMC Infect Dis, 2016, 16(1): 563. DOI:10.1186/s12879-016-1870-y |
| [24] |
张烨, 董方, 宋文琪, 等. 产NDM-1型碳青霉烯酶肺炎克雷伯菌儿童血流感染的临床特征及细菌耐药性分析[J]. 中国感染与化疗杂志, 2017, 17(5): 516-522. Zhang Y, Dong F, Song WQ, et al. Clinical characteristics and antimicrobial resistance of the bloodstream infections due to NDM-1 producing Klebsiella pneumoniae in children[J]. Chinese Journal of Infection and Chemotherapy, 2017, 17(5): 516-522. |




 唑
唑