2. 重庆市药物代谢研究重点实验室, 重庆 400016;
3. 中国人民解放军总医院第一医学中心血液病科, 北京 100853;
4. 中国人民解放军总医院医疗保障中心药剂科药物临床研究室, 北京 100853
2. Chongqing Key Laboratory of Drug Metabolism Research, Chongqing 400016, China;
3. Department of Hematology, First Medical Center, Chinese PLA General Hospital, Beijing 100853, China;
4. Center of Medicine Clinical Research, Department of Pharmacy, Medical Supplies Center, Chinese PLA General Hospital, Beijing 100853, China
由于免疫功能下降患者(包括中性粒细胞减少、感染人类免疫缺陷病毒、慢性免疫抑制、烧伤、糖尿病以及使用广谱抗菌药)日渐增多,导致侵袭性真菌病(invasive fungal diseases,IFD)的发病率逐年增加[1]。IFD是血液系统恶性肿瘤患者重要死亡原因之一,造血干细胞移植后IFD相关病死率高达50%,肺部是IFD主要侵犯部位[2]。由于早期临床诊断准确性低,真菌培养需要3~5 d才能获得结果[3],因此尽早开展抗真菌治疗以改善患者预后尤为重要。依据中国《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)》[4],血液病/恶性肿瘤患者推荐治疗IFD药物包括卡泊芬净、两性霉素B、伏立康唑、伊曲康唑、泊沙康唑等。目前用于临床的两性霉素B制剂包括两性霉素B脱氧胆酸盐(amphotericin B deoxycholate,d-AmB)、两性霉素B脂质复合体(amphotericin B lipid complex,ABLC)、两性霉素B胆固醇复合体(amphotericin B colloidal dispersion,ABCD)和两性霉素B脂质体(liposome amphotericin B,L-AmB)。因两性霉素B溶解度有限且口服生物利用度差,故所有制剂均为非肠道制剂,且具有较长半衰期,给药频次可以为1次/d[5]。为了解中国人民解放军总医院血液病科和造血干细胞移植病房罹患恶性血液病合并IFD的患者住院期间两性霉素B临床使用情况,分析患者临床资料,为指导恶性血液病患者两性霉素B的临床用药提供参考依据。
1 对象与方法 1.1 研究对象选择中国人民解放军总医院2021年1—12月血液病科和造血干细胞移植病房罹患恶性血液病合并IFD并使用两性霉素B治疗的住院患者为研究对象。纳入标准:血液病科和造血干细胞移植病房使用两性霉素B治疗的恶性血液病住院患者。排除标准:使用两性霉素B,但分层诊断时不具备至少1项的宿主因素(如:近期发生粒缺并持续10 d以上,接受异基因造血干细胞移植,既往应用糖皮质激素或免疫抑制剂,IFD感染病史,同时患有艾滋病或遗传性免疫缺陷)的患者。
1.2 收集资料采用回顾性研究方法,收集研究对象的人口学特征、影像学检查、真菌镜检/培养(送检标本包括静脉血、尿、粪便、痰、咽拭子等)、(1, 3)-β-D葡聚糖试验(G试验)、半乳甘露聚糖试验(GM试验)、两性霉素B药品的用法用量等资料。
1.3 IFD分层诊断依据《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)》[4]将IFD分为确诊、临床诊断、拟诊和未确定。确诊IFD即深部组织真菌感染标本镜检出霉菌或酵母菌;血液真菌培养结果为霉菌(曲霉菌除外)、念珠菌或其他酵母菌阳性,且临床症状及体征符合相关致病菌的感染。根据宿主因素、临床标准及微生物学标准判断临床诊断、拟诊和未确定IFD。临床诊断IFD为三项标准中每项至少具有1项,拟诊IFD为前两项标准至少具有1项,未确定IFD为仅宿主因素至少具有1项[4]。
1.4 评价方法用药物利用指数(drug utilization index, DUI)和用药频度(daily dose system, DDDs)评价患者抗真菌治疗药物使用情况。DUI=DDDs/实际用药天数,定义为使用某药的日剂量。一般认为DUI>1.00提示该药可能存在滥用,而DUI<1.00提示药物使用剂量偏低;一般认为DUI值越接近1.00剂量使用较为合理,0.9≤DUI≤1.1是判断用药剂量合理性的依据[6]。DDDs=某药用药总量/该药DDD值,表示某药使用频率。某药的DDDs越大,说明使用频率越高。限定日剂量(defined daily dose, DDD)以世界卫生组织(WHO)推荐为标准。
1.5 统计方法应用Excel表整理数据。
2 结果 2.1 基本情况共纳入131例患者,其中男性99例,女性32例。94例(71.76%)患者进行过胸部影像学检查,12例(12.76%)患者CT检查结果未见明显异常,结节影44例(46.81%),磨玻璃影28例(29.79%),实变影6例(6.38%)。G/GM试验阳性率分别为28.57%、13.45%。依据诊断标准,深部组织和血液中未培养出真菌,故无确诊IFD患者;131例患者均至少具有1项宿主因素,其中同时具有胸部CT和真菌实验室检查阳性的临床诊断IFD有26例(19.85%);同时具有胸部CT阳性的拟诊IFD有52例(39.69%);其余53例(40.46%)因分层诊断仅具有宿主因素而其他诊断标准为阴性,故为未确定IFD。见表 1。
| 表 1 131例恶性血液病合并IFD患者基本情况 Table 1 Basic information of 131 patients with malignant hematological diseases complicated with IFD |
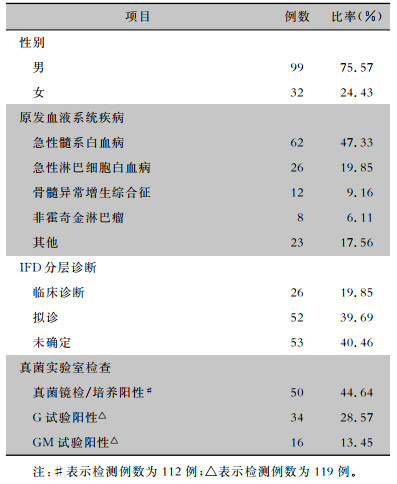
|
44.64%(50/112)患者真菌培养阳性,共培养真菌64株,以念珠菌居多(55株)。见表 2。
| 表 2 恶性血液病合并IFD患者真菌培养种类及标本来源 Table 2 Types of fungal culture and sources of specimens in patients with malignant hematological diseases and IFD |
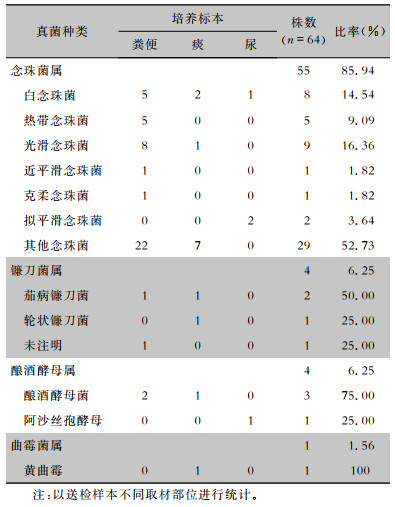
|
131例患者中111例患者使用d-AmB,61例患者以静脉滴注途径给药。13例患者使用0.9%氯化钠注射液作为溶媒,其中11例用于雾化吸入,2例用于静脉滴注(d-AmB和L-AmB各1例);55例患者使用地塞米松磷酸钠作为治疗前用药。见表 3。
| 表 3 131例恶性血液病合并IFD患者两性霉素B用法用量情况 Table 3 Usage and dosage of amphotericin B in 131 patients with malignant hematological diseases combined with IFD |
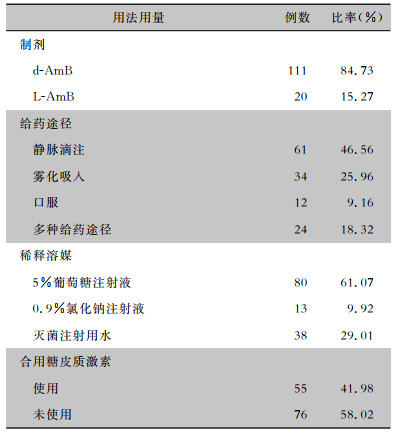
|
22例(16.79%)患者仅使用d-AmB或L-AmB单药治疗,109例(83.21%)患者使用联合治疗,联合方案中以d-AmB联合VRC最多(25.19%)。见表 4。
| 表 4 131例恶性血液病合并IFD患者抗真菌药用药情况 Table 4 Use of antifungal drugs in 131 patients with malignant hematological diseases combined with IFD |

|
用于静脉滴注和雾化吸入的d-AmB DUI值均<1.00,提示可能存在用量不足;用于静脉滴注的L-AmB DUI值为1.04,提示其用量合理。见表 5。
| 表 5 患者两性霉素B的DDDs和DUI Table 5 DDDs and DUI of amphotericin B in patients |
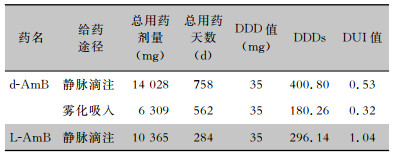
|
IFD治疗方案需考虑宿主因素、感染部位、辅助检查结果等因素。对尚未发生IFD的高危患者给予预防治疗,对持续粒细胞缺乏伴发热且广谱抗菌药治疗4~7 d无效的患者给予经验性治疗,对影像学或生物学检查阳性但未达到临床诊断或确诊的患者给予诊断驱动治疗,对临床诊断或确诊IFD的患者给予目标治疗。虽然辅助检查在诊疗过程中发挥重要作用,但也存在一定的局限性,如葡聚糖等成分在环境中的存在,易导致G试验出现假阳性结果;抗真菌药的经验性治疗会降低GM试验的敏感性和准确性[7-8];胸部CT的特征性改变(如伴或不伴晕征的病变、空气新月征、空洞、楔形和节段性或大叶性病灶)可以更好地区分是否为真菌性肺炎,却出现较晚,而早期患者则呈非特异性改变(如多发性肺结节、肿块、节段性或亚节段性实变、磨玻璃样阴影等)[4, 9-10];相比真菌培养诊断效能较好,但培养时间长,不宜作早期诊断[7],所以对于IFD高危患者尽早开展抗感染治疗尤为重要。
109例患者使用抗真菌药物联合用药,联合方案中以两性霉素B联合VRC最多(共38例,其中d-AmB+VRC为33例,L-AmB+VRC为5例)。《抗菌药物临床应用指导原则(2015年版)》[11]推荐的联合用药指征有:①包括免疫缺陷在内的病原菌未明的严重感染者;②单一抗菌药不能控制的严重感染;③长疗程,但病原菌易对某些抗菌药产生耐药性的感染,或病原菌含有不同生长特点的菌群;④毒性较大的药物。本研究中纳入的患者抗真菌药联用指征包括患者病情危重、长期使用免疫抑制剂、持续性高热、中性粒细胞长期减少、单药治疗失败或患者不能耐受其不良反应等,为扩大抗真菌覆盖范围和增强疗效从而启动联合治疗方案。由于d-AmB通过与真菌细胞膜中麦角固醇结合而发挥作用,而VRC干扰真菌细胞膜中麦角固醇的生物合成,故该联合策略存在争议。但研究[12]表明,因为两性霉素B对接合菌有效,VRC对两性霉素B耐药真菌有效(如毛孢子菌和一些酵母菌),所以对最广泛的病原菌有效。2例真菌培养为茄病镰刀菌的患者使用L-AmB联合VRC,该方案是临床治疗镰刀菌的首选。一项体外研究[13]表明,L-AmB与VRC联合作用于镰刀菌时产生协同作用,但在特定剂量下(L-AmB 0.5~4 mg/L,VRC 0.125~16 mg/L)却会产生拮抗作用。本研究观察到此3例患者在治疗期间联合4种抗真菌药,3例患者住院期间均出现持续低热的症状,其中1例患者是异基因造血干细胞移植术后伴肺部感染,真菌培养检出念珠菌和镰刀菌;1例患者为异基因造血干细胞移植术后,骨髓异常增生伴肺部感染,多次G/GM试验为阳性;1例患者住院时长(63 d)大于中位住院时长(34 d)且长期使用免疫抑制剂,以上3例患者均有联合用药指征。
两性霉素B最常见的不良反应包括肾毒性、低钾血症和输液相关不良反应。虽然两性霉素B的各种制剂对IFD的疗效没有差异,但含脂制剂能减少不良反应的发生[14]。一项荟萃分析[15]结果表明,接受d-AmB治疗的患者输液相关不良反应事件>65%,肾毒性发生率为12%~50%;然而,使用两性霉素B含脂制剂治疗的患者,不良反应事件的发生率为20%~40%,肾毒性发生率为9%~25%,不良反应的发生率仅为d-AmB报告的一半;L-AmB无论在药物相关不良反应还是防止突破性真菌感染方面都优于d-AmB [14]。本研究中,使用d-AmB治疗的患者数量高于L-AmB,可能与d-AmB比L-AmB更经济有关。本组55例(41.98%)患者在使用两性霉素B各种制剂的同时合并使用了小剂量地塞米松磷酸钠,2008年研究[16]表明,使用糖皮质激素作为治疗前用药可以预防急性不良事件的发生;但2021年研究[17]发现,无论是两性霉素B的何种制剂,是否给予治疗前用药,输液相关不良反应发生率都是相似的。由于此次纳入的患者大多并非首次入院,基础疾病多且较重,不能确定肾功能不全或电解质紊乱是药物还是基础疾病引起,故本研究未分析患者不良反应事件。
两性霉素B的给药途径除静脉滴注外,还可雾化吸入、经气管镜给药和鞘内注射。两性霉素B随氧气雾化吸入到肺部,使肺内药物浓度增加从而发挥治疗作用。本组55例患者雾化吸入d-AmB,其中21例联合其他给药途径。研究[18]表明,雾化给药有助于预防造血干细胞或实体器官移植接收者、接受强化化学治疗的恶性肿瘤患者,以及其他免疫抑制患者侵袭性曲霉病。本组12例患者单独采取口服给药途径,4例患者采取口服联合其他给药途径;此16例患者中有15例(93.75%)患者在粪便涂片中检出真菌病原菌或真菌孢子,尽管两性霉素B口服生物利用度差,但可以利用这一特性来消除患者肠道中的真菌。制霉菌素是口服多烯类抗真菌药,与两性霉素B一样具有口服生物利用度差的特点。制霉菌素在根除和防止直肠念珠菌定植方面优于两性霉素B,但不推荐用于患有中性粒细胞减少的患者[19-20]。本研究主要针对恶性血液病患者,大多伴有中性粒细胞减少或缺乏,故清除肠道真菌选用口服两性霉素B。对于两性霉素B的口服制剂,现已研究了如纳米颗粒、碳纳米管、纳米悬浮液、乳液、脂质卷等各种口服给药载体以克服两性霉素B口服生物利用度差的缺点,但目前还未上市[21-22]。
本研究中有2例患者使用0.9%氯化钠作为溶媒溶解两性霉素B进行静脉滴注。0.9%氯化钠虽然是临床应用中最常见的溶媒,但用其作为溶媒溶解d-AmB时会产生沉淀,影响药效甚至产生毒副作用。d-AmB易溶于5%葡萄糖溶液,但对5%葡萄糖溶液的pH值有一定要求(pH>4.2),《中国药典(2020年版)》规定临床使用5%葡萄糖溶液的pH值为3.2~6.5。研究[23]表明,选择不同pH值的5%葡萄糖溶液对d-AmB稳定性影响也不同,研究者们发现使用pH<4.2的5%葡萄糖溶液配制且放置1 h后出现不溶性杂质,且d-AmB的含量下降明显,并随放置时间的延长,产生的杂质增多,主药含量低于59.40%,已不能供临床使用。输注两性霉素B需要在避光条件下进行,一般选用避光袋和避光输液器,如果在输注过程中产生沉淀则不容易被观察到,故两性霉素B溶媒的选择至关重要。
综上所述,本研究回顾性分析了2021年中国人民解放军总医院血液科和造血干细胞移植病房罹患恶性血液病合并IFD使用两性霉素B治疗的患者资料,认为两性霉素B在合理应用,溶媒的选择、抗真菌药物联合或更换方面有待提高。虽然两性霉素B早已用于临床治疗,但不良反应较重且多见,故在临床实践中还需临床药师对两性霉素B的应用进行干预,促进合理用药,减低毒副作用。本研究未收集患者用药期间不良反应事件,是本研究存在的局限性,今后需要深入研究。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Sanguinetti M, Posteraro B, Beigelman-Aubry C, et al. Diagnosis and treatment of invasive fungal infections: looking ahead[J]. J Antimicrob Chemother, 2019, 74(Suppl 2): ii27-ii37. |
| [2] |
Sun YQ, Meng FY, Han MZ, et al. Epidemiology, management, and outcome of invasive fungal disease in patients undergoing hematopoietic stem cell transplantation in China: a multicenter prospective observational study[J]. Biol Blood Marrow Transplant, 2015, 21(6): 1117-1126. DOI:10.1016/j.bbmt.2015.03.018 |
| [3] |
Chen XC, Wang JX, Wang SB, et al. Real-world assessment of the effectiveness of posaconazole for the prophylaxis and treatment of invasive fungal infections in hematological patients: a retrospective observational study[J]. Medicine (Baltimore), 2021, 100(30): e26772. DOI:10.1097/MD.0000000000026772 |
| [4] |
中国医师协会血液科医师分会, 中国侵袭性真菌感染工作组. 血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第六次修订版)[J]. 中华内科杂志, 2020, 59(10): 754-763. Chinese Association Hematologists, Chinese Invasive Fungal Infection Working Group. The Chinese guidelines for the diagnosis and treatment of invasive fungal disease in patients with hematological disorders and cancers (the 6th revision)[J]. Chinese Journal of Internal Medicine, 2020, 59(10): 754-763. DOI:10.3760/cma.j.cn112138-20200627-00624 |
| [5] |
Nett JE, Andes DR. Antifungal agents: spectrum of activity, pharmacology, and clinical indications[J]. Infect Dis Clin North Am, 2016, 30(1): 51-83. DOI:10.1016/j.idc.2015.10.012 |
| [6] |
曹季平. 基于《社区获得性肺炎诊断和治疗指南(2016版)》对医院成人CAP患者抗菌药物使用的相关因素分析[J]. 抗感染药学, 2020, 17(3): 323-327. Cao JP. Analysis of relevant factor of antibiotic medication in adult patients with CAP in hospital based on "Guidelines of CAP 2016 Edition"[J]. Anti-Infection Pharmacy, 2020, 17(3): 323-327. DOI:10.13493/j.issn.1672-7878.2020.03-005 |
| [7] |
钱柯羽, 吕全省, 戴丽君, 等. G及GM试验在急性白血病合并侵袭性真菌病中的诊断价值[J]. 中国实验血液学杂志, 2019, 27(5): 1678-1681. Qian KY, Lv QS, Dai LJ, et al. Diagnostic value of G and GM tests in acute leukemia patients with invasive fungal di-sease[J]. Journal of Experimental Hematology, 2019, 27(5): 1678-1681. DOI:10.19746/j.cnki.issn1009-2137.2019.05.049 |
| [8] |
李航, 方文捷, 熊林, 等. 侵袭性真菌感染早期诊断技术的研究进展[J]. 菌物学报, 2019, 38(2): 151-158. Li H, Fang WJ, Xiong L, et al. Research progress on early diagnosis of invasive fungal infection[J]. Mycosystema, 2019, 38(2): 151-158. |
| [9] |
Alexander BD, Lamoth F, Heussel CP, et al. Guidance on imaging for invasive pulmonary aspergillosis and mucormycosis: From the imaging working group for the revision and update of the consensus definitions of fungal disease from the EORTC/MSGERC[J]. Clin Infect Dis, 2021, 72(Suppl 2): S79-S88. |
| [10] |
Donnelly JP, Chen SC, Kauffman CA, et al. Revision and update of the consensus definitions of invasive fungal disease from the European organization for research and treatment of cancer and the mycoses study group education and research consortium[J]. Clin Infect Dis, 2020, 71(6): 1367-1376. DOI:10.1093/cid/ciz1008 |
| [11] |
《抗菌药物临床应用指导原则》修订工作组. 抗菌药物临床应用指导原则(2015年版)[M]. 北京: 人民卫生出版社, 2015. The revised working group from clinical application of antibacterial drugs guiding principles. Clinical application of antibacterial drugs guiding priciple (2015)[M]. Beijing: People's Medical Publishing House, 2015. |
| [12] |
Qiu KY, Liao XY, Fang JP, et al. Combination antifungal treatment for invasive fungal disease after hematopoietic stem cell transplantation in children with hematological disorders[J]. Transpl Infect Dis, 2019, 21(3): e13066. DOI:10.1111/tid.13066 |
| [13] |
Vikelouda K, Simitsopoulou M, Skoura L, et al. Activity of amphotericin B formulations and voriconazole, alone or in combination, against biofilms of Scedosporium and Fusarium spp[J]. Antimicrob Agents Chemother, 2021, 65(11): e0063821. DOI:10.1128/AAC.00638-21 |
| [14] |
Hamill RJ. Amphotericin B formulations: a comparative review of efficacy and toxicity[J]. Drugs, 2013, 73(9): 919-934. DOI:10.1007/s40265-013-0069-4 |
| [15] |
Steimbach LM, Tonin FS, Virtuoso S, et al. Efficacy and safety of amphotericin B lipid-based formulations-a systematic review and Meta-analysis[J]. Mycoses, 2017, 60(3): 146-154. DOI:10.1111/myc.12585 |
| [16] |
Paterson DL, David K, Mrsic M, et al. Pre-medication practices and incidence of infusion-related reactions in patients receiving AMPHOTEC: data from the patient registry of amphotericin B cholesteryl sulfate complex for injection clinical tolerability (PRoACT) registry[J]. J Antimicrob Chemother, 2008, 62(6): 1392-1400. DOI:10.1093/jac/dkn394 |
| [17] |
Scardina T, Fawcett AJ, Patel SJ. Amphotericin-associated infusion-related reactions: a narrative review of pre-medications[J]. Clin Ther, 2021, 43(10): 1689-1704. DOI:10.1016/j.clinthera.2021.09.011 |
| [18] |
Xia D, Sun WK, Tan MM, et al. Aerosolized amphotericin B as prophylaxis for invasive pulmonary aspergillosis: a Meta-analysis[J]. Int J Infect Dis, 2015, 30: 78-84. |
| [19] |
Johansen HK, Gøtzsche PC. Amphotericin B versus fluconazole for controlling fungal infections in neutropenic cancer patients[J]. Cochrane Database Syst Rev, 2014, 2014(9): CD000239. |
| [20] |
Wittekamp BH, Ong DSY, Cremer OL, et al. Nystatin versus amphotericin B to prevent and eradicate Candida colonization during selective digestive tract decontamination in critically ill patients[J]. Intensive Care Med, 2015, 41(12): 2235-2236. |
| [21] |
Kaur K, Kumar P, Kush P. Amphotericin B loaded ethyl cellulose nanoparticles with magnified oral bioavailability for safe and effective treatment of fungal infection[J]. Biomed Pharmacother, 2020, 128: 110297. |
| [22] |
Liu M, Chen MW, Yang ZW. Design of amphotericin B oral formulation for antifungal therapy[J]. Drug Deliv, 2017, 24(1): 1-9. |
| [23] |
刘荣, 路霞林, 董平. 注射用两性霉素B与不同厂家5%葡萄糖注射液的配伍稳定性考察[J]. 中国药房, 2015, 26(20): 2771-2773. Liu R, Lu XL, Dong P. Study on the compatible stability of amphotericin B for injection and 5% glucose injection from different manufacturers[J]. China Pharmacy, 2015, 26(20): 2771-2773. |



