肠道产甲烷菌不是致病菌,但肠道产甲烷菌的数量异常会对人体产生一定影响。正常情况下,肠道产甲烷菌和其他微生物之间相互共生与竞争,形成动态平衡[1]。若平衡破坏,机体会出现病理及生理上的改变。研究[2]表明,肠道产甲烷菌与肥胖、肠易激综合征(irritable bowel syndrome,IBS)、炎症性肠病(inflammatory bowel disease,IBD)、结直肠癌(colorectal cancer,CRC)、憩室病等疾病存在一定联系。本文通过查阅国内外文献,对肠道产甲烷菌与肠道疾病的关系研究进展进行综述,着重梳理肠道产甲烷菌在人体肠道疾病中可能发生的机制,以期探寻治疗肠道疾病的有效靶点。
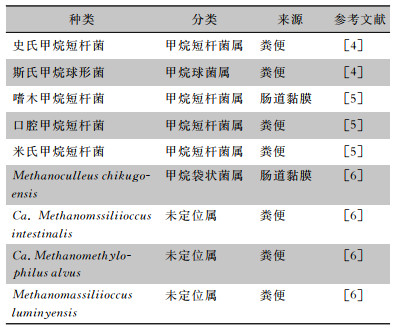
1 产甲烷菌的特点及种类产甲烷菌是一类厌氧型原核生物,属古生菌,广泛分布于淡水、海洋沉积物、潮湿土壤和肠道等环境中,包括甲烷杆菌目、甲烷球菌目、甲烷微菌目、甲烷八叠球菌目、甲烷火菌目、甲烷胞菌目六个目,属欧亚大陆门[3]。肠道主要产甲烷菌为史氏甲烷短杆菌(Methanobrevibacter smithii),其次是斯氏甲烷球形菌(Methanosphaera stadtmanae),在肠道黏膜和粪便中还发现了其他肠道产甲烷菌,见表 1。其中来源于肠道黏膜的菌群不易受外界环境影响,较粪便菌群稳定[7]。根据产甲烷菌底物不同,分为氢营养型、甲基营养型和乙酸营养型产甲烷菌[8],见图 1。肠道产甲烷菌产物主要为甲烷,因为产甲烷菌的特殊细胞成分及甲烷代谢功能,能将底物在厌氧条件下发酵转化成甲烷[10]。甲烷生成有甲基营养型、二氧化碳还原型和乙酸裂解型途径,三种途径都形成甲基辅酶M,然后在甲基辅酶M还原酶Ⅰ(MCR-Ⅰ)和甲基辅酶M还原酶Ⅱ(MCR-Ⅱ)催化下形成甲烷[11-12]。肠道产生的甲烷主要以肠道废气排出体外,其余通过循环系统由肺排出。甲烷的排出不仅能缩小肠道气体体积,还能为肠道提供良好的厌氧环境,促进其他厌氧菌生长[1]。此外,肠道产甲烷菌能与其他菌群互利共生,共同促进营养代谢,还能与硫酸盐还原菌同时存在且相互竞争氢气。若菌群平衡偏向于硫酸盐还原菌,会生成对肠道有害的硫化氢,导致炎症和上皮细胞损伤。肠道产甲烷菌与肠道菌群之间的共生竞争关系,对稳定肠道微生物区系,保障肠道健康有着重要意义。
| 表 1 目前已知人体肠道产甲烷菌的种类及来源 |
|
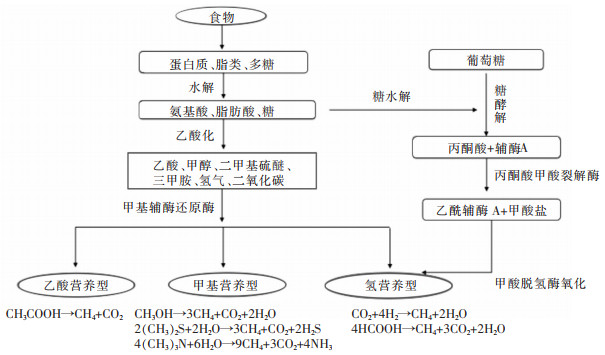 |
| 图 1 肠道产甲烷菌的代谢途径[9] |
产甲烷菌在人体肠道中普遍存在且早期定植。研究[13-14]发现,新生儿出生1d胃就定植史氏甲烷短杆菌,且早产儿胎粪中检测到产甲烷菌,新生儿肠道产甲烷菌可能来源于分娩过程中与母体阴道和肠道菌群的接触[4]。从肠道产甲烷菌的早期定植来看,肠道产甲烷菌不是致病菌,但其定植数量受年龄、性别、遗传和环境等因素影响。肠道产甲烷菌至青少年时期基本稳定,并达到成年人水平。在青少年和成人群体中,女性产生的甲烷明显多于男性[15]。双胞胎对比研究[5]发现,史氏甲烷短杆菌在同卵双胞胎中比异卵双胞胎具有更高的遗传性。产甲烷菌在人体结肠中的分布与粪便黏稠度有关,而左半结肠粪便较硬,产甲烷菌更占优势[4, 9]。根据甲烷呼气试验情况,可分为产甲烷者和非产甲烷者。1/3的正常人能通过呼气试验检测到甲烷,但呼吸试验缺乏敏感性,需产甲烷菌达到约108/g粪便时才能检测到甲烷,因此一般情况下呼气试验检测不到甲烷,但肠道中可能存在产甲烷菌[15-16]。
3 肠道产甲烷菌与疾病的关系 3.1 与肥胖肥胖及其相关代谢性疾病,如2型糖尿病、高血压、动脉粥样硬化、非酒精性脂肪肝等已成为全球性公共卫生难题[17]。肠道产甲烷菌能影响宿主的能量和代谢,促使肥胖发生。第一,史氏甲烷短杆菌与酵解多糖的多形拟杆菌混合接种小鼠的体重高于单一菌种接种小鼠的体重[2]。可能是因为史氏甲烷短杆菌消耗氢气,使肠道气体体积缩小,维持肠道厌氧环境,其他厌氧菌的发酵效率和无氧酵解效率提高,从而升高了短链脂肪酸水平,并提高了多形拟杆菌酵解多糖的能力,可吸收的能量增多[1-2]。第二,肥胖受试者中发现肠道产甲烷菌数量高于健康人群[17]。肠道产甲烷菌增多,氢气消耗增多,导致肠道处于低氢分压状态,这种状态使得NADH氧化还原中的电子以氢原子形式释放,因此发酵微生物通过还原质子形成氢气而不是还原丙酮酸形成二羧酸和乙醇再氧化NADH,这使丙酮酸积累,导致底物水平磷酸化获得更多ATP,同时发酵微生物生成更多乙酸,乙酸和氢气又能作为肠道产甲烷菌的底物供其生长、代谢,形成了一个能量更多的代谢循环[18]。另外,甲烷气体也可通过肠道运输和肠道神经肌肉功能来影响肥胖发生。将甲烷气体注入小肠,小肠蠕动速度减慢59%,促使肠道微生物聚集,且食糜在肠道停留和消化时间延长,提高机体对营养的吸收[19]。因此,肠道产甲烷菌的种群动态可作为肥胖发病机制的标志。
3.2 与肠道疾病 3.2.1 IBSIBS是一种慢性复发性功能性肠病,根据粪便性状主要分为便秘型(IBS-C)、腹泻型(IBS-D)和混合型(IBS-M)[20]。研究[21]指出,IBS-C的肠道气体以甲烷为主,IBS-D以氢气为主,IBS-M以氢气和甲烷为主,其中IBS-C肠道产甲烷菌主要为史氏甲烷短杆菌[20]。腹泻带来的肠道冲洗会抑制产甲烷菌定植,导致IBS-D和IBS-M肠道产甲烷菌减少,进而使产甲烷菌耗氢减少,肠道气体体积增加,可部分解释IBS患者肠道胀气的原因[20, 22]。IBS患者中,甲烷呼气试验阳性的患者大多数为IBS-C,且甲烷产生量与便秘的严重程度呈正相关[21]。甲烷呼气试验阳性的IBS患者在进食糖类1 h后,血清素水平低于甲烷呼气试验阴性患者,而血清素水平降低会使肠道蠕动减慢,可解释IBS患者便秘的原因[20]。
3.2.2 IBDIBD是一种病因复杂的肠道慢性炎症性疾病,包括克罗恩病和溃疡性结肠炎两种形式,主要临床表现为腹泻、腹痛、粪便异常等症状[23]。IBD与肠道产甲烷菌存在一定关联。一方面,研究[24-25]发现,IBD患者中史氏甲烷短杆菌数量明显低于健康人群,而史氏甲烷短杆菌数量较低会使硫酸盐还原菌增加,导致硫化氢生成增多,诱发炎症和上皮细胞损伤。另一方面,IBD患者粪便中斯氏甲烷球形菌数量高于健康人群,而斯氏甲烷球形菌增多,易引起炎症反应。斯氏甲烷球形菌诱导外周血单核细胞释放促炎细胞因子能力比史氏甲烷短杆菌强4倍,在人体外周血单核细胞中高度促炎,还能维持与粒细胞反应相关的髓样树突状细胞反应,具有较强的免疫原性[5, 26]。因此肠道产甲烷菌在IBD的发生过程中起着关键作用。
3.2.3 CRCCRC是一种消化系统的恶性肿瘤,包括结肠癌和直肠癌,为仅次于肺癌的全球第二大癌症。肠道微生物区系不仅是CRC的主要环境调节器,还是CRC发生的关键环境因素[27]。大量试验表明肠道产甲烷菌与CRC存在一定关联。研究[27]认为,CRC可能与粪便中丁酸盐浓度较低有关,若产甲烷菌胜过产乙酸菌,则会缺乏乙酸盐和具有抗癌作用的丁酸盐。而产甲烷者体内肠道产甲烷菌数量较多,结肠厌氧作用增强,高度厌氧的肠道环境可增强胆汁酸产生致癌物的能力,产甲烷者更易患上CRC[20]。此外,与健康人群相比,CRC黏膜样本中有更高水平的肠道产甲烷菌,且腺癌阶段的肠道产甲烷菌水平远高于管状腺瘤[27]。肿瘤本身也可能通过阻塞增加甲烷产生,肠内容物排空时间延长,肠道厌氧状态加重,产甲烷菌作用时间延长[20]。相反,研究[28]认为,右半结肠癌的发生可能与肠道产甲烷菌数量减少和粪便pH值降低有关。综上所述,肠道产甲烷菌与CRC存在密切联系,但个体差异等因素可能对试验结果存在一定影响,还需大量试验来证实肠道产甲烷菌在CRC中的发生机制。
3.2.4 憩室病憩室病是结肠壁肌层薄弱导致结肠黏膜下层突出的疾病,通常无症状[29]。肠道微生物组成的改变可以产生有毒代谢物,破坏肠道微生态与免疫系统之间的平衡,使上皮功能障碍、腔内压力增加和延迟肠道转运时间来促使憩室病发展[29]。根据粪便产甲烷菌直接计数发现,结肠憩室病患者粪便产甲烷菌数量较非憩室病有所增加[30]。这是因为憩室能为肠道产甲烷菌生长提供良好环境,其一,氢气在憩室中滞留,可以优先转化为甲烷而非通过粪便排出;其二,憩室保护生长缓慢的肠道产甲烷菌,使产甲烷菌不被肠道清除[20]。憩室病起病于左半结肠功能紊乱,促使氢气积聚,左半结肠产甲烷菌生长增多,甲烷含量升高,产生于左半结肠的氢气通过肠道产甲烷菌可迅速转化为甲烷,使腔内压力增加[20]。而右结肠憩室与肠道细菌产生的气体无明显关系,但没有考虑憩室的时间依赖性[29]。因此需要进一步研究肠道产甲烷菌与右结肠憩室之间的关系。
4 肠道产甲烷菌及其产物的检测方法 4.1 肠道产甲烷菌检测方法检测肠道产甲烷菌最多的方法是分子生物学方法。聚合酶链反应可估计特定样品中产甲烷菌的丰富度;实时定量聚合酶链反应用于研究反刍动物和其他环境中产甲烷菌的多样性,并确定人体结肠中氢营养型产甲烷菌的丰富度[31]。荧光原位杂交用于量化产甲烷菌,目前用来研究人体口腔产甲烷菌,但对肠道产甲烷菌的定量研究不多。二代基因测序能在样品中获取从产甲烷菌基因组数据到宏基因组数据的多样性信息[31]。分子标记物也可用于肠道产甲烷菌的研究,其中mcrA基因可描述产甲烷的生化途径和相关能源守恒,但斯氏甲烷球形菌只具有MCR-Ⅱ;mtaB基因用于描述甲烷球菌目,存在于斯氏甲烷球形菌中,是研究肠道产甲烷菌多样性的标记基因,但单独使用可能会产生偏差;伴侣蛋白被用作研究古细菌发育多样性的靶标,其序列更多样;将原核、细菌和古生菌的引物同时测序研究猪肠道微生物群,检测到古细菌成分并确定产甲烷菌,该法可能对研究人体肠道产甲烷菌有帮助。此外,三级连续生物反应器能接种产甲烷者的新鲜粪便,可用于肠道产甲烷菌的体外培养[31]。以上检测方法都有各自的优势和局限性,在今后研究中不断提高检测的精确度和准确度,对进一步探究肠道疾病具有重要意义。
4.2 肠道产甲烷菌产物检测方法除直接检测肠道产甲烷菌以外,还能通过检测呼吸中的甲烷来间接监测肠道产甲烷菌的新陈代谢。气相色谱法中热导检测器可用于氢的定量;火焰离子化检测器可用于甲烷的定量;脉冲氦放电离子化检测器可从人体呼吸样本中同时检测并分离出氢气和甲烷,灵敏度比热导检测器高500倍,比火焰离子化检测器高50倍[5, 32]。光谱检测方法中,二级管激光光谱可检测气体浓度变化;光学参量振荡器可检测甲烷气体的吸收波长,且连续波光学参量振荡器与光声光谱技术相结合的方法也已在人体呼吸甲烷的测量中显示出效用[15, 33]。压电传感器可对氢气和甲烷实现快速检测,通常取决于气体填充检测腔的时间;电化学传感器是基于甲烷与甲烷氧化菌反应的间接测量;安培传感器等电流传感器也被用于检测甲烷[15, 33]。另外,乳果糖氢呼气试验用于测定氢气、甲烷浓度,高甲烷产生者被定义为初始读数≥5 mg/L,低甲烷产生者的初始读数<4 mg/L[34]。Lactotest 202仪器使用电化学氢传感器和红外传感器检测甲烷和二氧化碳,主要用于呼吸中的甲烷和氢的临床常规检测;Quintron BreathTrackerTMSC可将氢气和甲烷与所有其他还原气体分离,用于测量呼吸中氢气、甲烷和二氧化碳的浓度;GastroCH4ECKTM使用红外传感器同时测量呼吸中的氢、甲烷和氧,通过电化学传感器测量甲烷和氢的水平[15]。由于其他结肠生物或宿主细胞没有甲烷气体代谢,通常以半定量分析肠道产甲烷菌的代谢,测量呼吸中的甲烷为研究肠道产甲烷菌提供了快速、简单的方法[4, 20]。
5 总结与展望综上所述,肠道产甲烷菌不是致病菌,但其数量的异常与疾病的发生、发展密切相关。肠道产甲烷菌引起疾病发生的机制主要表现在改变肠腔内环境、与其他菌群竞争底物、减少氢气积累、改变肠道蠕动速度等。因此,肠道产甲烷菌失调能使肠道健康状态发生改变,应将产甲烷菌作为调节肠道微生物群来降低疾病风险和改善健康的重要目标。当产甲烷菌过多时,一些抗菌药物可抑制肠道菌群的生长,调节肠道甲烷水平,但选择性抑制产甲烷菌的药物并不多,需要进一步研究。产甲烷菌缺乏时,可将产甲烷菌作为益生菌进行治疗。此外,还可采取饮食干预措施调节肠道产甲烷菌的组成来改善健康。但是目前部分相关致病机制与环境、遗传等相关问题尚不清楚,肠道产甲烷菌的检测方法也不够准确。因此,应深入研究其具体致病机制,使其与肠道微生物之间维持动态平衡,保持肠道稳定,同时加强对肠道产甲烷菌及其产物检测方法的改进与创新,提高检测方法的精确度和准确度。以上对肠道疾病的治疗、诊断和预防有着重要意义,不仅可以促进人体肠道健康,还可能找到一个全新治疗肠道疾病的有效靶点。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
葛婷, 慕春龙, 朱伟云. 人肠道产甲烷菌与肠道健康[J]. 微生物学报, 2015, 55(6): 661-666. Ge T, Mu CL, Zhu WY. Methanogen and human gut health- a review[J]. Acta Microbiologica Sinica, 2015, 55(6): 661-666. DOI:10.13343/j.cnki.wsxb.20140376 |
| [2] |
胡婷姿. 产甲烷菌在C57BL/6小鼠肥胖模型消化道不同部位的分布及其相关性研究[D]. 长沙: 中南大学, 2014. Hu TZ. The distribution of Methanobrevibacter smithii in intestine of diet-induced obesity C57BL/6mice and the relationship between M. smithii and obesity[D]. Changsha: Central South University, 2014. |
| [3] |
Gaci N, Borrel G, Tottey W, et al. Archaea and the human gut: new beginning of an old story[J]. World J Gastroenterol, 2014, 20(43): 16062-16078. DOI:10.3748/wjg.v20.i43.16062 |
| [4] |
Triantafyllou K, Chang C, Pimentel M. Methanogens, methane and gastrointestinal motility[J]. J Neurogastroenterol Motil, 2014, 20(1): 31-40. DOI:10.5056/jnm.2014.20.1.31 |
| [5] |
Chaudhary PP, Conway PL, Schlundt J. Methanogens in humans: potentially beneficial or harmful for health[J]. Appl Microbiol Biotechnol, 2018, 102(7): 3095-3104. DOI:10.1007/s00253-018-8871-2 |
| [6] |
Guindo CO, Davoust B, Drancourt M, et al. Diversity of methanogens in animals' gut[J]. Microorganisms, 2020, 9(1): 13. DOI:10.3390/microorganisms9010013 |
| [7] |
Dridi B, Henry M, Richet H, et al. Age-related prevalence of Methanomassiliicoccus luminyensis in the human gut micro-biome[J]. APMIS, 2012, 120(10): 773-777. DOI:10.1111/j.1600-0463.2012.02899.x |
| [8] |
Borrel G, Brugère JF, Gribaldo S, et al. The host-associated archaeome[J]. Nat Rev Microbiol, 2020, 18(11): 622-636. DOI:10.1038/s41579-020-0407-y |
| [9] |
Guindo CO, Drancourt M, Grine G. Digestive tract methanodrome: physiological roles of human microbiota-associated methanogens[J]. Microb Pathog, 2020, 149: 104425. DOI:10.1016/j.micpath.2020.104425 |
| [10] |
Djemai K, Drancourt M, Tidjani Alou M. Bacteria and methanogens in the human microbiome: a review of syntrophic inte-ractions[J]. Microb Ecol, 2022, 83(3): 536-554. DOI:10.1007/s00248-021-01796-7 |
| [11] |
Lyu Z. Back to the source: molecular identification of Methanogenic archaea as markers of colonic methane production[J]. Dig Dis Sci, 2021, 66(11): 3661-3664. DOI:10.1007/s10620-021-06839-0 |
| [12] |
Chen H, Gan QL, Fan CG. Methyl-coenzyme M reductase and its post-translational modifications[J]. Front Microbiol, 2020, 11: 578356. DOI:10.3389/fmicb.2020.578356 |
| [13] |
Grine G, Boualam MA, Drancourt M. Methanobrevibacter smithii, a methanogen consistently colonising the newborn stomach[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(12): 2449-2455. DOI:10.1007/s10096-017-3084-7 |
| [14] |
Sereme Y, Guindo CO, Filleron A, et al. Meconial Methanobrevibacter smithii suggests intrauterine methanogen colonization in preterm neonates[J]. Curr Res Microb Sci, 2021, 2: 100034. |
| [15] |
de Lacy Costello BP, Ledochowski M, Ratcliffe NM. The importance of methane breath testing: a review[J]. J Breath Res, 2013, 7(2): 024001. DOI:10.1088/1752-7155/7/2/024001 |
| [16] |
Scanlan PD, Shanahan F, Marchesi JR. Human methanogen diversity and incidence in healthy and diseased colonic groups using mcrA gene analysis[J]. BMC Microbiol, 2008, 8: 79. DOI:10.1186/1471-2180-8-79 |
| [17] |
Mathur R, Barlow GM. Obesity and the microbiome[J]. Expert Rev Gastroenterol Hepatol, 2015, 9(8): 1087-1099. DOI:10.1586/17474124.2015.1051029 |
| [18] |
Saengkerdsub S, Ricke SC. Ecology and characteristics of Methanogenic archaea in animals and humans[J]. Crit Rev Micro-biol, 2014, 40(2): 97-116. DOI:10.3109/1040841X.2013.763220 |
| [19] |
Barlow GM, Yu A, Mathur R. Role of the gut microbiome in obesity and diabetes mellitus[J]. Nutr Clin Pract, 2015, 30(6): 787-797. DOI:10.1177/0884533615609896 |
| [20] |
时佳子, 翟骁, 陈晓, 等. 甲烷在肠道疾病中的作用[J]. 肠外与肠内营养, 2015, 22(2): 119-122. Shi JZ, Zhai X, Chen X, et al. The role of methane in intestinal diseases[J]. Parenteral & Enteral Nutrition, 2015, 22(2): 119-122. |
| [21] |
李佩, 张少波, 苏军凯, 等. 肠易激综合征症状与肠道气体的研究进展[J]. 胃肠病学, 2016, 21(10): 629-632. Li P, Zhang SB, Su JK, et al. Progress in study on symptoms of irritable bowel syndrome and intestinal gas[J]. Chinese Journal of Gastroenterology, 2016, 21(10): 629-632. DOI:10.3969/j.issn.1008-7125.2016.10.012 |
| [22] |
邵好青, 谭周进. 靶向肠道菌群治疗胃肠疾病研究进展[J]. 世界华人消化杂志, 2021, 29(15): 841-848. Shao HQ, Tan ZJ. Microbiota-targeted therapeutics in gastrointestinal diseases[J]. World Chinese Journal of Digestology, 2021, 29(15): 841-848. |
| [23] |
Ghavami SB, Rostami E, Sephay AA, et al. Alterations of the human gut Methanobrevibacter smithii as a biomarker for inflammatory bowel diseases[J]. Microb Pathog, 2018, 117: 285-289. DOI:10.1016/j.micpath.2018.01.029 |
| [24] |
Sereme Y, Mezouar S, Grine G, et al. Methanogenic archaea: emerging partners in the field of allergic diseases[J]. Clin Rev Allergy Immunol, 2019, 57(3): 456-466. DOI:10.1007/s12016-019-08766-5 |
| [25] |
Nakamura N, Lin HC, McSweeney CS, et al. Mechanisms of microbial hydrogen disposal in the human colon and implications for health and disease[J]. Annu Rev Food Sci Technol, 2010, 1: 363-395. DOI:10.1146/annurev.food.102308.124101 |
| [26] |
Blais Lecours P, Marsolais D, Cormier Y, et al. Increased prevalence of Methanosphaera stadtmanae in inflammatory bowel diseases[J]. PLoS One, 2014, 9(2): e87734. DOI:10.1371/journal.pone.0087734 |
| [27] |
Mira-Pascual L, Cabrera-Rubio R, Ocon S, et al. Microbial mucosal colonic shifts associated with the development of colorectal cancer reveal the presence of different bacterial and archaeal biomarkers[J]. J Gastroenterol, 2015, 50(2): 167-179. |
| [28] |
Holma R, Osterlund P, Sairanen U, et al. Colonic methanogenesis in vivo and in vitro and fecal pH after resection of colorectal cancer and in healthy intact colon[J]. Int J Colorectal Dis, 2012, 27(2): 171-178. DOI:10.1007/s00384-011-1323-4 |
| [29] |
Yazici C, Arslan DC, Abraham R, et al. Breath methane le-vels are increased among patients with diverticulosis[J]. Dig Dis Sci, 2016, 61(9): 2648-2654. DOI:10.1007/s10620-016-4174-6 |
| [30] |
Daniels L, Philipszoon LE, Boermeester MA. A hypothesis: important role for gut microbiota in the etiopathogenesis of diverticular disease[J]. Dis Colon Rectum, 2014, 57(4): 539-543. |
| [31] |
Chaudhary PP, Gaci N, Borrel G, et al. Molecular methods for studying methanogens of the human gastrointestinal tract: current status and future directions[J]. Appl Microbiol Biotechnol, 2015, 99(14): 5801-5815. |
| [32] |
Roberge MT, Finley JW, Lukaski HC, et al. Evaluation of the pulsed discharge Helium ionization detector for the analysis of hydrogen and methane in breath[J]. J Chromatogr A, 2004, 1027(1-2): 19-23. |
| [33] |
Lawrence NS. Analytical detection methodologies for methane and related hydrocarbons[J]. Talanta, 2006, 69(2): 385-392. |
| [34] |
Harvie RM, Tuck CJ, Schultz M. Evaluation of lactulose, lactose, and fructose breath testing in clinical practice: a focus on methane[J]. JGH Open, 2020, 4(2): 198-205. |



