2. 山西医科大学第二医院医院感染管理科, 山西 太原 030001
2. Department of Healthcare-associated Infection Management, The Second Hospital of Shanxi Medical University, Taiyuan 030001, China
铜绿假单胞菌(Pseudomonas aeruginosa)是一种致病力较低的革兰阴性杆菌,在某些特定条件下才能致病,例如长期应用糖皮质激素、免疫抑制剂,进行化学治疗、放射治疗等导致患者免疫功能低下,可引起严重的甚至致死性的感染;此外接受一些侵入性操作(如气管切开、留置导尿管等)的患者也容易发生感染,铜绿假单胞菌已成为医院感染的重要病原菌之一[1]。土壤、水、空气,正常人的皮肤、呼吸道和肠道中都有该菌存在,环境中无处不在的特性使得此类感染暴发的来源难以识别,潮湿的场所、自来水、水槽、消毒剂溶液、呼吸设备和支气管镜等是铜绿假单胞菌最常见的医院内宿主,通过污染清洁设备、消毒剂和水系统而引起暴发[2-3]。应对铜绿假单胞菌引起的医院感染暴发是医疗机构的一项重大挑战,了解铜绿假单胞菌的暴发特征有助于指导监测暴发、暴发后快速调查以及制定相应的感染控制措施[4]。全球暴发数据库(Worldwide Database for Nosocomial Outbreaks)从医学文献公布的暴发报告中提取标准化数据,代表了当前可用的所有类型医院内暴发的最全面的集合,使有着特定参数的文献能够被快速检索[5]。本研究汇总分析近17年铜绿假单胞菌医院感染暴发事件的暴发特征、暴发源、传播途径、感染控制措施、暴发株的同源性分析方法及危险因素,为今后处理铜绿假单胞菌医院感染暴发提供经验。
1 资料与方法 1.1 纳入与排除标准纳入标准:①铜绿假单胞菌引起的医院感染暴发原始报告/文献;相关综述作为进一步查找原始暴发报告/文献的来源;②不限制出版物与语言。排除标准:①2005年之前发表的报告与原始文献,最大程度上降低过时数据(如微生物学诊断以及基因分型方法)的影响;②重复报道以及同一事件的重复报道文献;③Meta、系统综述、会议文献;④非铜绿假单胞菌引起的医院感染暴发及疑似暴发事件;⑤未描述铜绿假单胞菌医院感染暴发事件流行病学特征或表述不清的文献。
1.2 文献检索计算机检索全球医院感染暴发数据库(https://www.outbreak-database.com/Home.aspx)以及PubMed数据库,检索时限从2005年1月1日—2022年7月18日。暴发数据库以“Pseudomonas aeruginosa”为主题词检索,选择检索参数“complete-view”来获取文献信息与相关暴发资料;PubMed数据库以“Pseudomonas aeruginosa、outbreak”为主题词进行检索,同时对相关内容综述和纳入文献的参考文献进行手工检索以发现潜在的符合纳入标准的研究。
1.3 文献筛选与数据提取由2名研究者独立筛选文献并提取资料,完成后交叉核对,如果出现分歧通过讨论解决,如无法解决则与第3名研究者讨论后决定,提取所有可能与由铜绿假单胞菌引起的医院感染暴发的相关资料:年份、暴发持续时间、国家、病房特征[重症监护病房(ICU)与其他]、受影响的患者例数、感染患者例数、死亡例数、病原菌来源、分子分型方法、感染传播途径、终止暴发采用的感染控制措施,从病例对照研究与队列研究中获得铜绿假单胞菌传播的危险因素,对提取的危险因素分组后处理。
1.4 质量评价由于暴发资料大多为案例报告,因此由两名研究者使用纽克斯尔-渥太华量表(The Newcastle-Ottawa Scale,NOS)仅对所有纳入的病例对照研究及队列研究进行质量评价,NOS量表评价内容包括研究人群选择(4分)、研究间可比性(3分)、暴露评价或结局评价(2分),NOS评分≥6分表明文献质量较高,文献质量评价结果不作为排除标准。
1.5 统计学方法应用Excel 2010对暴发相关数据进行描述性分析,计数资料以例数和百分率表示;病死率与铜绿假单胞菌耐药性的分析采用四格表资料的χ2检验,P≤0.05为差异具有统计学意义;应用统计软件Stata 16.0对铜绿假单胞菌获得与传播的危险因素分组后进行Meta分析,计数资料的效应指标采用比值比(odds ratio, OR)及其95%置信区间(confidence interval,CI)表示,采用Q检验和I2统计量以量化研究间的异质性,如果P<0.05, I2>50%,则存在异质性,使用随机效应模型进行比较;反之使用固定效应模型。由于每组纳入的文献少于10篇,采用Egger’s检验评估纳入文献的发表偏倚。
2 结果 2.1 文献检索结果初步检索出文献321篇(英文316篇、法文2篇、西班牙文2篇、日文1篇),通过Endnote文献管理软件剔除38篇重复文献,对283篇文献通过阅读题目、摘要进行初筛,初筛后剩余268篇,在阅读全文进行二次筛选后共纳入148篇文献,文献筛选流程图及结果见图 1。
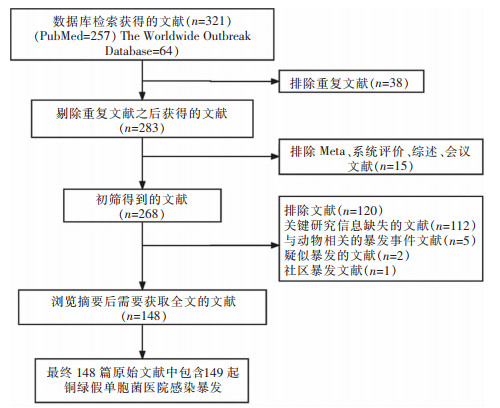 |
| 图 1 文献筛选流程图 Figure 1 Flow chart of literature screening |
共纳入148篇研究,发生149起铜绿假单胞菌引起的医院感染暴发,121起为案例报告,21起为病例对照研究,5起为队列研究,其余2起分别为随机对照研究与新闻报道。共有27个国家报告了铜绿假单胞菌医院感染暴发,分别来自美国(17起)、法国(14起)、意大利(15起)、日本(13起)、西班牙(11起)、英国(9起)、巴西(8起)、中国(7起)、印度(7起)、土耳其(7起)等。
133起报告提供了暴发持续时间,平均暴发持续时间为507 d,每次暴发的平均感染病例数与平均致死病例数分别为18、9例,总病死率为16.9%。多数研究对象为成人住院患者,14起在儿童/新生儿人群中发生。66起铜绿假单胞菌医院感染暴发提供了确切的病死率数据,包括860例感染和594例死亡病例,其中多重耐药铜绿假单胞菌医院感染病死率为31.9%,非多重耐药铜绿假单胞菌医院感染病死率为16.2%,病死率与铜绿假单胞菌的耐药性特征有关(χ2=77.836,P<0.05)。149起暴发中仅19起来自ICU,130起来源于普通病房,包括外科、新生儿科、眼科、血液科、儿科、烧伤科等,2005—2022年按病房类型分层的铜绿假单胞菌医院感染暴发情况见图 2。
 |
| 图 2 2005—2022年普通病房与ICU铜绿假单胞菌医院感染暴发情况(累计数据) Figure 2 P. aeruginosa HAI outbreaks in general wards and intensive care unit from 2005 to 2022 (cumulative data) |
检测暴发源是调查的重要目标之一,因为其能立即终止暴发事件。有78起铜绿假单胞菌医院感染暴发中识别到环境暴发源,见表 1,主要包括三大类:水系统(28起,35.90%)、医疗设备(34起,43.59%)以及治疗用溶液(7起,8.97%,主要为眼科常用溶液)。
| 表 1 铜绿假单胞菌医院感染暴发事件明确的环境暴发源 Table 1 The defined environmental sources of P. aeruginosa HAI outbreaks |
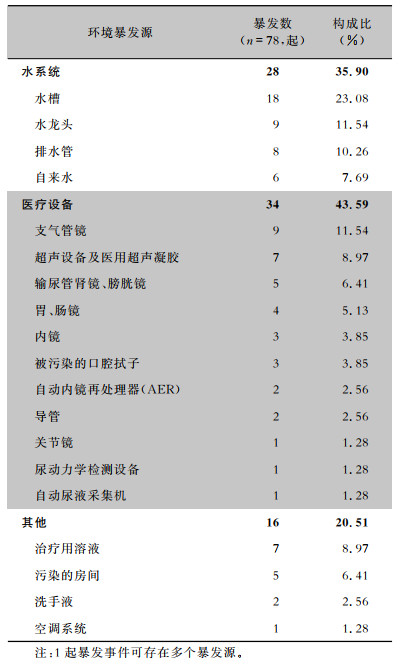
|
本研究在112起暴发事件中找到铜绿假单胞菌医院感染的主要传播途径,铜绿假单胞菌的传播主要通过污染的医疗设备(39起,34.82%),其次是污染的医院水系统(36起,32.14%),通过手接触传播(19起,16.96%),通过环境物体表面接触传播(18起,16.07%)。
2.5 终止暴发实施的感染控制措施112起暴发描述了终止暴发的感染控制措施,本研究按水系统、医疗设备与治疗用溶液将其分类汇总,见表 2。除了针对不同暴发源实施的针对性感染控制措施,基础的感染控制措施也是终止暴发的重要环节。
| 表 2 针对铜绿假单胞菌医院感染不同暴发源采取的感染控制措施 Table 2 Infection control measures to different P. aeruginosa HAI outbreak sources |

|
130起暴发事件为判断感染源、切断传播途径、控制感染蔓延,对铜绿假单胞菌暴发株进行了分子分型与同源性分析,最广泛使用的方法是脉冲凝胶电泳(PFGE,86次)、聚合酶链式反应(PCR,21次)和全基因组测序(WGS,8次),见图 3。
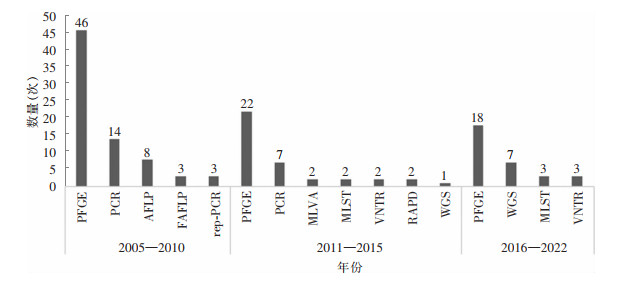 |
| 注:AFLP为扩增片段长度多态性;FAFLP为荧光素标记的选择性扩增片段长度多态性;rep-PCR为重复DNA序列的聚合酶链式反应;MLVA为多位点可变数目串联重复序列分型;MLST为多位点序列分型;VNTR为数目可变串联重复序列;RAPD为随机扩增多态性DNA标记。 图 3 不同年份暴发病例采用的分子分型方法 Figure 3 Molecular typing methods for outbreak cases in different years |
纳入的21篇病例对照研究、5篇队列研究中仅15项病例对照研究提供OR值,NOS量表评分结果为5~6分,共提取59个铜绿假单胞菌医院感染的危险因素,Meta分析结果见表 3。
| 表 3 铜绿假单胞菌医院感染不同危险因素的Meta分析 Table 3 Meta-analysis on different risk factors of P. aeruginosa HAI outbreak |
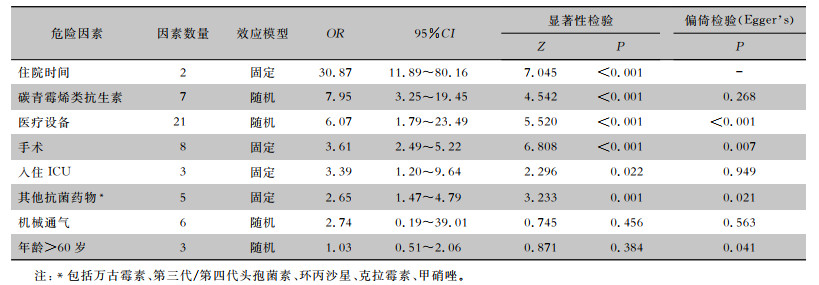
|
本研究综合分析全球铜绿假单胞菌医院感染事件发现,铜绿假单胞菌的暴发更多发生于普通病房,且从病死率数据来看,细菌的耐药性与病死率存在相关性,近年来随着抗菌药物的广泛使用,多重耐药菌成为医院感染的重要病原菌,虽然ICU多重耐药铜绿假单胞菌引起的暴发并不常见,但每次暴发造成的后果不容乐观,在医院感染管理中需重点关注并提前预警。医院内暴发并不特定于一个医疗部门,而是可以在医院内整体发生,对感染控制人员调查此类暴发造成了较大困难,在寻找可能的致病病原体以及暴发源时需花费大量精力,医院也为此承担着高额费用。一旦发现医院内暴发,感染控制团队的目标是尽快终止暴发,而了解以前在类似事件中实施的有效措施有助于感染控制团队及时准确处理当前的紧急情况。
铜绿假单胞菌医院感染的暴发源与传播途径分析结果显示,大多数暴发事件是由于水系统与医疗设备的污染。水是铜绿假单胞菌的重要储存库,被铜绿假单胞菌污染的水槽、水龙头、自来水以及管道系统均被认为是主要且持续的传播源。zhou等[6]的暴发调查发现,18.6%的自来水标本和22.1%的水槽存水弯标本中检测到铜绿假单胞菌,存水弯阳性率(92.3%,12/13)高于自来水阳性率(53.8%,7/13),提示水槽中铜绿假单胞菌的定植程度比自来水严重。定植在水系统中的铜绿假单胞菌从水槽存水弯蔓延到水槽,如果病床和水槽距离<1 m,则将直接污染患者与周围环境;甚至在洗手时短暂污染医护人员的手,随后医护人员手污染患者周围环境甚至是直接污染患者。感应式水龙头因其可避免直接触摸因而被广泛使用,但相关暴发调查结果显示,电磁阀有适合铜绿假单胞菌形成生物膜的橡胶、塑料和聚氯乙烯膜,且35~40℃的水温是铜绿假单胞菌生长的理想温度,出水口、电磁阀和混合装置成为污染最严重的部分[7-9],安装抗菌过滤器可对此实现有效预防。良好的水槽设计可以减少飞溅[10-11],适当使用防溅挡板或屏障[10]或重新安排周围空间[12],使专用储存空间距离水槽1 m以上[11]等策略均可以最大限度地减少周围表面和物体的污染。但如果管道系统被污染,很难对主体结构修改与更换,需采用适当的消毒措施,德国儿科肿瘤护理病房发生的一起暴发事件就在水槽下方的虹吸管中检出铜绿假单胞菌,调查分析发现水龙头与水槽距离较近,水射流直接汇集于虹吸管,产生带有铜绿假单胞菌的气溶胶,患者因吸入受污染的气溶胶以及工作人员被污染的手接触患者后导致暴发,除了更换水龙头使其与虹吸管的间距增加、安装抗菌过滤器以避免污染的水流直接进入水槽;还使用能对虹吸管内壁进行连续物理消毒(热和紫外线)及带电清洁的BIOREC医疗卫生虹吸管,暴发终止后的两年内未再发生铜绿假单胞菌医院感染。总体而言,46.4%(13/28)的暴发通过更换水系统相关设施终止,其他的有效策略还包括:为高危患者提供无菌水护理甚至是“无水”护理(取消所有水槽)以及必要时关闭暴发病房。
暴发报告中报道的与内镜有关的铜绿假单胞菌传播的最重要原因是违背清洁和消毒/灭菌指南的原则,内镜检查作为一项侵入性诊疗技术临床应用十分广泛,但由于价格昂贵容易出现因镜子少而使用频率高、冲洗不彻底、消毒时间不足等[13-20]问题而引起交叉感染。另外不适当的消毒剂[2]、被污染的冲洗水[2]、自动内镜再处理器[21]以及内镜本身的破损[22]也是造成铜绿假单胞菌传播的重要原因。每次使用内镜后应立即进行清洁,以防止分泌物变干,一旦分泌物变干,可能会形成很厚的生物膜,导致清洁剂或消毒剂的效力降低。在防止铜绿假单胞菌传播和医院感染发生方面,干燥、清洗与高水平消毒同样重要,内镜垂直悬挂在干燥且通风良好的储物柜中,特别注意避免内镜任何部分发生卷曲,以便减少通道内发生带菌小水珠积聚的可能性。酸性氧化电位水用于内镜的消毒可提高工作效率减少环境污染,但目前有些医院对其正确使用尚缺乏认识,对内镜的消毒效果还有待进一步研究证实,加强内镜检查室的建设,提高医护人员对内镜消毒灭菌工作重要性的认识,严格医护人员操作规范,切实加强内镜的监测与管理等是医院内镜消毒管理的重要内容。
汇总分析暴发事件中采用的分子分型技术发现,PFGE是目前鉴别能力最强且使用最广泛的铜绿假单胞菌分型方法,但近年来随着基因测序成本的下降,WGS被广泛应用于临床和流行病学调查中[23-24],WGS具有较高的灵敏度和特异度,能够及时发现变异菌株和新的病原菌[25]。基因型不同的菌株通常没有共同来源,将更有可能是使用抗菌药物导致的多重耐药铜绿假单胞菌传播;相反,如果微生物菌株在基因型上相同或密切相关,则提示存在共同传播源;实际工作中简单认为相同抗菌药物耐药性特征的菌株有着相似基因类型的想法并不可取,不仅不会遏制多重耐药铜绿假单胞菌的传播,还可能误导控制暴发策略的实施,铜绿假单胞菌在医院环境中存在多种潜在传播源,暴发的实际来源通常很难确定,且存在着与导致暴发无关的环境菌株,为明确暴发源及时准确控制暴发,暴发菌株的遗传分型与同源性分析是重要的调查手段,数据结果能够帮助确定铜绿假单胞菌感染和传播是否与选择(碳青霉烯类抗生素使用)或传播(水系统、医疗器械)相关。
控制暴发的策略中,基础感染控制措施的功劳不容忽视。例如积极监测病原体、筛查患者、接触隔离、限制抗菌药物使用、严格环境消毒等。无论是否已经证明存在着外源性暴发源,对患者的接触隔离和严格遵守手卫生措施依然是进一步阻止暴发分离菌株传播的必要步骤。铜绿假单胞菌通常不被认为是皮肤定植生物,手部病原菌定植的来源可能是通过接触被定植的患者或水,这种机制可能与皮肤损伤有关,因此需要医务人员在戴手套、洗手和脱手套后进行手消毒的依从性较高,甚至达100%的依从性。
本研究在危险因素的分析中,研究结果与一项系统综述[26]结果一致。住院时间、碳青霉烯类抗生素与医疗设备的使用是铜绿假单胞菌获得与传播的主要危险因素,医疗设备的使用是文献中报告最多的危险因素,医疗设备使用量的增加以及使用时间的延长,意味着患者更容易感染铜绿假单胞菌。碳青霉烯类抗生素的使用显示出较高的OR值,突出了抗菌药物管理在控制暴发中的重要性,尤其需要减少碳青霉烯类抗生素的使用,以帮助防止耐碳青霉烯类铜绿假单胞菌的出现和传播,并且建议医生在使用抗菌药物治疗前与临床药师共同制定和优化抗菌药物治疗方案,规范抗菌药物临床应用行为,提高抗菌药物临床应用水平[27-28]。
本研究由于检索范围相对局限,对于国内的铜绿假单胞菌医院感染事件仍需进一步汇总分析;另外由于暴发事件报告类型的特殊性,未对纳入的案例报告进行质量评价,Stone等[29]建议在医学文献中采用更标准化的暴发报告方式,以避免遗漏任何值得关注的参数,但暴发报告在过去十几年中规范性未得到很大改善,暴发报告中提供的可获取数据并不总是全面,例如:在149起铜绿假单胞菌医院感染暴发中仅101起明确报告暴发涉及的医疗科室,尽管在暴发调查中确实可获得此信息。因此,本研究在此强调暴发报告遵守ORION指南[29]在未来的重要性,以避免遗漏任何值得关注的参数。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Qin SG, Xiao W, Zhou CM, et al. Pseudomonas aeruginosa: pathogenesis, virulence factors, antibiotic resistance, interaction with host, technology advances and emerging therapeutics[J]. Signal Transduct Target Ther, 2022, 7(1): 199. DOI:10.1038/s41392-022-01056-1 |
| [2] |
Fernández-Cuenca F, López-Cerero L, Cabot G, et al. Nosocomial outbreak linked to a flexible gastrointestinal endoscope contaminated with an amikacin-resistant ST17 clone of Pseudo-monas aeruginosa[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(10): 1837-1844. DOI:10.1007/s10096-020-03915-7 |
| [3] |
Bicking Kinsey C, Koirala S, Solomon B, et al. Pseudomonas aeruginosa outbreak in a neonatal intensive care unit attributed to hospital tap water[J]. Infect Control Hosp Epidemiol, 2017, 38(7): 801-808. DOI:10.1017/ice.2017.87 |
| [4] |
Wieland K, Chhatwal P, Vonberg RP. Nosocomial outbreaks caused by Acinetobacter baumannii and Pseudomonas aeruginosa: results of a systematic review[J]. Am J Infect Control, 2018, 46(6): 643-648. DOI:10.1016/j.ajic.2017.12.014 |
| [5] |
Vonberg RP, Weitzel-Kage D, Behnke M, et al. Worldwide outbreak database: the largest collection of nosocomial outbreaks[J]. Infection, 2011, 39(1): 29-34. DOI:10.1007/s15010-010-0064-6 |
| [6] |
Zhou ZY, Hu BJ, Gao XD, et al. Sources of sporadic Pseudomonas aeruginosa colonizations/infections in surgical ICUs: association with contaminated sink trap[J]. J Infect Chemother, 2016, 22(7): 450-455. DOI:10.1016/j.jiac.2016.03.016 |
| [7] |
Berthelot P, Chord F, Mallaval F, et al. Magnetic valves as a source of faucet contamination with Pseudomonas aeruginosa?[J]. Intensive Care Med, 2006, 32(8): 1271. DOI:10.1007/s00134-006-0206-6 |
| [8] |
Mazzotta M, Girolamini L, Pascale MR, et al. The role of sensor-activated faucets in surgical handwashing environment as a reservoir of Legionella[J]. Pathogens, 2020, 9(6): 446. DOI:10.3390/pathogens9060446 |
| [9] |
Charron D, Bédard E, Lalancette C, et al. Impact of electronic faucets and water quality on the occurrence of Pseudomonas aeruginosa in water: a multi-hospital study[J]. Infect Control Hosp Epidemiol, 2015, 36(3): 311-319. DOI:10.1017/ice.2014.46 |
| [10] |
Hota S, Hirji Z, Stockton K, et al. Outbreak of multidrug-resistant Pseudomonas aeruginosa colonization and infection se-condary to imperfect intensive care unit room design[J]. Infect Control Hosp Epidemiol, 2009, 30(1): 25-33. DOI:10.1086/592700 |
| [11] |
Breathnach AS, Cubbon MD, Karunaharan RN, et al. Multidrug-resistant Pseudomonas aeruginosa outbreaks in two hospitals: association with contaminated hospital waste-water systems[J]. J Hosp Infect, 2012, 82(1): 19-24. DOI:10.1016/j.jhin.2012.06.007 |
| [12] |
Catho G, Martischang R, Boroli F, et al. Outbreak of Pseudo-monas aeruginosa producing VIM carbapenemase in an intensive care unit and its termination by implementation of waterless patient care[J]. Crit Care, 2021, 25(1): 301. DOI:10.1186/s13054-021-03726-y |
| [13] |
Tosh PK, Disbot M, Duffy JM, et al. Outbreak of Pseudomonas aeruginosa surgical site infections after arthroscopic procedures: Texas, 2009[J]. Infect Control Hosp Epidemiol, 2011, 32(12): 1179-1186. DOI:10.1086/662712 |
| [14] |
Kumarage J, Khonyongwa K, Khan A, et al. Transmission of multi-drug resistant Pseudomonas aeruginosa between two flexible ureteroscopes and an outbreak of urinary tract infection: the fragility of endoscope decontamination[J]. J Hosp Infect, 2019, 102(1): 89-94. DOI:10.1016/j.jhin.2019.02.015 |
| [15] |
Kikuchi T, Nagashima G, Taguchi K, et al. Contaminated oral intubation equipment associated with an outbreak of carbapenem-resistant Pseudomonas in an intensive care unit[J]. J Hosp Infect, 2007, 65(1): 54-57. DOI:10.1016/j.jhin.2006.07.017 |
| [16] |
Kayabas U, Bayraktar M, Otlu B, et al. An outbreak of Pseudomonas aeruginosa because of inadequate disinfection procedures in a urology unit: a pulsed-field gel electrophoresis-based epidemiologic study[J]. Am J Infect Control, 2008, 36(1): 33-38. DOI:10.1016/j.ajic.2007.03.003 |
| [17] |
Achour W, Abbassi MS, Cherif A, et al. Nosocomial respiratory infection due to an imipenem-resistant Pseudomonas aeruginosa O: 12 strain in a Tunis's neonatal intensive care unit[J]. Pathol Biol (Paris), 2006, 54(10): 596-599. DOI:10.1016/j.patbio.2006.07.032 |
| [18] |
Bou R, Aguilar A, Perpiñán J, et al. Nosocomial outbreak of Pseudomonas aeruginosa infections related to a flexible bronchoscope[J]. J Hosp Infect, 2006, 64(2): 129-135. DOI:10.1016/j.jhin.2006.06.014 |
| [19] |
Centers for Disease Control and Prevention (CDC). Pseudomonas aeruginosa infections associated with transrectal ultrasound-guided prostate biopsies-Georgia, 2005[J]. MMWR Morb Mortal Wkly Rep, 2006, 55(28): 776-777. |
| [20] |
Guy M, Vanhems P, Dananché C, et al. Outbreak of pulmonary Pseudomonas aeruginosa and Stenotrophomonas maltophilia infections related to contaminated bronchoscope suction valves, Lyon, France, 2014[J]. Euro Surveill, 2016, 21(28): 30286. |
| [21] |
Shimono N, Takuma T, Tsuchimochi N, et al. An outbreak of Pseudomonas aeruginosa infections following thoracic surgeries occurring via the contamination of bronchoscopes and an automatic endoscope reprocessor[J]. J Infect Chemother, 2008, 14(6): 418-423. DOI:10.1007/s10156-008-0645-9 |
| [22] |
Cêtre JC, Nicolle MC, Salord H, et al. Outbreaks of contaminated broncho-alveolar lavage related to intrinsically defective bronchoscopes[J]. J Hosp Infect, 2005, 61(1): 39-45. DOI:10.1016/j.jhin.2004.12.020 |
| [23] |
Mellmann A, Harmsen D, Cummings CA, et al. Prospective genomic characterization of the German enterohemorrhagic Escherichia coli O104:H4 outbreak by rapid next generation sequencing technology[J]. PLoS One, 2011, 6(7): e22751. DOI:10.1371/journal.pone.0022751 |
| [24] |
Balloux F, Brønstad Brynildsrud O, van Dorp L, et al. From theory to practice: translating whole-genome sequencing (WGS) into the clinic[J]. Trends Microbiol, 2018, 26(12): 1035-1048. DOI:10.1016/j.tim.2018.08.004 |
| [25] |
Jiang Y, Wei Z, Wang Y, et al. Tracking a hospital outbreak of KPC-producing ST11 Klebsiella pneumoniae with whole genome sequencing[J]. Clin Microbiol Infect, 2015, 21(11): 1001-1007. DOI:10.1016/j.cmi.2015.07.001 |
| [26] |
Voor In't Holt AF, Severin JA, Lesaffre EMEH, et al. A systematic review and Meta-analyses show that carbapenem use and medical devices are the leading risk factors for carba-penem-resistant Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2014, 58(5): 2626-2637. DOI:10.1128/AAC.01758-13 |
| [27] |
Tebano G, Dyar OJ, Beovic B, et al. Practices, organisation, and regulatory aspects in advising on antibiotic prescription: the international ESCMID AntibioLegalMap survey[J]. Infection, 2019, 47(5): 749-760. DOI:10.1007/s15010-019-01298-2 |
| [28] |
Maraolo AE, Ong DSY, Cimen C, et al. Organization and training at national level of antimicrobial stewardship and infection control activities in Europe: an ESCMID cross-sectional survey[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(11): 2061-2068. DOI:10.1007/s10096-019-03648-2 |
| [29] |
Stone SP, Cooper BS, Kibbler CC, et al. The ORION statement: guidelines for transparent reporting of outbreak reports and intervention studies of nosocomial infection[J]. Lancet Infect Dis, 2007, 7(4): 282-288. DOI:10.1016/S1473-3099(07)70082-8 |



