2. 南方医科大学珠江医院输血科, 广东 广州 510280
2. Department of Transfusion Medicine, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
无乳链球菌(Streptococcus agalactiae,GBS)是孕产妇和新生儿感染的常见病原菌,主要定植在女性下消化道或泌尿生殖道。孕妇妊娠期间身体免疫力降低,母体易感染GBS,引起孕妇流产、早产、胎膜早破、羊膜炎及子宫内膜炎等一系列的妊娠并发症,并通过母婴垂直传播给新生儿,导致新生儿感染,引起新生儿肺炎、血流感染、脑膜炎等严重感染性疾病,甚至导致新生儿死亡[1-3]。近年来,随着抗菌药物的广泛使用,GBS对四环素、红霉素、克林霉素均有不同程度耐药[4],给临床抗感染治疗带来严峻挑战。本研究分析孕产妇生殖道GBS的血清型、耐药谱及耐药基因,为临床防治GBS感染提供参考依据。
1 对象与方法 1.1 研究对象根据《预防围产期B族链球菌病(中国)专家共识》[5],选择2020年1月—2021年6月入住某院妊娠晚期且生殖道分泌物检出GBS的孕产妇为研究对象(n=62例),年龄20~38岁,孕周35~37周。排除习惯性流产、有其他明确感染因素、有严重妊娠并发症及内科疾病的孕妇。研究获得医院伦理委员会批准。
1.2 方法 1.2.1 标本采集采用一次性无菌阴道拭子,在受检孕妇阴道下段1/3处旋转1周,收集阴道黏膜分泌物标本,置于无菌试管送检。
1.2.2 病原菌的分离培养、鉴定及药敏检测按照第四版《全国临床检验操作规范》相关要求,阴道黏膜分泌物接种于血琼脂培养基,置于35℃,5% CO2培养箱中,培养24 h后采用VITEK 2 Compact微生物系统进行病原菌鉴定及药敏试验,药敏结果判定参照美国临床和实验室标准化协会(CLSI)2021年的药敏标准[6]。
1.2.3 克林霉素诱导耐药性试验(D试验)采用K-B纸片琼脂扩散法(K-B法)检测GBS大环内酯类的耐药表型,GBS对红霉素及克林霉素有4个耐药表型[7]:若病原菌对克林霉素和红霉素均表现为耐药,即为内在型(cMLSB)表型;若病原菌对红霉素耐药,且靠近红霉素纸片一侧的克林霉素纸片出现类似字母D的抑菌环,D试验为阳性,即为诱导型(iMLSB)表型;如果病原菌对红霉素敏感或中介,而对克林霉素耐药,即为L型表型;如果病原菌对克林霉素敏感,对红霉素耐药,即为M型表型。
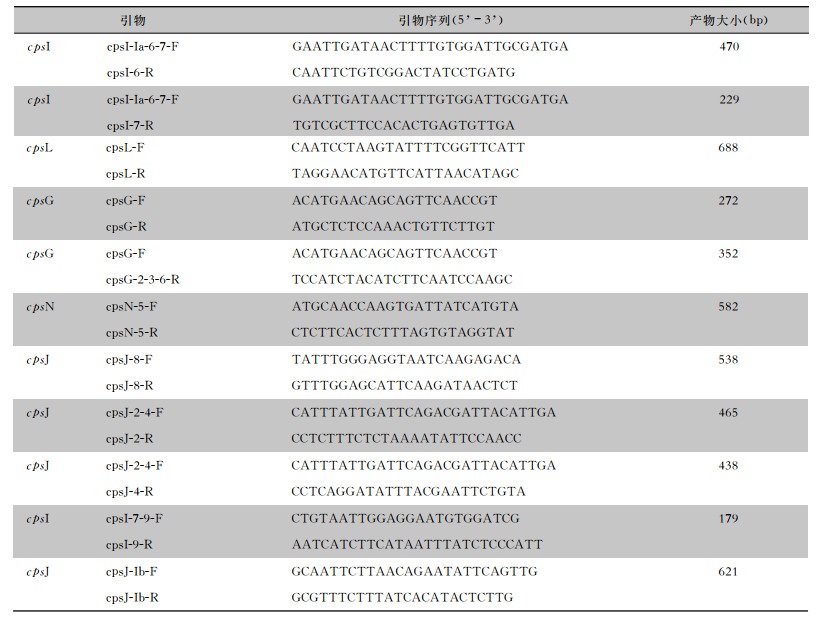
1.2.4 GBS血清分型与耐药基因检测使用QIAGEN DNA提取试剂盒提取GBS DNA,根据参考文献[8-9],设计GBS血清分型与耐药基因聚合酶链式反应(PCR)引物序列(见表 1、2)。参考Poyart等[8]基于GBS的cps基因差异性建立多重PCR方法,对GBS进行快速、准确地血清型分型。本研究的引物均由擎科生物公司合成,采用PCR扩增法检测GBS血清型与耐药基因,将PCR扩增产物送至擎科生物公司进行测序,并通过BLAST基因数据库进行序列比对分析。
| 表 1 GBS的血清型PCR引物序列 Table 1 PCR primer sequences of GBS serotypes |
|
| 表 2 GBS的四环素、红霉素、克林霉素耐药基因PCR引物序列 Table 2 PCR primer sequences of tetracycline, erythromycin and clindamycin resistance genes in GBS |

|
62株GBS共检出5个血清型,GBS血清型分别为Ⅲ型(30株,48.4%)、Ⅰ a型(16株,25.8%)、Ⅰ b型(8株,12.9%)、Ⅴ型(6株,9.7%)、Ⅵ型(2株,3.2%)。见图 1。
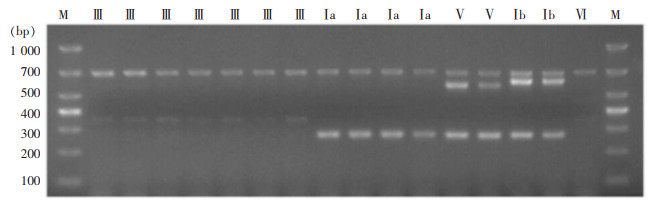 |
| 注:M为DLl 000 Marker,Ⅲ、Ⅰ a、Ⅴ、Ⅰ b、Ⅵ为对应的血清型基因。 图 1 GBS血清分型PCR扩增产物电泳图 Figure 1 Electrophoresis map of PCR amplification products for GBS serotyping |
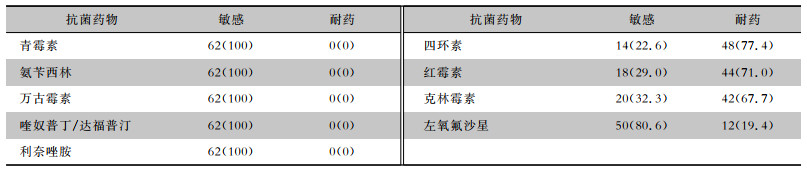
GBS对四环素、红霉素、克林霉素有较高的耐药性,耐药率分别为77.4%、71.0%、67.7%,对氨苄西林、青霉素、喹奴普丁/达福普汀、利奈唑胺、万古霉素敏感率为100%,未发现对常见抗菌药物中介的菌株。见表 3。
| 表 3 62株GBS对常见抗菌药物的药敏结果[株(%)] Table 3 Drug susceptibility test results of 62 GBS strains to commonly used antimicrobial agents (No. of isolates[%]) |
|
耐四环素GBS检出tetM 36株(75.0%)、tetO 16株(33.3%)、tetL 2株(4.2%),耐红霉素GBS检出ermB 32株(72.7%)、mefA/E 10株(22.7%)、ermA 8株(18.2%)、ermTR 6株(13.6%),耐克林霉素GBS检出linB 18株(42.9%)。见图 2。
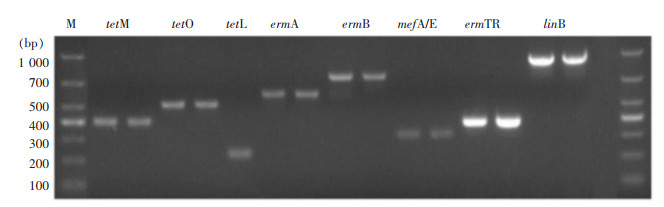 |
| 注:M为DL1 000 Marker,tetM、tetO、tetL、ermA、ermB、mefA/E、ermTR、linB为对应的耐药基因。 图 2 GBS耐药基因PCR扩增产物电泳图 Figure 2 Electrophoresis map of PCR amplification products for GBS drug resistance genes |
耐药表型主要以cMLSB表型为主,占75.0%,其次是M表型(占12.5%)、L表型(占8.3%)、iMLSB表型(占4.2%)。其中cMLSB表型主要由ermB(44.4%,16/36)基因、ermB+linB(27.8%,10/36)基因介导。见表 4。
| 表 4 GBS红霉素和克林霉素耐药表型与基因型的关联 Table 4 Correlation between erythromycin and clindamycin resistance phenotypes and genotypes of GBS |

|
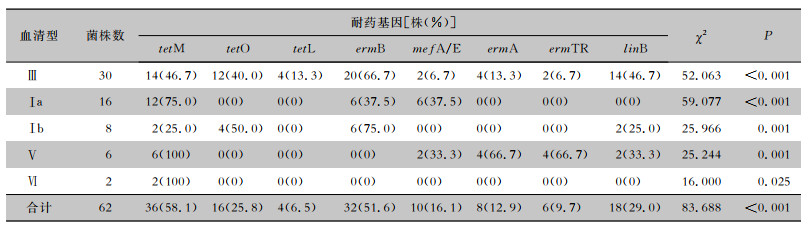
Ⅲ型血清型携带的耐药基因主要为ermB (66.7%)、tetM(46.7%)、linB(46.7%)、tetO(40.0%),Ⅰ a血清型携带的耐药基因主要为tetM(75.0%),Ⅰ b血清型携带的耐药基因主要为ermB(75.0%),Ⅴ血清型携带的耐药基因主要为tetM(100%),Ⅵ血清型携带的耐药基因主要为tetM(100%)。见表 5。
| 表 5 GBS不同血清分型中不同抗菌药物耐药基因检出情况 Table 5 Detection results of antimicrobial resistance genes in different GBS serotypes |
|
GBS是围产期感染的常见病原菌,常定植在女性下消化道或泌尿生殖道。GBS可以通过产道扩散感染子宫,引起子宫内膜炎和血流感染,并且具有一定的垂直传播率,可以引发早产、胎儿窒息和新生儿严重的感染性疾病[1-3]。近年来,关于GBS引起新生儿感染的报道屡见不鲜,GBS造成的母婴感染逐渐受到医学界关注,成为国内引起孕妇及婴儿感染的重要病原菌。因此,了解GBS血清型、耐药谱及耐药基因,有助于预防和治疗母婴GBS感染。
GBS表面的荚膜多糖是其重要的毒力因子,还可以作为血清学分类的主要依据。因此,了解GBS血清型对确定其致病性非常重要[10]。按GBS上荚膜多糖类型可分为Ⅰ a、Ⅰ b、Ⅱ~Ⅸ等10种血清型,其中5种(Ⅰ a、Ⅰ b、Ⅱ、Ⅲ和Ⅴ) 是GBS的主要类型[11]。本研究根据分子血清分型检出5种血清型(Ⅰ a、Ⅰ b、Ⅲ、Ⅴ、Ⅵ),主要为Ⅲ、Ⅰ b、Ⅰ a(87.1%)血清型,与国内报道[12]的血清型分布和占比(93.0%)基本一致。其他研究[13-14]中不同地区的主要血清型,如巴西Ⅰ a、Ⅱ、Ⅰ b血清型(65.4%)与加拿大Ⅲ、Ⅰ a、Ⅰ b、Ⅱ、Ⅴ、Ⅳ血清型(92.9%),与本研究血清型分布不同。因此,由于不同国家的地域性差异、研究对象的个体特征不同,GBS的血清型分布也存在着空间以及人群差异。报告[15]显示,Ⅲ型血清型在新生儿感染病例中检出更多,其致病性也较其他血清型强。本研究Ⅲ型血清型高达48.4%,应予以重视。GBS的荚膜多糖(CPS)不仅是血清分型的基础,也是疫苗研究的重要靶点。疫苗是预防GBS感染最有效的方式,了解GBS血清型分布对开发基于CPS的多价疫苗至关重要。
根据美国GBS医疗指导方针,GBS对大多数β-内酰胺类抗生素敏感,青霉素是治疗GBS感染的首选药物[5]。本研究显示,GBS对氨苄西林、青霉素的敏感率为100%,故二者可以作为治疗GBS感染的一线用药,但需注意过敏反应。克林霉素与红霉素曾被广泛作为治疗GBS感染的二线用药,然而GBS对克林霉素与红霉素的耐药率逐渐上升,已引起世界范围内的关注,且我国报道的耐药率高于国外相关报道[4, 16]。本研究中GBS对克林霉素和红霉素具有高度耐药性,耐药率分别为67.7%、71.0%,建议临床对两者的用药予以重新评价;对四环素的耐药率最高,为77.4%,临床应予以重视。虽然未检测到奎奴普丁/达福普汀、利奈唑胺、万古霉素的耐药菌株,但万古霉素具肝肾毒性,在孕产妇中的使用受到限制,而奎奴普丁/达福普汀及利奈唑胺也不适用于孕产妇的抗感染治疗。因此,针对GBS感染,青霉素可作为一线用药,对青霉素过敏者要做药敏试验,并根据试验结果选择适当抗菌药物,以达到及时、有效的临床疗效。
本研究GBS耐药谱表明,GBS对红霉素、克林霉素、四环素具有不同程度的耐药性。ermA、ermB、ermTR和mefA/E是红霉素耐药基因。erm基因编码的甲基化酶引起核糖体构型改变,使作用于抗菌药物的结合靶位点发生改变,阻碍GBS与红霉素的结合。mef基因编码外排蛋白使病原菌主动将红霉素泵出菌体外,从而产生耐药[17]。本研究显示,对红霉素耐药的GBS菌株主要耐药基因为ermB(72.7%),提示ermB基因介导的耐药机制可能在GBS耐药中起主导作用。GBS主要耐药表型为cMLSB(75.0%),与国内外近年来的研究数据基本一致[17-18]。分析cMLSB表型的耐药基因,发现以ermB基因为主。tetM、tetO、tetL和tetK为四环素耐药基因,tetM和tetO编码核糖体保护蛋白,使四环素无法与细菌核糖体结合;tetK和tetL编码外排蛋白,从而产生四环素耐药[19]。本研究中四环素耐药主要由tetM、tetO介导,携带率分别为75.0%、33.3%。克林霉素耐药由编码林可酰胺核苷酸转移酶的linB基因介导,本研究中linB携带率为42.9%。此外,64.5%的GBS同时携带红霉素和四环素耐药基因,主要为ermB和tetM,多种耐药基因的出现可能与耐药基因的水平转移有关。本研究还发现,GBS菌株中存在特定的血清型-耐药基因组合,其中Ⅲ型血清型与ermB基因有关,Ⅰa血清型与tetM基因有关。Ⅲ型血清型与新生儿重症感染密切相关,因此研究血清Ⅲ型GBS的耐药机制更有临床意义。
综上所述,GBS血清型主要以Ⅲ型为主,GBS对四环素、红霉素、克林霉素有着较高的耐药性,四环素耐药以tetM、tetO基因介导为主,红霉素耐药以ermB基因介导的cMLSB型为主,克林霉素耐药以linB基因介导为主。因此,加强对GBS流行病学的监测,有助于更好地了解GBS耐药流行株的发生及传播规律,有助于临床制订防治方案,对预防和控制耐药株的产生极为重要。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Lin C, Chu SM, Wang HC, et al. Complicated Streptococcus agalactiae sepsis with/without meningitis in young infants and newborns: the clinical and molecular characteristics and outcomes[J]. Microorganisms, 2021, 9(10): 2094. DOI:10.3390/microorganisms9102094 |
| [2] |
Nanduri SA, Petit S, Smelser C, et al. Epidemiology of invasive early-onset and late-onset group B streptococcal disease in the United States, 2006 to 2015: multistate laboratory and population-based surveillance[J]. JAMA Pediatr, 2019, 173(3): 224-233. DOI:10.1001/jamapediatrics.2018.4826 |
| [3] |
覃德明, 胡龙华. B族链球菌在围产期妇女的情况和血清型分型研究进展[J]. 实验与检验医学, 2021, 39(5): 1318-1322. Qin DM, Hu LH. Progress in the study of the status and serotyping of group B streptococci in perinatal women[J]. Experimental and Laboratory Medicine, 2021, 39(5): 1318-1322. DOI:10.3969/j.issn.1674-1129.2021.05.079 |
| [4] |
Oppegaard O, Skrede S, Mylvaganam H, et al. Emerging threat of antimicrobial resistance in β-hemolytic streptococci[J]. Front Microbiol, 2020, 11: 797. DOI:10.3389/fmicb.2020.00797 |
| [5] |
中华医学会围产医学分会, 中华医学会妇产科学分会产科学组. 预防围产期B族链球菌病(中国)专家共识[J]. 中华围产医学杂志, 2021, 24(8): 561-566. Perinatal Medicine Branch of the Chinese Medical Association, Obstetrics and Gynecology Section of the Chinese Medical Association. Chinese experts consensus on prevention of perinatal group B streptococcal disease[J]. Chinese Journal of Perinatal Medicine, 2021, 24(8): 561-566. DOI:10.3760/cma.j.cn113903-20210716-00638 |
| [6] |
Clinical and Laboratory Standards Institute. CLSI publishes M100—performance standards for antimicrobial susceptibility testing, 31st edition[EB/OL]. (2021-03-29)[2022-07-20]. https://clsi.org/about/press-releases/clsi-publishes-m100-performance-standards-for-antimicrobial-susceptibility-testing-31st-edition/.
|
| [7] |
李娟, 高坎坎, 容莉莉, 等. 新生儿侵袭性感染B族链球菌的耐药表型及耐药机制[J]. 中华实验和临床感染病杂志(电子版), 2018, 12(1): 20-27. Li J, Gao KK, Rong LL, et al. Resistance patterns and mechanism of group B Streptococcus isolated from infants with invasive disease[J]. Chinese Journal of Experimental and Clinical Infectious Diseases(Electronic Edition), 2018, 12(1): 20-27. DOI:10.3877/cma.j.issn.1674-1358.2018.01.005 |
| [8] |
Poyart C, Tazi A, Réglier-Poupet H, et al. Multiplex PCR assay for rapid and accurate capsular typing of group B streptococci[J]. J Clin Microbiol, 2007, 45(6): 1985-1988. DOI:10.1128/JCM.00159-07 |
| [9] |
Bolukaoto JY, Monyama CM, Chukwu MO, et al. Antibiotic resistance of Streptococcus agalactiae isolated from pregnant women in Garankuwa, South Africa[J]. BMC Res Notes, 2015, 8: 364. DOI:10.1186/s13104-015-1328-0 |
| [10] |
Mukesi M, Iweriebor BC, Obi LC, et al. Prevalence and capsular type distribution of Streptococcus agalactiae isolated from pregnant women in Namibia and South Africa[J]. BMC Infect Dis, 2019, 19(1): 179. DOI:10.1186/s12879-019-3809-6 |
| [11] |
Shabayek S, Spellerberg B. Group B streptococcal colonization, molecular characteristics, and epidemiology[J]. Front Microbiol, 2018, 9: 437. DOI:10.3389/fmicb.2018.00437 |
| [12] |
Cheng ZM, Qu PH, Ke PF, et al. Antibiotic resistance and molecular epidemiological characteristics of Streptococcus agalactiae isolated from pregnant women in Guangzhou, South China[J]. Can J Infect Dis Med Microbiol, 2020, 2020: 1368942. |
| [13] |
do Nascimento CS, Dos Santos NFB, Ferreira RCC, et al. Streptococcus agalactiae in pregnant women in Brazil: prevalence, serotypes, and antibiotic resistance[J]. Braz J Micro-biol, 2019, 50(4): 943-952. DOI:10.1007/s42770-019-00129-8 |
| [14] |
Ma A, Thompson LA, Corsiatto T, et al. Epidemiological characterization of group B Streptococcus infections in Alberta, Canada: an update from 2014 to 2020[J]. Microbiol Spectr, 2021, 9(3): e0128321. DOI:10.1128/Spectrum.01283-21 |
| [15] |
Wu BQ, Su JZ, Li L, et al. Phenotypic and genetic differences among group B Streptococcus recovered from neonates and pregnant women in Shenzhen, China: 8-year study[J]. BMC Microbiol, 2019, 19(1): 185. DOI:10.1186/s12866-019-1551-2 |
| [16] |
陈华, 俞萍, 张吉平, 等. 围生期妇女生殖道感染B族链球菌耐药基因及毒力基因分析[J]. 中华医院感染学杂志, 2021, 31(12): 1916-1920. Chen H, Yu P, Zhang JP, et al. Analysis of resistance genes and virulence genes of group B Streptococcus in the perinatal women with reproductive tract infection[J]. Chinese Journal of Nosocomiology, 2021, 31(12): 1916-1920. |
| [17] |
Motallebirad T, Fazeli H, Azadi D, et al. Determination of capsular serotypes, antibiotic susceptibility pattern, and molecular mechanism of erythromycin resistance among clinical isolates of group B Streptococcus in Isfahan, Iran[J]. Adv Biomed Res, 2021, 10: 27. DOI:10.4103/abr.abr_269_20 |
| [18] |
Guo HW, Fu MZ, Peng Q, et al. Antimicrobial resistance and molecular characterization of Streptococcus agalactiae from pregnant women in southern China[J]. J Infect Dev Ctries, 2019, 13(9): 802-809. DOI:10.3855/jidc.11395 |
| [19] |
Gizachew M, Tiruneh M, Moges F, et al. Molecular characterization of Streptococcus agalactiae isolated from pregnant women and newborns at the University of Gondar Comprehensive Specialized Hospital, Northwest Ethiopia[J]. BMC Infect Dis, 2020, 20(1): 35. DOI:10.1186/s12879-020-4776-7 |



