2. 兰州大学第一医院老年病三科, 甘肃 兰州 730000;
3. 兰州大学第一医院重症医学科, 甘肃 兰州 730000;
4. 兰州大学第一医院护理部, 甘肃 兰州 730000;
5. 兰州大学循证医学中心, 甘肃 兰州 730000
2. Department-3 of Geriatrics, The First Hospital of Lanzhou University, Lanzhou 730000, China;
3. Department of Critical Care Medicine, The First Hospital of Lanzhou University, Lanzhou 730000, China;
4. Department of Nursing, The First Hospital of Lanzhou University, Lanzhou 730000, China;
5. Evidence-Based Medicine Centre, Lanzhou University, Lanzhou 730000, China
艰难梭菌(Clostridium difficile, CD)是艰难梭菌感染(Clostridium difficile infection, CDI)的病原体,是引起医院相关性腹泻的原因之一,占医院腹泻病例的15%~25%[1-2]。随着CDI感染率的不断增加,给国家公共卫生事业带来严峻挑战[3]。目前抗菌药物是治疗CDI的首选方法,但是复发率较高,从而导致住院患者死亡绝对风险增加了10%[4]。同时也增加了危及生命的严重并发症(即中毒性巨结肠和脓毒性休克)[5-8]。粪菌移植(fecal microbiota transplantation, FMT)是复发性艰难梭菌感染(recurrent Clostridium difficile infection,RCDI)患者的一种新的治疗方法[9-11],对复杂或严重的RCDI均有较好的疗效[12-13]。但是,目前仅1/4医院愿意采用FMT治疗RCDI,其原因可能是因为缺乏FMT安全性的证据[14]。因此,非常有必要评价FMT治疗RCDI的安全性,以期为指导临床工作提供客观的依据。
1 资料与方法 1.1 纳入与排除标准纳入标准:①研究对象:确诊的RCDI患者;②干预措施:不同类型的FMT之间或FMT与抗菌药物的比较,粪菌主要包括:新鲜、冰冻及冻干粪菌(新鲜粪菌是捐赠者的个人新鲜粪便标本用生理盐水在8 h内给予稀释后过滤处理,细菌数量略有减少,随后取适量过滤液给患者使用;冰冻粪便是将用生理盐水过滤后的新鲜粪菌储存在-80℃下的冰冻容器内,并在制备后6个月内使用;冻干粪菌是将过滤后的新鲜粪菌溶液冷冻在-80℃的容器中,然后将其置于冷冻干燥系统下至少6 h,使产品中的水份蒸发而不升华干燥,冻干后,将产品保存在4℃下的密封容器中备用,并在制备后6个月内使用);③研究类型:随机对照试验(randomized controlled trial, RCT);④结局指标:不良反应发生率。
排除标准:①动物试验研究;②非艰难梭菌单纯原因引起的腹泻;③非中英文文献;④数据不全或重复发表的文献;⑤结局指标中未提及不良反应的研究。
1.2 检索策略计算机检索中国生物医学文献数据库(CBM)、中国知网(CNKI)、万方、PubMed、Cochrane Library、Web of Science、EMbase数据库,检索时限均为建库至2022年1月16日,检索语种不限,同时追踪纳入研究的参考文献以补充检索。检索策略采用主题词和自由词相结合的方式进行检索,英文检索词:fecal、faecal、microbiota、microflora、feces、faeces、stool、fecal flora、faecal flora、transplant、transfusion、implantation、implant、instillation、microbiota、donor、enema、reconstitution、infusion、therapy、bacteriotherapy、Clostridium difficile infection、CDI、randomized controlled trial、RCT;中文检索词:粪便、粪菌、肠菌、肠道微生物、移植、治疗、微生物疗法、微生态移植、艰难梭菌感染、随机、随机对照试验。
1.3 文献筛选和资料提取根据纳入和排除标准,由2名研究人员对文献进行独立初筛,对于初步纳入的文献调阅全文,提取资料。如遇分歧,则协商解决。研究者按资料提取表提取以下资料:①纳入研究的基本信息;②研究对象的基线特征;③所关注的结局指标和结果测量数据。
1.4 文献质量评价2名研究者按照Cochrane手册[14]评价纳入研究的偏倚风险。评价内容包括:随机序列的产生、分配隐藏、参与者及研究者盲法、结果测评者盲法、结局指标完整性、选择性报道及其他偏倚来源。A为完全满足上述要求,B为部分满足上述要求,C为完全不满足上述要求,发生偏倚风险A最小,B其次,C最大。
1.5 统计学方法应用RevMan 5.3软件对纳入研究的数据进行Meta分析。各效应量均以95%可信区间(CI)表示,计数资料采用比值比(OR)作为效应指标;连续性资料如使用测量工具相同,则采用加权均数差(MD),如使用测量工具不同,则采用标准化均数差(SMD)进行分析;采用卡方检验分析统计学异质性(检验水准为α=0.1),当各研究结果间统计学同质性较好(P>0.05,I2<50%)时,采用固定效应模型分析;如各研究结果间存在统计学异质性(P≤0.05,I2≥50%),则分析异质性来源,若无临床异质性,则采用随机效应模型进行分析;若异质性较大(P<0.05,I2>85%)且无法判断异质性来源,则采用描述性分析。
2 结果 2.1 文献筛选流程及结果初检出相关文献598篇,最终纳入11篇文献[15-25]。文献筛选流程见图 1。
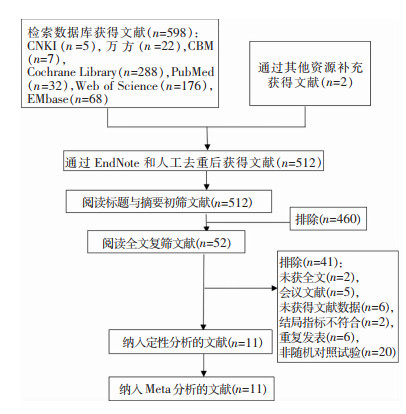 |
| 图 1 文献纳入流程图 Figure 1 Flow chart of the studies inclusion |
纳入的11篇RCT[15-25]发表于2013—2019年,共纳入了756例患者。纳入的研究对干预方法均有详细描述,且有明确的结局指标。纳入的RCDI相关文献的基本特征见表 1。
| 表 1 纳入RCDI文献的基本特征 Table 1 Basic characteristics of the included literatures on RCDI |
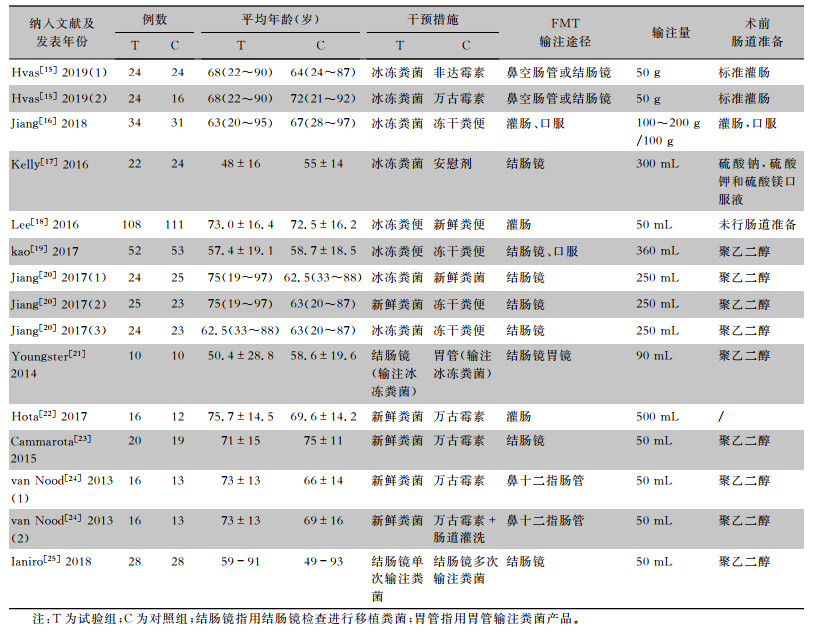
|
纳入的11篇RCT有7篇文献采用随机数字表随机,4篇研究只提及随机;所有纳入的研究仅4篇研究采用分配隐藏,其余均未提及;有5篇研究采用盲法,4篇未采用盲法,其余均未报道;均未有不完整数据报告和数据缺失。见表 2。
| 表 2 纳入文献的方法学质量特征 Table 2 Quality characteristics of methodology of included literatures |
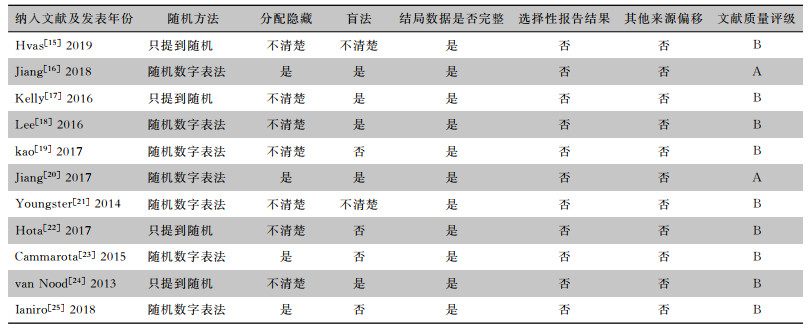
|
11篇研究均报告了FMT治疗RCDI后患者不良反应的发生情况。其中7篇研究无发生不良反应的具体数值,无法进行数据合并,故仅进行描述性分析。kelly等[17]研究结果显示:自体粪菌移植患者出现寒战的频率高于供体粪菌移植的患者(P=0.053);其他不良反应两组间比较,差异无统计学意义(均P>0.05),主要不良反应有:发热、腹痛、腹胀、恶心、呕吐、腹泻、胀气、厌食和便秘,患者在随访过程中又出现了新的并发症,但结果都证实与粪菌移植治疗无关。Jiang等[20]研究结果显示,粪菌移植后患者未出现严重的不良反应,但出现了恶心、轻度腹泻、腹部不适、发热、疲乏、头痛、体重增加不良反应。Youngster等[21]研究结果也显示,粪菌移植治疗后患者会出现轻度的腹部不适、腹胀。Hota等[22]研究结果显示,粪菌移植治疗后的0~7 d与7~14 d患者均出现了发热、恶心、呕吐、腹痛、腹胀、黏液便、血便、大便失禁、厌食、疲乏等不良反应。Cammarota等[23]研究结果显示,粪菌移植治疗后患者出现了腹泻、腹痛、腹胀,这些症状在12 h内都逐渐缓解。van Nood等[24]研究结果表明,粪菌移植治疗后患者出现了打嗝、恶心、腹痛、腹泻的不良反应,这些症状均在3 h内自愈。Ianiro等[25]研究结果也表明,粪菌移植治疗后患者出现了轻度腹泻和便秘,但在随访期间均逐步缓解。
对冰冻粪菌治疗RCDI后出现的不良反应进行合并分析,异质性检验结果:I2=0,P=0.85,故采用固定效应模型进行Meta分析,4篇研究Meta分析结果合并显示冰冻粪菌与万古霉素或非达霉素、新鲜或冻干粪菌治疗RCDI后患者不良反应的发生率比较,差异无统计学意义[OR=1.62,95%CI(0.92, 2.86),P=0.10];通过亚组分析,冰冻粪菌相比万古霉素或非达霉素治疗RCDI后患者不良反应的发生率,差异无统计学意义[OR=1.32,95%CI(0.57, 3.09),P=0.52],冰冻粪菌与冻干粪菌治疗RCDI后患者不良反应的发生率比较,差异无统计学意义[OR=1.76, 95%CI(0.66, 4.72), P=0.26],冰冻粪菌相比新鲜粪菌治疗RCDI后患者不良反应的发生率,差异无统计学意义[OR=2.14,95%CI(0.63, 7.33),P=0.23],见图 2。1篇研究Meta分析结果显示新鲜粪菌相比自体粪菌治疗RCDI后患者不良反应的发生率,差异也无统计学意义[OR=0.33,95%CI(0.03, 3.47),P=0.36],见图 3。
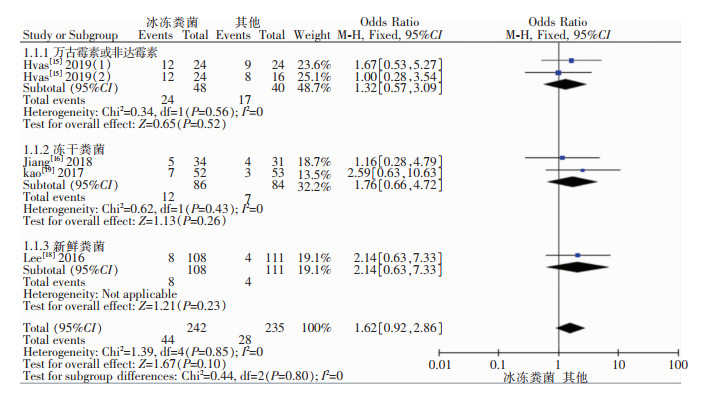 |
| 图 2 冰冻粪菌移植治疗RCDI后不良反应发生率的Meta分析结果 Figure 2 Meta-analysis on adverse reaction rate after frozen FMT for treatment of RCDI |
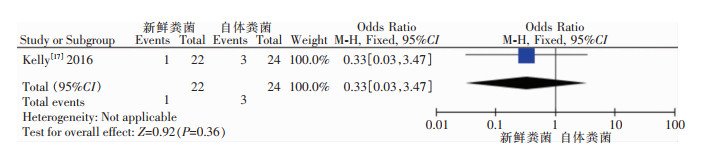 |
| 图 3 新鲜粪菌移植治疗RCDI后不良反应发生率的Meta分析结果 Figure 3 Meta-analysis on adverse reaction rate after fresh FMT for treatment of RCDI |
纳入的11篇研究均符合质量评价标准,文献质量均在B级以上,但是部分文献未报道随机分配方法、分配隐藏、是否使用盲法。后续相关研究在随机方法、分配隐藏、盲法和数据完整性方面可进一步提高严谨性,以达更高质量水平。
3.2 FMT在治疗RCDI时不良反应系统评价FMT是指将健康供体的粪便悬浮液输注于患者体内,以便恢复RCDI患者的正常肠道微生物群,重建肠道菌群平衡,修复肠黏膜屏障,控制炎症反应,调节机体免疫进而达到治疗RCDI的目的。从本质上讲,FMT的作用是在患者结肠内重建肠道微生物群,打破CDI的复发循环[26]。虽然FMT在治疗RCDI中的作用机制目前尚不太清楚,但研究发现FMT通过激活不同的免疫介导途径,减少肠道炎症并启动肠内稳态的恢复,最终导致先天性和适应性免疫细胞产生IL-10,并降低树突细胞、单核细胞和巨噬细胞向结肠T细胞呈递MHCII依赖性细菌抗原的能力,其中拟杆菌和厚壁菌是FMT治疗RCDI的关键成分[27]。另外,粪便中的可溶性因子也在抵御RCDI中发挥一定作用,移植的粪菌还可竞争RCDI营养或受体,上调固有免疫功能、促进肠道屏障功能修复,进而抑制CDI复发。Mullish等[28]研究发现,FMT可通过恢复肠道菌群的胆盐水解酶活性,以促进牛磺胆酸的水解,从而治疗RCDI[29]。尽管FMT仍存在许多挑战,但将其广泛用于RCDI仍有一定的治疗前景[30]。现有研究结果和循证医学证据表明新鲜粪菌、冰冻粪菌和冻干粪菌在RCDI总体治愈率方面比较,差异无统计学意义,主要是由于三种粪菌肠道菌群的数量和种类类似,故冰冻粪菌和冻干粪菌能达到和新鲜粪菌相似的治疗效果[15-16, 18-19]。虽然在FMT治疗的过程中,患者出现不同程度的发热、腹胀、腹痛、腹泻等不适症状,但是研究发现患者出现这些不良反应与FMT本身无较大的相关性,主要是由于在FMT治疗后,肠道微生物群的组成发生变化,导致受体肠黏膜免疫功能、黏膜细胞基因表达、肠道微生态环境和患者自身代谢差异的改变相关[31-34]。
本研究结果显示冰冻粪菌、新鲜粪菌移植治疗RCDI后会出现一些不良反应,大部分都是由于粪菌移植后患者肠道内微生物菌群发生改变引起的,且这些不良反应都是较轻症的反应,不会给患者造成其他损伤性疾病的发生,这与前期Tang等[35]的研究结果一致。
本研究也存在一定的局限性。仅4个研究有详细的数据描述了患者不良反应的发生率,但是并未对每种不良反应进行具体的数据分析。7篇文献对患者的不良反应进行了描述,但是并未对不良反应的具体原因及预防措施进行详细阐述,希望以后可以对FMT治疗RCDI后患者出现的不良反应进行更详细的研究报道。
4 小结现有证据显示粪菌移植治疗RCDI后患者出现的不良反应与粪菌移植治疗无直接的相关性,是由于粪菌移植后肠道微生物菌群发生改变而引起,上述结论尚需开展更多高质量研究予以证实。而且目前越来越多的研究表明,肠道菌群或某些特殊微生物失调与各种癌症之间有着紧密的联系,希望以后在FMT治疗癌症方面有更多的结论。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Czepiel J, Dróżdż M, Pituch H, et al. Clostridium difficile infection: review[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(7): 1211-1221. DOI:10.1007/s10096-019-03539-6 |
| [2] |
Goyal H, Perisetti A, Rehman MR, et al. New and emerging therapies in treatment of Clostridium difficile infection[J]. Eur J Gastroenterol Hepatol, 2018, 30(6): 589-597. DOI:10.1097/MEG.0000000000001103 |
| [3] |
Song JH, Kim YS. Recurrent Clostridium difficile infection: risk factors, treatment, and prevention[J]. Gut Liver, 2019, 13(1): 16-24. DOI:10.5009/gnl18071 |
| [4] |
Madoff SE, Urquiaga M, Alonso CD, et al. Prevention of recurrent Clostridioides difficile infection: a systematic review of randomized controlled trials[J]. Anaerobe, 2020, 61: 102098. DOI:10.1016/j.anaerobe.2019.102098 |
| [5] |
Mullish BH, Williams HR. Clostridium difficile infection and antibiotic-associated diarrhoea[J]. Clin Med (Lond), 2018, 18(3): 237-241. |
| [6] |
Kullar R, Tran MCN, Goldstein EJC. Investigational treatment agents for recurrent Clostridioides difficile infection (rCDI)[J]. J Exp Pharmacol, 2020, 12: 371-384. DOI:10.2147/JEP.S242959 |
| [7] |
You JHS, Jiang XC, Lee WH, et al. Cost-effectiveness analysis of fecal microbiota transplantation for recurrent Clostridium difficile infection in patients with inflammatory bowel di-sease[J]. J Gastroenterol Hepatol, 2020, 35(9): 1515-1523. DOI:10.1111/jgh.15002 |
| [8] |
Gupta A, Ananthakrishnan AN. Economic burden and cost-effectiveness of therapies for Clostridiodes difficile infection: a narrative review[J]. Therap Adv Gastroenterol, 2021, 14: 17562848211018654. |
| [9] |
Hammeken LH, Baunwall SMD, Hvas CL, et al. Health economic evaluations comparing faecal microbiota transplantation with antibiotics for treatment of recurrent Clostridioides difficile infection: a systematic review[J]. Health Econ Rev, 2021, 11(1): 3. DOI:10.1186/s13561-021-00301-7 |
| [10] |
杨丽平, 韩露露, 张志刚, 等. 新鲜粪菌移植在治疗艰难梭菌感染性腹泻方面的疗效及安全性的Meta分析[J]. 中国微生态学杂志, 2021, 33(7): 765-769. Yang LP, Han LL, Zhang ZG, et al. Efficacy and safety of fresh fecal microbiota transplantation for treatment of recurrent Clostridium difficile infection: a Meta-analysis[J]. Chinese Journal of Microecology, 2021, 33(7): 765-769. DOI:10.13381/j.cnki.cjm.202107004 |
| [11] |
Jørgensen SMD, Hansen MM, Erikstrup C, et al. Faecal microbiota transplantation: establishment of a clinical application framework[J]. Eur J Gastroenterol Hepatol, 2017, 29(11): e36-e45. DOI:10.1097/MEG.0000000000000958 |
| [12] |
Fischer M, Sipe B, Cheng YW, et al. Fecal microbiota transplant in severe and severe-complicated Clostridium difficile: a promising treatment approach[J]. Gut Microbes, 2017, 8(3): 289-302. DOI:10.1080/19490976.2016.1273998 |
| [13] |
van Beurden YH, Nieuwdorp M, van de Berg PJEJ, et al. Current challenges in the treatment of severe Clostridium difficile infection: early treatment potential of fecal microbiota transplantation[J]. Therap Adv Gastroenterol, 2017, 10(4): 373-381. DOI:10.1177/1756283X17690480 |
| [14] |
Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions: version 5.1.0[EB/OL]. [2022-05-05]. http://handbook-5-1.cochrane.org/.
|
| [15] |
Hvas CL, Dahl Jørgensen SM, Jørgensen SP, et al. Fecal microbiota transplantation is superior to fidaxomicin for treatment of recurrent Clostridium difficile infection[J]. Gastroenterology, 2019, 156(5): 1324-1332. e3. DOI:10.1053/j.gastro.2018.12.019 |
| [16] |
Jiang ZD, Jenq RR, Ajami NJ, et al. Safety and preliminary efficacy of orally administered lyophilized fecal microbiota product compared with frozen product given by enema for recurrent Clostridium difficile infection: a randomized clinical trial[J]. PLoS One, 2018, 13(11): e0205064. DOI:10.1371/journal.pone.0205064 |
| [17] |
Kelly CR, Khoruts A, Staley C, et al. Effect of fecal microbiota transplantation on recurrence in multiply recurrent Clos-tridium difficile infection: a randomized trial[J]. Ann Intern Med, 2016, 165(9): 609-616. DOI:10.7326/M16-0271 |
| [18] |
Lee CH, Steiner T, Petrof EO, et al. Frozen vs fresh fecal microbiota transplantation and clinical resolution of diarrhea in patients with recurrent Clostridium difficile infection: a randomized clinical trial[J]. JAMA, 2016, 315(2): 142-149. DOI:10.1001/jama.2015.18098 |
| [19] |
Kao D, Roach B, Silva M, et al. Effect of oral capsulevs colonoscopy-delivered fecal microbiota transplantation on recurrent Clostridium difficile infection: a randomized clinical trial[J]. JAMA, 2017, 318(20): 1985-1993. DOI:10.1001/jama.2017.17077 |
| [20] |
Jiang ZD, Ajami NJ, Petrosino JF, et al. Randomised clinical trial: faecal microbiota transplantation for recurrent Clostridum difficile infection-fresh, or frozen, or lyophilised microbiota from a small pool of healthy donors delivered by colonoscopy[J]. Aliment Pharmacol Ther, 2017, 45(7): 899-908. DOI:10.1111/apt.13969 |
| [21] |
Youngster I, Sauk J, Pindar C, et al. Fecal microbiota transplant for relapsing Clostridium difficile infection using a frozen inoculum from unrelated donors: a randomized, open-label, controlled pilot study[J]. Clin Infect Dis, 2014, 58(11): 1515-1522. DOI:10.1093/cid/ciu135 |
| [22] |
Hota SS, Sales V, Tomlinson G, et al. Oral vancomycin followed by fecal transplantation versus tapering oral vancomycin treatment for recurrent Clostridium difficile infection: an open-label, randomized controlled trial[J]. Clin Infect Dis, 2017, 64(3): 265-271. DOI:10.1093/cid/ciw731 |
| [23] |
Cammarota G, Masucci L, Ianiro G, et al. Randomised clinical trial: faecal microbiota transplantation by colonoscopy vs. vancomycin for the treatment of recurrent Clostridium difficile infection[J]. Aliment Pharmacol Ther, 2015, 41(9): 835-843. DOI:10.1111/apt.13144 |
| [24] |
van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile[J]. N Engl J Med, 2013, 368(5): 407-415. DOI:10.1056/NEJMoa1205037 |
| [25] |
Ianiro G, Masucci L, Quaranta G, et al. Randomised clinical trial: faecal microbiota transplantation by colonoscopy plus vancomycin for the treatment of severe refractory Clostridium difficile infection-single versus multiple infusions[J]. Aliment Pharmacol Ther, 2018, 48(2): 152-159. DOI:10.1111/apt.14816 |
| [26] |
季欣欣, 孟秀娟. 艰难梭菌感染的诊断及治疗研究进展[J]. 中国感染控制杂志, 2019, 18(6): 600-606. Ji XX, Meng XJ. Advances in diagnosis and treatment of Clostridium difficile infection[J]. Chinese Journal of Infection Control, 2019, 18(6): 600-606. |
| [27] |
Beinortas T, Burr NE, Wilcox MH, et al. Comparative efficacy of treatments for Clostridium difficile infection: a systematic review and network Meta-analysis[J]. Lancet Infect Dis, 2018, 18(9): 1035-1044. DOI:10.1016/S1473-3099(18)30285-8 |
| [28] |
Mullish BH, McDonald JAK, Pechlivanis A, et al. Microbial bile salt hydrolases mediate the efficacy of faecal microbiota transplant in the treatment of recurrent Clostridioides difficile infection[J]. Gut, 2019, 68(10): 1791-1800. DOI:10.1136/gutjnl-2018-317842 |
| [29] |
Wang JW, Kuo CH, Kuo FC, et al. Fecal microbiota transplantation: review and update[J]. J Formos Med Assoc, 2019, 118(Suppl 1): S23-S31. |
| [30] |
Bang BW, Park JS, Kim HK, et al. Fecal microbiota transplantation for refractory and recurrent Clostridium difficile infection: a case series of nine patients[J]. Korean J Gastroenterol, 2017, 69(4): 226-231. DOI:10.4166/kjg.2017.69.4.226 |
| [31] |
Cui JQ, Lin ZL, Tian HL, et al. Long-term follow-up results of fecal microbiota transplantation for irritable bowel syndrome: a single-center, retrospective study[J]. Front Med (Lausanne), 2021, 8: 710452. |
| [32] |
Park SY, Seo GS. Fecal microbiota transplantation: is it safe?[J]. Clin Endosc, 2021, 54(2): 157-160. DOI:10.5946/ce.2021.072 |
| [33] |
Nicco C, Paule A, Konturek P, et al. From donor to patient: collection, preparation and cryopreservation of fecal samples for fecal microbiota transplantation[J]. Diseases, 2020, 8(2): 9. DOI:10.3390/diseases8020009 |
| [34] |
Woting A, Blaut M. The intestinal microbiota in metabolic disease[J]. Nutrients, 2016, 8(4): 202. DOI:10.3390/nu8040202 |
| [35] |
Tang GH, Yin W, Liu WE. Is frozen fecal microbiota transplantation as effective as fresh fecal microbiota transplantation in patients with recurrent or refractory Clostridium difficile infection: a Meta-analysis?[J]. Diagn Microbiol Infect Dis, 2017, 88(4): 322-329. DOI:10.1016/j.diagmicrobio.2017.05.007 |



