2. 贵州省人民医院呼吸与危重症医学科, 贵州 贵阳 550000;
3. 贵州省人民医院中心实验室, 贵州 贵阳 550000;
4. 四川省人民医院呼吸与危重症医学科, 四川 成都 610072;
5. 遵义医科大学附属医院呼吸与危重症医学科, 贵州 遵义 563006
2. Department of Respiratory & Critical Care Medicine, Guizhou Provincial People's Hospital, Guiyang 550000, China;
3. Department of Central Laboratory, Guizhou Provincial People's Hospital, Guiyang 550000, China;
4. Department of Respiratory & Cri-tical Care Medicine, Sichuan Provincial People's Hospital, Chengdu 610072, China;
5. Department of Respiratory & Critical Care Medicine, Affiliated Hospital of Zunyi Medical College, Zunyi 563006, China
耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales, CRE)的耐药性是医疗面临的紧迫问题之一,其菌株毒力强,感染患者病情重,治疗药物选择有限,目前全球已发表的研究中CRE感染已经达到近60%的病死率[1-3]。美国国家医疗保健安全网(National Healthcare Safety Network, NHSN)和医院感染监测系统(National No-socomial Infection Surveillance System, NNIS)监测数据显示,CRE在医疗保健相关感染中的比率已从2001年1.2%增加到2011年的4.2%,其中感染率的增加主要集中在克雷伯菌属(Klebsiella spp.),从1.6%增加至10.4%。中国已有研究关注耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP) 在国内的分子流行病学特征和分布[4-9]。2007年中国首次报道CRKP,至此之后几乎每个省都已发现CRE[4-5]。中国一项多中心研究收集了2014—2015年来自全国27个省市999株CRE,其中CRKP以70%位居首位,远高于大肠埃希菌(16%)和其他肠杆菌目细菌(13%)[5]。中国CRKP对碳青霉烯类的耐药率在2014年攀升至13.4%[6-7],已经成为导致临床严重感染和治疗失败的最重要耐药菌。因此,本研究以中国西南地区3所三级甲等医院收集的CRKP为研究对象,比较CRKP感染患者的临床特征、实验室检查和转归等信息,检测CRKP的流行病学特征及耐药性,为CRKP感染的预防与治疗提供实验室数据和临床信息。
1 资料与方法 1.1 菌株收集与鉴定收集2019年1—12月来自贵州省人民医院、四川省人民医院和遵义医科大学附属医院等3所三级甲等医院共159株对碳青霉烯类不敏感的KP菌株(排除来源于同一患者的菌株),按照全自动微生物分析系统(Phoenixtm-100,BD,美国)及CRKP菌株基因组DNA为模板扩增RNA聚合酶β亚单位基因(rpoB)进行细菌鉴定后[10],参照2019年美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)应用改良Hodge试验进行表型验证。159株KP均确定为CRKP并纳入本研究,ATCC 700603为质控菌株。
1.2 临床数据采集根据美国疾病控制与预防中心(CDC)和NHSN标准,收集CRKP感染患者的临床和流行病学资料,包括CRKP菌株标本来源(痰、血、腹腔积液、尿、伤口分泌物和其他类型标本)、患者基础资料(性别、年龄、基础疾病)、CRKP阳性培养30天前侵入性操作及留置导管情况(深静脉置管、气管插管/气管造瘘、导尿管、透析)、CRKP阳性培养30天前抗菌药物使用(抗菌药物单药治疗、联合治疗、使用第三/四代头孢菌素、使用碳青霉烯类抗生素)、实验室检查(外周血白细胞计数、C反应蛋白、降钙素原)和临床转归(痊愈、好转/转院、死亡)。该研究由贵州省人民医院研究伦理委员会审核批准(No.2015022)。
1.3 药敏试验采用微量肉汤稀释法检测美罗培南、亚胺培南、庆大霉素、阿米卡星、左氧氟沙星、头孢曲松、头孢他啶、头孢西丁、氨曲南、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦11种抗菌药物对CRKP的最低抑菌浓度(minimum inhibitory concentration,MIC)。
1.4 碳青霉烯酶基因检测利用聚合酶链反应(polymerase chain reaction, PCR),以CRKP细菌基因组DNA为模板,扩增CRKP菌株中碳青霉烯酶基因KPC、GES、IMP、VIM、NDM和OXA-48,引物见表 1[11-12]。扩增产物双向测序后与GenBank数据库进行比对,确定CRKP菌株携带的碳青霉烯酶基因。
| 表 1 扩增碳青霉烯酶基因的引物序列、退火温度及产物大小 Table 1 Primer sequence, annealing temperature, and pro-duct size for amplification of carbapenemase gene |

|
根据巴斯德研究所MLST网站(http://bigsdb.pasteur.fr/klebsiella/klebsiella.html),分别以159株CRKP菌株基因组DNA为模板,扩增7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)后进行MLST[13]。
1.6 统计学方法应用SPSS 21.0统计软件进行数据分析。计数资料采用例数和百分比表示,无序分类计数资料组间比较采用Fisher确切概率法,等级分类计数资料比较采用秩和检验。P≤0.05为差异有统计学意义。
2 结果 2.1 患者基础情况159例CRKP感染患者中男性占59.1%(94例),年龄[M(P25,P75):64(52~78)]岁,其中≥65岁患者占50.3%(80例),77.4%(123例)患有2种和/或2种以上基础疾病。见表 2。
| 表 2 159例CRKP感染患者基本特征 Table 2 Basic characteristics of 159 patients with CRKP infection |

|
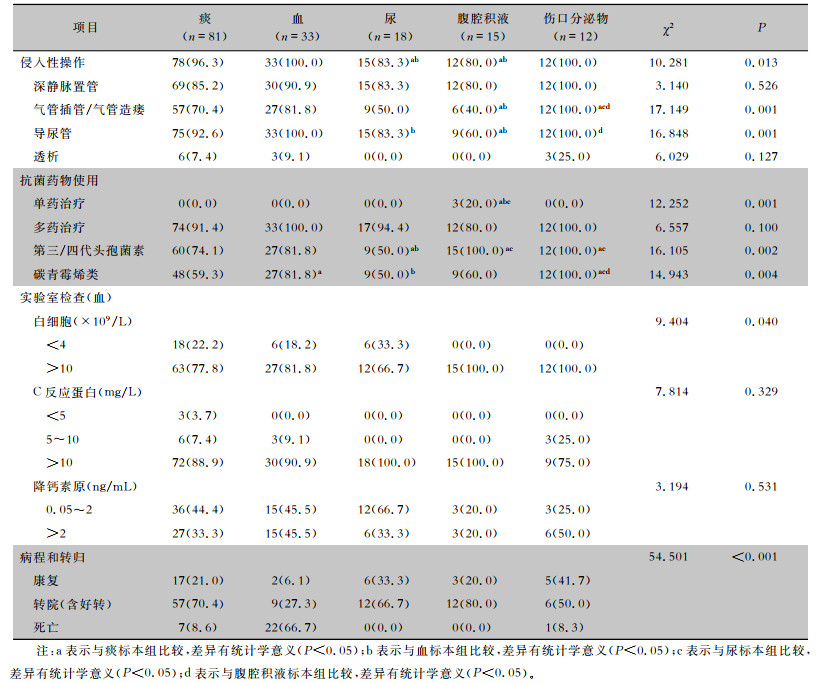
94.3%患者在获得CRKP培养阳性前都接受过侵入性操作,其中标本来源为痰和血的两组患者比率高于尿和腹腔积液组(均P < 0.05)。伤口分泌物组患者实施气管插管/气管造瘘的比率高于痰、尿、腹腔积液组(P < 0.05)。痰、血、伤口分泌物组患者使用导尿管的比率高于腹腔积液组(均P < 0.05)。抗菌药物使用方面,腹腔积液组的单药治疗比率高于其他各组(均P < 0.05);伤口分泌物组患者使用第三/四代头孢菌素的比率高于痰、尿来源患者(P < 0.05);血、伤口分泌物组患者使用碳青霉烯类高于其余各组(均P < 0.05)。各组患者的C反应蛋白和降钙素原比较,差异无统计学差异(P>0.05)。标本来源为血患者的转归最差,病死率较高,为66.7%。见表 3。
| 表 3 CRKP不同标本来源患者的临床特征、实验室检查及转归[例(%)] Table 3 Clinical characteristics, laboratory examination and outcome of patients of different CRKP specimen sources (No. of cases[%]) |
|
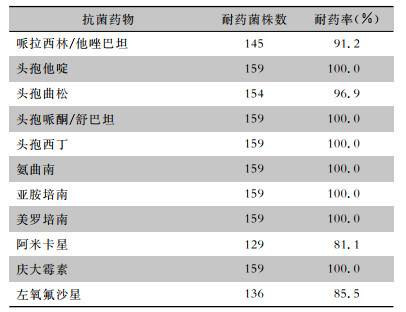
159株CRKP均为多重耐药菌(multidrug-resistant organism, MDRO),对头孢他啶、头孢西丁、头孢哌酮/舒巴坦、亚胺培南、美罗培南、氨曲南和庆大霉素的耐药率均为100%,对其他抗菌药物的耐药率为81.1%~96.9%。见表 4。
| 表 4 159株CRKP对11种抗菌药物的耐药情况 Table 4 Resistance of 159 strains of CRKP against 11 kinds of antimicrobial agents |
|
159株CRKP菌株均检测出碳青霉烯酶基因,其中129株(81.1%)只携带KPC-2,21株(13.2%)只携带NDM-1,9株(5.7%)同时携带KPC-2和NDM-1。9株同时携带KPC-2和NDM-1的菌株中,6株(66.7%)来自血培养。未检测出GES、IMP、VIM和OXA-48基因。见图 1。
 |
| A:KPC-2扩增产物电泳图;B:NDM-1扩增产物电泳图。 图 1 CRKP耐药基因扩增产物电泳图 Figure 1 Electrophoresis map of amplification products of CRKP resistance genes |
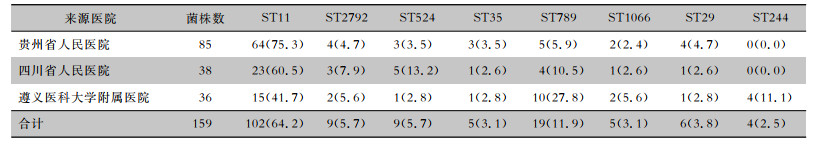
159株CRKP共检测出8种序列型,其中最流行的序列类型为ST11(64.2%)。不同来源医院的CRKP菌株MLST构成比较,差异有统计学差异(χ2=28.927,P=0.002),其中ST244分型的菌株全部来源于遵义医科大学附属医院。见表 5。
| 表 5 不同来源医院的CRKP菌株MLST构成情况[株(%)] Table 5 MLST of CRKP strains from different hospitals (No. of isolates[%]) |
|
本项目收集来自中国西南地区3所三级甲等医院临床标本分离的159株CRKP,检测CRKP菌株的耐药性、携带的耐药基因及MLST,结合患者临床特征、实验室检查和转归,分析中国西南地区流行的CRKP菌株分子流行病学特征,研究结果是对国内CRKP菌株多中心流行病学调查的有力补充。
该项目中CRKP感染的死亡患者主要来自血流感染(66.7%)。既往荟萃分析和系统回顾分析表明,CRKP感染病死率在北美、南美、欧洲和亚洲分别为33.24%、46.71%、50.06%、44.82%,其中血流感染病死率和入住ICU患者的病死率较高,分别为54.30%、48.9%[14]。首先,本项目大多数血流感染患者在CRKP培养阳性前接受了深静脉置管和气管插管/机械通气等侵入性操作。国内一项报道收集了来自上海地区的100株CRKP,发现有创机械通气会导致更高的CRKP感染率[15]。其次本研究中全部血流感染患者在培养出CRKP前接受了多种抗菌药物治疗,81.8%的患者接触了第三/四代头孢菌素或碳青霉烯类抗生素。住院治疗和累积抗菌药物使用史,尤其是既往使用β-内酰胺类和碳青霉烯类抗生素被认为是与CRE感染相关的独立危险因素[16-17]。尽管从伤口分泌物分离出CRKP的患者实施气管插管/气管造瘘、使用第三/四代头孢菌素/碳青霉酶烯类和外周血白细胞升高的比率较高,但这部分患者大多数为外伤和外科手术后患者,在外科主要疾病得到控制后,并没有导致较差的预后。本研究中未观察到尿路感染患者的死亡,尽管我国另外14个省三级甲等医院的数据发现CRKP尿路感染的病死率高达30.3%[9],但是从全球流行病学数据来看,常常与高病死率风险相关的是CRKP导致的血流感染,尿路感染未显示出过高的病死率[18]。
本研究提示产碳青霉烯酶是中国西南地区CRKP耐药的重要原因,KPC-2是该地区最流行的耐药基因。CRKP携带的碳青霉烯酶基因具有地域差异,如我国陕西省分离的76株CRE携带率最高的基因是NDM(97%)[5],国内另两项研究也分别发现在湖南和重庆地区流行的CRKP也是以携带NDM为主[9, 19]。除了产碳青霉烯酶以外,超广谱β-内酰胺酶(ESBLs)和/或AmpC头孢菌素酶(AmpC)同时兼具膜通透性的改变也会使肺炎克雷伯菌对碳青霉烯类抗生素耐药[20]。但产碳青霉烯酶的肺炎克雷伯菌与非产碳青霉烯酶的菌株相比具有更高的毒力,对美罗培南的MIC更高,14天病死率也有显著上升[21],是CRKP最主要的耐药机制。目前认为在中国出现新的CRKP菌株主要途径是现有耐药菌株的克隆传播和特定动力元件的传递,提示未来控制CRKP的策略应该集中于抑制关键耐药菌株中碳青霉烯酶编码基因的传递[9]。
本研究中所有CRKP均为MDRO,对庆大霉素和阿米卡星的耐药率分别达到100%、81.1%,对左氧氟沙星耐药率为85.5%,高于国外和国内其他省份报道的耐药率[22-23]。本研究中大多数菌株(86.8%) 携带KPC-2基因,国内一项新生儿CRKP医院感染暴发回顾性研究[24]发现,产KPC-2的CRKP菌株对部分抗菌药物的MIC值比产NDM-1的菌株更高。另外,本项目中一半以上的患者在65岁以上,且来自ICU,病情重,既往也有多次使用抗菌药物的病史。目前对CRKP的治疗仍然非常棘手,体外药敏试验并不能完全反映CRKP在体内对药物的治疗反应。即使对阿米卡星和多粘菌素敏感的CRKP感染患者,肾毒性仍然是临床医生需要重视的问题[25]。对于CRKP血流感染的患者,接受以高剂量碳青霉烯类抗生素为基础的联合治疗,似乎能带来更好的临床收益[26]。也有报道新型抗菌药物如头孢他啶/阿维巴坦的使用可能会与更好的临床预后和生存率有关[23]。
本研究所收集的CRKP菌株在遗传上相对保守,大多数属于ST11型(64.2%),与国内CRKP的主流克隆型一致[9],但是3所医院的序列分型构成比仍然有差异。ST244分型的菌株没有在位于贵阳的2所医院检出,全部来源于遵义医科大学附属医院。欧美国家主要流行的CRKP是ST258型,与国内流行的ST11同属于克隆复合体258 (clonal complex,CC),主要与KPC型和NDM型碳青霉烯酶流行相关[27-28]。本课题组在既往研究中比较了37株ST11型及非ST11型CRKP菌株在患者年龄、性别、感染途径、抗菌药物使用情况等,虽然未发现有统计学差异[29],但是CRKP分离菌株的分子生物学分型对CRKP传染现状监测、传染源追踪、传播途径调查和暴发识别仍具有重要意义。
本研究的不足之处是住院患者CRKP感染率的信息缺失。但是可以明确的是,中国西南地区流行的CRKP菌株耐药性强,尤其血流感染患者预后差,病死率高,迫切需要加强感染控制措施和提高预防意识,这将对中国西南地区临床控制CRKP的传播和感染具有重要意义。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis, 2011, 17(10): 1791-1798. DOI:10.3201/eid1710.110655 |
| [2] |
Amit S, Mishali H, Kotlovsky T, et al. Bloodstream infections among carriers of carbapenem-resistant Klebsiella pneumoniae: etiology, incidence and predictors[J]. Clin Microbiol Infect, 2015, 21(1): 30-34. DOI:10.1016/j.cmi.2014.08.001 |
| [3] |
Balkan II, Aygün G, Aydın S, et al. Blood stream infections due to OXA-48-like carbapenemase-producing Enterobacteria-ceae: treatment and survival[J]. Int J Infect Dis, 2014, 26: 51-56. DOI:10.1016/j.ijid.2014.05.012 |
| [4] |
Wei ZQ, Du XX, Yu YS, et al. Plasmid-mediated KPC-2 in a Klebsiella pneumoniae isolate from China[J]. Antimicrob Agents Chemother, 2007, 51(2): 763-765. DOI:10.1128/AAC.01053-06 |
| [5] |
Zhang R, Chan EWC, Zhou HW, et al. Prevalence and gene-tic characteristics of carbapenem-resistant Enterobacteriaceae strains in China[J]. Lancet Infect Dis, 2017, 17(3): 256-257. DOI:10.1016/S1473-3099(17)30072-5 |
| [6] |
Xiao YH, Wang J, Li Y, et al. Bacterial resistance surveillance in China: a report from Mohnarin 2004-2005[J]. Eur J Clin Microbiol Infect Dis, 2008, 27(8): 697-708. DOI:10.1007/s10096-008-0494-6 |
| [7] |
Hu FP, Guo Y, Zhu DM, et al. Resistance trends among clini- cal isolates in China reported from CHINET surveillance of bacterial resistance, 2005-2014[J]. Clin Microbiol Infect, 2016, 22(Suppl 1): S9-S14. |
| [8] |
Xu A, Zheng B, Xu YC, et al. National epidemiology of carbapenem-resistant and extensively drug-resistant Gram-negative bacteria isolated from blood samples in China in 2013[J]. Clin Microbiol Infect, 2016, 22(Suppl 1): S1-S8. |
| [9] |
Zhang YW, Wang Q, Yin YY, et al. Epidemiology of carbape- nem-resistant Enterobacteriaceae infections: report from the China CRE Network[J]. Antimicrob Agents Chemother, 2018, 62(2): e01882-17. |
| [10] |
Diancourt L, Passet V, Verhoef J, et al. Multilocus sequence typing of Klebsiella pneumoniae nosocomial isolates[J]. J Clin Microbiol, 2005, 43(8): 4178-4182. DOI:10.1128/JCM.43.8.4178-4182.2005 |
| [11] |
Arabacı Ç, Dal T, Başyi it T, et al. Investigation of carbapene- mase and mcr-1 genes in carbapenem-resistant Klebsiella pneumoniae isolates[J]. J Infect Dev Ctries, 2019, 13(6): 504-509. DOI:10.3855/jidc.11048 |
| [12] |
El-Badawy MF, El-Far SW, Althobaiti SS, et al. The first Egyptian report showing the co-existence of blaNDM-25, blaOXA-23, blaOXA-181, and blaGES-1 among carbapenem-resistant K. pneumoniae clinical isolates genotyped by BOX-PCR[J]. Infect Drug Resist, 2020, 13: 1237-1250. DOI:10.2147/IDR.S244064 |
| [13] |
An SC, Chen JC, Wang ZW, et al. Predominant characteristics of CTX-M-producing Klebsiella pneumoniae isolates from patients with lower respiratory tract infection in multiple medical centers in China[J]. FEMS Microbiol Lett, 2012, 332(2): 137-145. DOI:10.1111/j.1574-6968.2012.02586.x |
| [14] |
Xu LF, Sun AA, Ma XL. Systematic review and Meta-analysis of mortality of patients infected with carbapenem-resistant Klebsiella pneumoniae[J]. Ann Clin Microbiol Antimicrob, 2017, 16(1): 18. DOI:10.1186/s12941-017-0191-3 |
| [15] |
Zheng B, Dai YX, Liu Y, et al. Molecular epidemiology and risk factors of carbapenem-resistant Klebsiella pneumoniae infections in eastern China[J]. Front Microbiol, 2017, 8: 1061. DOI:10.3389/fmicb.2017.01061 |
| [16] |
Patel N, Harrington S, Dihmess A, et al. Clinical epidemiology of carbapenem-intermediate or -resistant Enterobacteriaceae[J]. J Antimicrob Chemother, 2011, 66(7): 1600-1608. DOI:10.1093/jac/dkr156 |
| [17] |
Wang Q, Zhang Y, Yao X, et al. Risk factors and clinical outcomes for carbapenem-resistant Enterobacteriaceae nosocomial infections[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(10): 1679-1689. DOI:10.1007/s10096-016-2710-0 |
| [18] |
Hauck C, Cober E, Richter SS, et al. Spectrum of excess mortality due to carbapenem-resistant Klebsiella pneumoniae infections[J]. Clin Microbiol Infect, 2016, 22(6): 513-519. DOI:10.1016/j.cmi.2016.01.023 |
| [19] |
Yan JR, Pu SL, Jia XJ, et al. Multidrug resistance mechanisms of carbapenem resistant Klebsiella pneumoniae strains isolated in Chongqing, China[J]. Ann Lab Med, 2017, 37(5): 398-407. DOI:10.3343/alm.2017.37.5.398 |
| [20] |
Goodman KE, Simner PJ, Tamma PD, et al. Infection control implications of heterogeneous resistance mechanisms in carba-penem-resistant Enterobacteriaceae (CRE)[J]. Expert Rev Anti Infect Ther, 2016, 14(1): 95-108. DOI:10.1586/14787210.2016.1106940 |
| [21] |
Tamma PD, Goodman KE, Harris AD, et al. Comparing the outcomes of patients with carbapenemase-producing and non-carbapenemase-producing carbapenem-resistant Enterobacteriaceae bacteremia[J]. Clin Infect Dis, 2017, 64(3): 257-264. DOI:10.1093/cid/ciw741 |
| [22] |
Han JH, Goldstein EJC, Wise J, et al. Epidemiology of carbapenem-resistant Klebsiella pneumoniae in a network of long-term acute care hospitals[J]. Clin Infect Dis, 2017, 64(7): 839-844. |
| [23] |
Dong F, Zhang Y, Yao KH, et al. Epidemiology of carbape-nem-resistant Klebsiella pneumoniae bloodstream infections in a Chinese children's hospital: predominance of New Delhi metallo-β-lactamase-1[J]. Microb Drug Resist, 2018, 24(2): 154-160. DOI:10.1089/mdr.2017.0031 |
| [24] |
Yu J, Tan K, Rong ZH, et al. Nosocomial outbreak of KPC-2- and NDM-1-producing Klebsiella pneumoniae in a neonatal ward: a retrospective study[J]. BMC Infect Dis, 2016, 16(1): 563. DOI:10.1186/s12879-016-1870-y |
| [25] |
Shields RK, Nguyen MH, Chen L, et al. Ceftazidime-avibactam is superior to other treatment regimens against carbape-nem-resistant Klebsiella pneumoniae bacteremia[J]. Antimicrob Agents Chemother, 2017, 61(8): e00883-17. |
| [26] |
Giannella M, Trecarichi EM, Giacobbe DR, et al. Effect of combination therapy containing a high-dose carbapenem on mortality in patients with carbapenem-resistant Klebsiella pneumoniae bloodstream infection[J]. Int J Antimicrob Agents, 2018, 51(2): 244-248. DOI:10.1016/j.ijantimicag.2017.08.019 |
| [27] |
Oteo J, Saez D, Bautista V, et al. Carbapenemase-producing Enterobacteriaceae in Spain in 2012[J]. Antimicrob Agents Chemother, 2013, 57(12): 6344-6347. DOI:10.1128/AAC.01513-13 |
| [28] |
Williamson DA, Sidjabat HE, Freeman JT, et al. Identification and molecular characterisation of New Delhi metallo-β-lactamase-1 (NDM-1)- and NDM-6-producing Enterobacteriaceae from New Zealand hospitals[J]. Int J Antimicrob Agents, 2012, 39(6): 529-533. DOI:10.1016/j.ijantimicag.2012.02.017 |
| [29] |
杨雪, 刘琳, 赵丹, 等. 耐碳青霉烯类肺炎克雷伯菌耐药基因检测与分子流行病学研究[J]. 重庆医学, 2018, 47(15): 1977-1980, 1985. Yang X, Liu L, Zhao D, et al. Detection of drug resistance gene of carbapenem-resistant Klebsiella pneumoniae and molecular epidemiological study[J]. Chongqing Medicine, 2018, 47(15): 1977-1980, 1985. DOI:10.3969/j.issn.1671-8348.2018.15.001 |



