尽管近年来重症医学发展迅速,但重症监护病房(ICU)患者的医院获得性感染发病率仍高于非ICU病房患者[1],可能与患者疾病严重程度、基础疾病、接受侵入性操作、频繁与医护人员密切接触及过多的抗菌药物使用有关。多重耐药菌(MDRO)感染的早期判别可以指导临床医生进行适当经验治疗的同时避免耐药菌株传播。迄今为止,在许多感染控制相关指南中都建议使用“筛查、隔离和根除”的措施,目的是及早发现MDRO,有效防止其传播,从而减轻细菌感染负担,但仍然缺乏支持这种感染控制策略的有效证据[2]。部分研究[3-4]认为,主动筛查投入的人力、物力及经济成本过高,其成本-效益比受到质疑。部分研究[5-7]认为积极筛查和隔离对MDRO感染的预防和控制有重要价值,有助于早期识别患者MDRO感染和定植情况,以便尽早地采用消毒隔离措施减少医院感染,更加合理使用抗菌药物,从而降低MDRO传播的风险。本研究主要通过对入住三峡大学第一临床医学院急诊科ICU的患者采用主动筛查结合预先隔离的干预模式,即主动进行微生物培养、预防性隔离,并对抗菌药物使用、环境物品消毒等感染防控重点环节进行管控,分析主动筛查在ICU MDRO感染的防控与治疗中的作用。
1 对象与方法 1.1 研究对象选取2017年1月1日—2020年12月31日所有入住宜昌市中心人民医院急诊ICU的患者,2017—2018年未进行主动筛查的患者为对照组,2019—2020年进行主动筛查的患者为干预组。排除标准:入住急诊ICU时已经明确有MDRO感染的患者;治疗不足24 h自动出院者或死亡者;未能坚持系统治疗致资料不全者。
1.2 研究方法干预组采用主动筛查,并对入科患者进行预先隔离措施直至筛查结果阴性。患者入科后均采用鼻咽拭子进行耐甲氧西林金黄色葡萄球菌(MRSA)筛查,直肠拭子KPC筛查,或其他存在活动性感染或定植的部位如伤口、引流部位、粪便及留置导管部位等进行MDRO主动筛查。在等待筛查结果期间,所有进入病房或隔离区的人员均执行接触隔离。对照组不进行主动筛查,在入科时按标准预防进行诊疗,根据临床病原学结果,在确认MDRO感染后,进行接触隔离。医护人员在进行诊疗的过程中确保合理使用抗菌药物,加强与患者及探视人员的沟通,同时医院也应加强对微生物实验室能力的建设。
1.3 调查内容收集患者基本信息和临床资料,如性别、年龄、主要诊断、急性生理与慢性健康评分(APACHE-Ⅱ评分)、危险因素、病种、细菌学标本送检情况及结果、抗菌药物使用情况、住院日数、不良事件发生情况。
1.4 统计学方法应用统计软件SPSS 25.0进行数据分析。计量资料以均数±标准差(x±s)表示,采用t检验进行比较;计数资料以率(百分比)表示,采用χ2检验进行比较;P≤0.05为差异有统计学意义。
2 结果 2.1 两组患者感染情况对照组(2017—2018年)共有1 834例患者,医院感染发病率7.91%,社区感染发病率1.58%;干预组(2019—2020年)共有1 636例患者,医院感染发病率5.26%,社区感染发病率2.32%;两组患者医院感染发病率比较,差异有统计学意义(P=0.002);社区感染发病率比较,差异无统计学意义(P>0.05)。两组患者感染情况见表 1。
| 表 1 干预组与对照组患者感染情况 Table 1 Infection of patients in intervention group and control group |
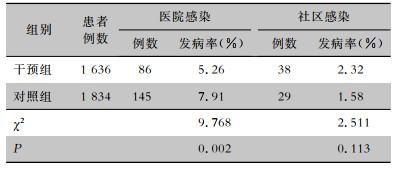
|
1 834例对照组中MDRO感染患者58例,MDRO感染率为3.16%;1 636例干预组中MDRO感染患者33例,MDRO感染率为2.02%;两组比较,差异有统计学意义(χ2= 4.442,P=0.035)。对照组患者平均年龄(63.95±18.82)岁,APACHE-Ⅱ评分(22.76±3.35)分;干预组患者中平均年龄(61.52±12.65)岁,APACHE-Ⅱ评分(23.45±3.19)分。两组患者的年龄、APACHE-Ⅱ评分及其他基本资料比较,差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 两组患者中MDRO感染患者基本资料比较 Table 2 Comparison of basic data of patients with MDRO infection between two groups of patients |
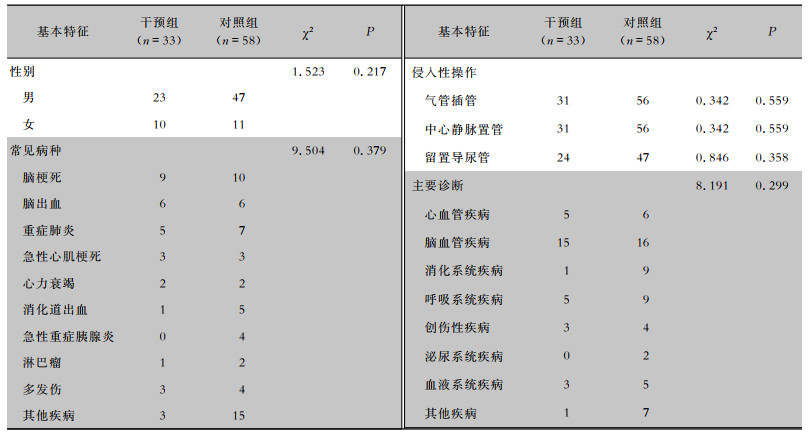
|
干预组耐碳青霉烯类鲍曼不动杆菌(CRAB)、多重耐药/泛耐药铜绿假单胞菌(MDR/PDR-PA)、产超广谱β-内酰胺酶(ESBLs)细菌的例次感染率均低于对照组,差异有统计学意义(均P<0.05)。两组患者MRSA、耐碳青霉烯类肠杆菌目细菌(CRE)、其他类别MDRO的例次感染率比较,差异均无统计学意义(均P>0.05)。见表 3。
| 表 3 两组患者不同种类MDRO感染情况[例次(%)] Table 3 Different types of MDRO infection in two groups of patients (No. of cases[%]) |
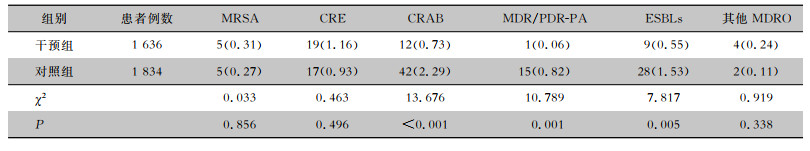
|
对照组发生MDRO呼吸道感染52例次,感染率为2.84%;干预组发生MDRO呼吸道感染29例次,感染率为1.77%;两组比较,差异有统计学意义(P=0.038)。两组患者血流、泌尿道及其他部位MDRO感染率比较,差异均无统计学意义(均P>0.05)。见表 4。
| 表 4 两组患者不同部位MDRO感染情况[例次(%)] Table 4 MDRO infection at different sites of two groups of patients (No. of cases[%]) |
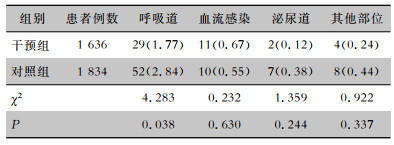
|
干预组的平均总住院日数及ICU住院日数均低于对照组,差异均有统计学意义(均P<0.05)。见表 5。
| 表 5 两组患者住院日数、ICU住院日数比较(x±s,d) Table 5 Comparison of hospitalization days and ICU hospitalization days between two groups of patients (x±s, d) |
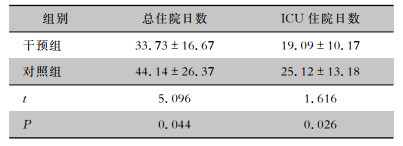
|
对照组MDRO感染患者医疗不良事件发生率为25.86%,干预组为6.06%,两组比较差异有统计学意义(P=0.006)。对照组MDRO感染患者因护理导致不良事件发生率为20.69%,干预组为3.03%,两组比较差异有统计学意义(P=0.021)。见表 6。
| 表 6 两组MDRO感染患者医疗不良事件发生情况[例(%)] Table 6 Comparison of occurrence of adverse medical events between two groups of patients (No. of cases[%]) |
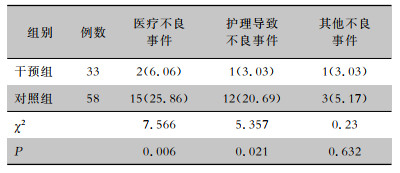
|
主动筛查阳性率与细菌学培养阳性率比较,差异无统计学意义(χ2=3.814,P=0.067)。主动筛查灵敏度为87.13%,特异度为97.29%。见表 7。表明主动筛查检测的MDRO结果与细菌学培养大致相同,有良好的特异性和敏感性。
| 表 7 主动筛查的敏感度和特异度 Table 7 Sensitivity and specificity of active screening |
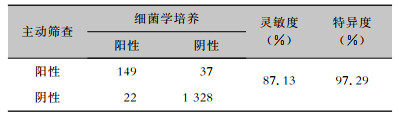
|
根据中国细菌耐药监测网2014—2019年的报告[8]显示,我国6年间总体细菌构成和比例基本保持稳定,革兰阴性菌所占比率较革兰阳性菌所占比率高1倍以上,分别占70.3%~71.5%、28.5%~29.7%;革兰阴性菌中居前5位的细菌分别为大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和阴沟肠杆菌,其中MRSA的检出率为30.2%,耐碳青霉烯类的鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌、大肠埃希菌的检出率分别为56.0%~60.0%、19.1%、10.9%、1.4% ~1.9%;对第三代头孢菌素耐药的大肠埃希菌、肺炎克雷伯菌的检出率分别为51.9%、31.9%。本研究通过实行MDRO主动筛查对急诊ICU的医院感染进行防控,可为ICU MDRO感染的防控和治疗提供一定的理论基础和实践经验。
医院环境是一个复杂的生态系统,需要采取多种干预措施才能实现最佳的感染控制,MDRO传播的控制策略应包括尽早确定并遏制MDRO的传播,这是MDRO感染控制措施的基础[9]。研究[10]指出,ICU超过一半的MDRO感染由外院转入或从社区获得,应加强对MDRO来源的识别,采取更为有效、精准、及时且具有针对性的感染防控措施。本研究显示,主动筛查可以降低ICU患者的医院感染发病率,这与大多数研究结果一致。国内研究[6]也提出MDRO主动筛查在ICU医院感染预防控制中有重要价值。另外,采取主动筛查,对患者进行早期病原学送检,可帮助识别ICU患者社区感染和定植情况,尤其对于重症感染者,对全身情况差、免疫力低下的患者,可根据细菌学及药敏试验结果进行早期预防或治疗。
我国卫生部在1986年建立了第一个全国性的医院感染监测网络,在2011年发布了预防和控制MDRO的技术指南,要求采取隔离、消毒、合理使用抗菌药物及对MDRO监测的措施。中国感染控制取得了重大进展,几乎所有医院都建立了感染控制团队[11],但部分MDRO的发病率仍上升,如CRAB,鲍曼不动杆菌属细菌作为条件性致病菌,主要与医疗保健相关的感染有关,包括呼吸机相关肺炎、中心静脉导管相关血流感染,尿路感染和伤口感染[1]。由于ICU患者的特殊性,使ICU的细菌分布与整体的细菌分布不同。2010年卫生部全国细菌耐药监测网对ICU来源细菌耐药监测的报告[12]提示,我国ICU患者分离的细菌以革兰阴性菌为主,前5位分别是鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌和大肠埃希菌。最常见的标本来源是呼吸道,其次是血、尿等[13]。本研究分离的MDRO主要有CRAB、CRE、ESBLs、MDR/PDR-PA、MRSA等,与上述菌种基本一致。本研究分离的MDRO主要标本来源也与全国数据相符,主要来自呼吸道、血、泌尿道、手术部位等。本研究显示,主动筛查可以降低ICU患者MDRO感染率,降低CRAB、MDR/PDR-PA、ESBLs感染率,降低呼吸道MDRO感染率。其原因可能为实施主动筛查可帮助判断MDRO感染、定植或污染,从而实施最佳的预防控制措施。
ICU病房的患者往往合并基础疾病多、免疫功能低下、住院时间长,且预后不佳。抗菌药物耐药性削弱了患者对抗病原体的能力[13],使死亡风险增高,延长患者的住院时间,当一线药物受到耐药性的限制或治疗效果不佳时,往往需要使用更高级的抗菌药物,治疗的经济成本和治疗时间也会增加,从而增加感染患者的住院费用和住院日数。有研究[14]证明MDRO感染患者再次入院的可能性几乎高出普通感染患者的3倍,尤其是MRSA或ESBLs感染患者,MDRO感染可能会导致更高的医院感染复发率。国内研究[15]采取主动筛查联合包括隔离、手卫生、环境清洁、抗菌药物管理在内的集束化防控措施管控ICU MDRO感染,针对危险因素进行早期监测评估,以明确感染的病原微生物类型和感染灶,合理规范的使用抗菌药物,研究结果提示这种方法对于改善患者的预后、减少患者的平均住院日均能获益。本研究表明主动筛查可减少MDRO感染患者的总住院日数和ICU住院日数。
医疗不良事件的出现可能会降低医疗安全和质量,引起医患纠纷,造成医疗资源的浪费,对患者、家属、医护人员及医疗机构都会产生不同程度的影响,因而医疗安全不良事件的管理受到全国医疗机构的重视。按照不良事件的危险程度将其分为Ⅳ级,其中最严重的为Ⅰ级事件,是指发生错误造成患者死亡。以Ⅲ级不良事件为主,可达到50%以上。研究[16-17]表明,近50%的医疗不良事件是可以避免的。2015—2017年全国数据表明,造成医疗不良事件一半以上的原因是基础护理、信息传递与接收、药品调剂与分发和导管操作[18]。ICU患者多为危重症患者,常常合并意识障碍、呼吸衰竭、血流动力学不稳定等危险因素,需使用大量的仪器及设备,留置多根管道,护理不当易导致患者病情恶化甚至可导致死亡。本研究所采取的干预措施,加大了医护人员的工作量和精神压力,可能会导致不良事件的发生,但由于患者处于隔离状态,医护人员在对其诊疗及护理过程中的管理更加规范,不断地强化整改措施带来益处可能会超过负面影响。本研究结果表明,主动筛查组患者的医疗不良事件发生率低于对照组,以降低护理所导致的不良事件发生率为主。
MDRO感染诊断的确立依赖于临床表现结合实验室培养结果,治疗前应留取病原学标本进行检测和培养,并进行细菌药敏试验[19],因此提高筛查的阳性率尤为重要。尽管在许多感染控制指南中,建议使用MDRO筛查来确定MDRO携带者,但主动筛查的敏感性和特异性仍受到部分医疗卫生机构及研究人员的质疑,如患者的年龄、住院时间[20]、筛查频率、使用的拭子材料、仪器设备和实验室技术的差别等都可能影响筛查的阳性率,导致筛查难以标准化。本研究表明,对MDRO进行主动筛查,其敏感度和特异度均较高,对临床耐药菌的监测起良好作用。
综上所述,本研究结果表明,主动筛查可早期识别MDRO携带者,尽早了解MDRO感染和定植情况,可降低ICU医院感染率和MDRO感染率,尤其是减少呼吸道MDRO感染率。实施主动筛查可减少MDRO感染患者的总住院日数和ICU住院日数,以及减少医疗不良事件的发生。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
MacVane SH. Antimicrobial resistance in the intensive care unit: a focus on Gram-negative bacterial infections[J]. J Intensive Care Med, 2017, 32(1): 25-37. DOI:10.1177/0885066615619895 |
| [2] |
Lemmen SW, Lewalter K. Antibiotic stewardship and horizontal infection control are more effective than screening, isolation and eradication[J]. Infection, 2018, 46(5): 581-590. DOI:10.1007/s15010-018-1137-1 |
| [3] |
Strich JR, Palmore TN. Preventing transmission of multidrug-resistant pathogens in the intensive care unit[J]. Infect Dis Clin North Am, 2017, 31(3): 535-550. DOI:10.1016/j.idc.2017.05.010 |
| [4] |
Robotham JV, Deeny SR, Fuller C, et al. Cost-effectiveness of national mandatory screening of all admissions to English National Health Service hospitals for methicillin-resistant Staphylococcus aureus: a mathematical modelling study[J]. Lancet Infect Dis, 2016, 16(3): 348-356. DOI:10.1016/S1473-3099(15)00417-X |
| [5] |
顾克菊, 沈永红. 实施主动筛查防控重症监护病房多重耐药菌传播流行[J]. 中国感染控制杂志, 2016, 15(6): 401-404. Gu KJ, Shen YH. Implementation of active screening for preventing and controlling the spread of multidrug-resistant organisms in intensive care unit[J]. Chinese Journal of Infection Control, 2016, 15(6): 401-404. DOI:10.3969/j.issn.1671-9638.2016.06.009 |
| [6] |
曾秀玉, 张华平, 陈夏容, 等. 多药耐药菌主动筛查在ICU医院感染预防控制中的价值[J]. 中华医院感染学杂志, 2016, 26(10): 2373-2375. Zeng XY, Zhang HP, Chen XR, et al. Value of active scree-ning of multidrug-resistant organisms in control of nosocomial infections in ICU[J]. Chinese Journal of Nosocomiology, 2016, 26(10): 2373-2375. |
| [7] |
祝丽君, 陈上仲, 林晨. 隔离干预对控制重症监护病房多重耐药菌定植的研究[J]. 中国消毒学杂志, 2020, 37(10): 744-747. Zhu LJ, Chen SZ, Lin C. Study on isolation intervention to control multi-drug resistance colonization in ICU[J]. Chinese Journal of Disinfection, 2020, 37(10): 744-747. |
| [8] |
全国细菌耐药监测网. 全国细菌耐药监测网2014-2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1): 15-30. China Antimicrobial Resistance Surveillance System. Antimicrobial resistance of bacteria: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(1): 15-30. |
| [9] |
Backman C, Taylor G, Sales A, et al. An integrative review of infection prevention and control programs for multidrug-resistant organisms in acute care hospitals: a socio-ecological perspective[J]. Am J Infect Control, 2011, 39(5): 368-378. DOI:10.1016/j.ajic.2010.07.017 |
| [10] |
李占结, 刘波, 李惠芬, 等. ICU多重耐药菌感染分布与来源研究[J]. 中华医院感染学杂志, 2019, 29(8): 1165-1170. Li ZJ, Liu B, Li HF, et al. Study on distribution and source of multi-drug resistant bacteria infection in ICUs[J]. Chinese Journal of Nosocomiology, 2019, 29(8): 1165-1170. |
| [11] |
Zong ZY, Wu AH, Hu BJ. Infection control in the era of antimicrobial resistance in China: progress, challenges, and opportunities[J]. Clin Infect Dis, 2020, 71(Suppl 4): S372-S378. |
| [12] |
朱任媛, 张小江, 杨启文, 等. 卫生部全国细菌耐药监测网2011年ICU来源细菌耐药监测[J]. 中国临床药理学杂志, 2012, 28(12): 905-909. Zhu RY, Zhang XJ, Yang QW, et al. Ministry of Health National Antimicrobial Resistance Investigation Net annual report of 2011:surveillance of antimicrobial resistance in bacteria from intensive care units[J]. The Chinese Journal of Clinical Pharmacology, 2012, 28(12): 905-909. DOI:10.3969/j.issn.1001-6821.2012.12.005 |
| [13] |
Barrasa-Villar JI, Aibar-Remón C, Prieto-Andrés P, et al. Impact on morbidity, mortality, and length of stay of hospital-acquired infections by resistant microorganisms[J]. Clin Infect Dis, 2017, 65(4): 644-652. DOI:10.1093/cid/cix411 |
| [14] |
张映喜, 杨宝军, 孟冬梅. 耐药菌筛查联合组合式降阶梯集束化防控降低ICU感染的疗效分析[J]. 四川医学, 2018, 39(2): 172-176. Zhang YX, Yang BJ, Meng DM. Analysis of the therapeutic effect of drug resistant bacteria screening combined with combined descending ladder cluster control to reduce ICU infection[J]. Sichuan Medical Journal, 2018, 39(2): 172-176. |
| [15] |
Mutters NT, Günther F, Frank U, et al. Costs and possible benefits of a two-tier infection control management strategy consisting of active screening for multidrug-resistant organi-sms and tailored control measures[J]. J Hosp Infect, 2016, 93(2): 191-196. DOI:10.1016/j.jhin.2016.02.013 |
| [16] |
Halfon P, Staines A, Burnand B. Adverse events related to hospital care: a retrospective medical records review in a Swiss hospital[J]. Int J Qual Health Care, 2017, 29(4): 527-533. |
| [17] |
Sanchez JA, Lobdell KW, Moffatt-Bruce SD, et al. Investigating the causes of adverse events[J]. Ann Thorac Surg, 2017, 103(6): 1693-1699. DOI:10.1016/j.athoracsur.2017.04.001 |
| [18] |
张艳丽, 麻国强, 赵骥, 等. 我国医疗安全(不良)事件大数据分析及策略研究[J]. 中国医院管理, 2020, 40(8): 29-32. Zhang YL, Ma GQ, Zhao J, et al. Analysis of big data and strategy research on medical safety (adverse)events in China[J]. Chinese Hospital Management, 2020, 40(8): 29-32. |
| [19] |
倪明, 田德英. 细菌耐药——挑战与对策[J]. 医药导报, 2016, 35(3): 219-223. Ni M, Tian DY. Bacterial resistance-challenges and strategies[J]. Herald of Medicine, 2016, 35(3): 219-223. |
| [20] |
温剑艺, 覃铁和, 王首红, 等. ICU老年患者多重耐药菌主动筛查情况及危险因素分析[J]. 中国药房, 2018, 29(2): 199-203. Wen JY, Qin TH, Wang SH, et al. Analysis of active scree- ning and risk factors for multidrug-resistant organisms in elderly patients of ICU[J]. China Pharmacy, 2018, 29(2): 199-203. |



