噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH),又称噬血细胞综合征,是由于多种致病因素导致机体免疫调节紊乱,巨噬细胞和T细胞过度增殖、活化和高细胞因子血症,引起全身炎症反应和多脏器功能损伤的一组综合征。临床上可分为原发性HLH和继发性HLH:原发性包括家族性(familial hemophagocytic lymphohistiocytosis,FHL)和遗传性免疫缺陷相关性HLH;继发性HLH可继发于感染、风湿免疫性疾病、肿瘤等。该病好发于婴儿和儿童,起病急、进展迅速、预后差。随着治疗方案的不断改善,患者的预后及生存时间得以延长,但同时也出现了治疗相关的不良反应,尤其是依托泊苷(VP16)暴露引起的继发白血病受到了关注。本文第一次报道表皮短杆菌感染相关HLH治疗后继发急性早幼粒细胞白血病(acute promyelocytic leukemia, APL),现详细报告如下。
1 病历资料 1.1 病史患儿,男性,5岁,因“发热、关节痛15 d”于2020年3月25日入院,入院体格检查:神清,精神可,颌下可触及1蚕豆大小淋巴结。咽部稍充血,扁桃体不大,双肺呼吸音粗,未闻及干湿性啰音,心律齐,心音有力,无杂音,腹平软,肝肋下1 cm,脾肋下未触及,各关节无红肿、压痛,4字征阴性,神经系统查体无特殊。
1.2 诊疗经过辅助检查:血常规白细胞24.47×109/L,中性粒细胞20.15×109/L,血红蛋白105 g/L,血小板511×109/L;C-反应蛋白130.83 mg/L,血沉119 mm/h,铁蛋白2 774.67 ng/mL,G试验255.2 pg/mL;肝肾功能、血脂、心肌酶、凝血功能、降钙素原、抗链“O”、GM试验、EBV-DNA、血培养及骨髓培养、免疫球蛋白+补体、狼疮全套+血管炎、抗CCP抗体、HLA-B27未见异常。病原微生物高通量基因检测:革兰阳性(G+)表皮短杆菌。心脏彩超:二尖瓣上不规则回声结节,考虑感染性心内膜炎可能性大;肺部CT平扫:左上肺及双下肺感染,心脏稍大,心包少许积液;腹部B超、双膝关节MRI平扫+增强未见异常。骨髓细胞学:骨髓增生活跃。诊断考虑:(1)急性支气管肺炎;(2)感染性心内膜炎(表皮短杆菌),先后予美罗培南、万古霉素、氟康唑、卡泊芬净抗感染,免疫球蛋白调节免疫治疗。后患儿无明显关节痛,仍有反复发热,最高40.5℃,约2~4次/天,布洛芬可退至正常。
入院第14天起患儿反复出现鼻衄、消化道出血。辅助检查:血常规白细胞3.46×109/L,血红蛋白68 g/L,血小板53×109/L,中性粒细胞2.99×109/L;丙氨酸氨基转移酶731.3 U/L,门冬氨酸氨基转移酶2 074.7 U/L,乳酸脱氢酶3 600.3 U/L,甘油三脂3.81 mmol/L,纤维蛋白原1.74 g/L,铁蛋白>40 000.00 ng/mL,降钙素原>100.0 ng/mL,NK细胞活性1.1%,sCD25:2 985 U/mL。骨髓细胞学:骨髓增生尚活跃,可见3.0%的组织细胞,在片尾处可见吞噬较多晚幼红细胞和中性粒细胞;血液细胞学:分类白细胞可见12%的组织细胞。高精度全外显基因检测未提示相关基因突变。根据HLH2004诊断标准,诊断感染相关噬血细胞综合征,按HLH2004方案给予甲强龙、VP16、环孢素治疗共14周,VP16累积剂量1 100 mg/m2,病情控制于2020年7月停药。
患儿出院后基本正常,2021年2月因“发现粒细胞减少半月余”再次入院,血常规白细胞计数2.30×109/L,血红蛋白113 g/l,血小板计数90×109/L,中性粒细胞计数0.30×109/L,肝功能、凝血功能、铁蛋白、sCD25等无异常,排除HLH复发,骨髓细胞学及免疫分型提示急性髓系细胞白血病(M3)。分子遗传学:PML/RARa(bc1)融合基因阳性,WT1基因定量提示高表达,染色体核型分析:46,XY,t(15;17)(q22;q21)。诊断急性早幼粒细胞白血病(acute promyelocytic leukemia,APL),给予维甲酸、伊达比星、复方黄黛片诱导化学治疗(化疗),第23天复查骨穿完全缓解。继续给予维甲酸、复方黄黛片巩固化疗,过程顺利,多次复查骨髓处于缓解状态。目前患儿HLH及APL复查均处于稳定状态,无特殊不适。
2 文献复习本文以“噬血细胞综合征、白血病”和“hemopha-gocytic lymphohistiocytosis、leukemia”为关键词分别检索知网、万方及PubMed数据库,查阅文献发现,HLH继发白血病报道较少,且几乎全为儿童,共发现相关文献18篇,2篇因病例资料不全被剔除,1篇因患者年龄62岁被剔除,最后纳入分析共15篇(国内3篇、国外12篇),共报道17例,包括本组1例,共计18例,见表 1。在纳入分析的18例患者中,男性13例(72.22%),女性5例(27.78%),首次诊断HLH的年龄为0~19岁,中位年龄为3岁;HLH类型:FHL 3例(16.67%),EB病毒感染相关噬血细胞综合征(EBV-HLH)11例(61.11%),不明类型3例(16.67%),本例为表皮短杆菌感染相关HLH。在确诊HLH后所有患者均接受了包含VP16的化疗方案,其中6例接受HLH-94方案,8例接受HLH-04方案,4例方案不明,VP16累积剂量为400~20 500 mg/m2,中位数为3 100 mg/m2。从HLH诊断到白血病或骨髓增生异常综合征的发病时间为6~72个月,中位发病时间为26个月,继发肿瘤中最常见为AML(15例,占83.33%;M2型1例,M3型6例,M4型2例,M5型4例,不明分型2例),T-ALL、急性混合细胞型白血病及骨髓增生异常综合征(MDS)各1例。在16例可供分析的细胞遗传学或分子生物学资料的患者中,正常核型4例(25.00%),异常核型12例(75.00%),异常核型中t(15;17)(q22;q21)易位6例(50.00%),t(9, 11)(p22;q23)易位3例(25.00%),复杂核型2例(16.67%),存在11q23重排6例(50.00%)。18例患者中死亡6例,存活12例;其中6例M3接受化疗后均完全缓解并存活,其他12例非M3患者中7例接受移植(存活4例,死亡3例),4例接受化疗(存活2例,死亡2例),1例放弃。见表 1。
| 表 1 18例HLH治疗后继发白血病患儿的临床特征及转归 Table 1 Clinical characteristics and prognosis of 18 children with secondary leukemia after receiving therapy for HLH |
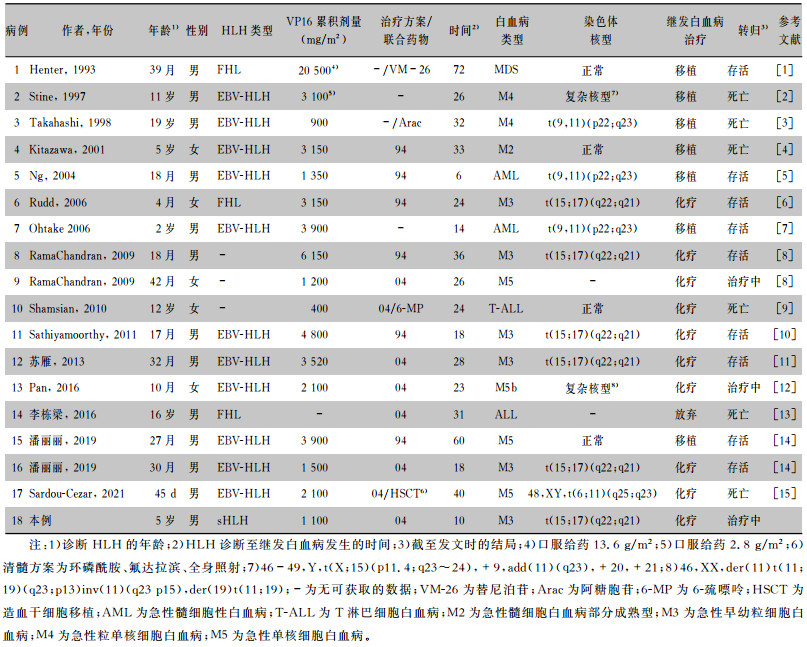
|
HLH是一场灾难性的免疫系统紊乱,其通常与感染有关,感染既是其最常见的继发原因,也是儿童FHL最常见的诱因[16]。本例报告通过宏基因确诊为表皮短杆菌引起的细菌性心内膜炎。短杆菌属(Brevibacterium species)是一种过氧化氢酶阳性、专性需氧G+杆菌,此类细菌在人类皮肤上定植,既往经常被认为是污染菌。直到近几十年,短杆菌属相关性血流感染的临床报道不断增加,其被确认为是引起某些重大疾病的病因。表皮短杆菌引起的心内膜炎目前报道较少,据笔者所知,目前仅国外报道2例,使用万古霉素治疗均有效[17-18]。本例诊断表皮短杆菌心内膜炎后,予美罗培南+万古霉素抗感染,2周后体温下降,但HLH相关指标进行性上升,最后考虑感染继发噬血综合征。
在近30年中,随着对HLH治疗方案的不断改进,儿童HLH患者的5年生存率提高至62%[19]。VP16作为一线用药,对单核细胞有很高的活性,能够阻止感染细胞中EBV-DNA的合成,降低FHL移植前死亡率,延长疾病缓解时间,在HLH,尤其是EBV-HLH治疗中具有相当重要的作用[19]。但同时,VP16作为拓扑异构酶抑制剂的一种,其致白血病的作用同样引起了临床医生的关注。
VP16治疗引起的白血病在儿童血液肿瘤及多种实体瘤中被报道[20-22],相比之下,HLH治疗后继发白血病的发生较为罕见。VP16治疗引起的白血病特点有:最常见为AML,且倾向于单核细胞表型;潜伏期相对较短(2~3年);常伴11q23染色体易位。在本文纳入分析的病例中,潜伏期中位时间26个月,其中最短的仅6个月,该病例在HLH诊断后3个月(距最后一次VP16使用1个月)时骨髓中便可检测出MLL裂解片段[5]。继发白血病最常见的为AML,在12例异常核型中6例存在11q23重排,与既往报道的VP16治疗引起的白血病特点相符合。在已知亚型的13例AML中,M3占较大比例(46.15%,6/13),此现象在一项关于朗格汉斯细胞组织增生症治疗中VP16相关AML的研究中被报道过[23],其具体的机制值得进一步研究。
本文纳入的病例中,EBV-HLH继发白血病占61.11%,目前仍缺乏对各类型HLH继发白血病风险的大宗病例及多中心研究,相关的流行病学研究仍较少。两项前瞻性研究纳入的600多例HLH患者中,仅2例发展为AML,提示发生率不足1%[19, 24];一项日本研究报道EBV-HLH患者中继发白血病发生率为1.23%(1/81)[25],而国内报道发生率为4.76%(2/42)[14]。感染性HLH仍是HLH继发白血病中较常见的原发病类型,包括EB病毒、细菌(如本文中报告的表皮短杆菌)等感染。虽然HLH治疗后继发白血病风险较低,但仍然需要高度关注HLH继发白血病的发生情况,尤其是感染性HLH治疗后。
目前认为VP16继发白血病主要与累积剂量、应用频率、联合方案等因素相关,其中累积剂量是主要因素,但关于安全剂量目前仍有争议。在儿童实体瘤中,有研究认为VP16累积剂量在1.2~6 g/m2时,继发AML的风险增加了7倍,而超过6 g/m2的患者该风险是197倍[20]。关于朗格汉斯组织细胞增生症患者的研究结果提示,VP16累积量超过4 000 m2时发生继发AML风险明显增加[23]。此外,现普遍认为1周2次或1周1次的给药频率继发白血病风险较高[26],而在HLH治疗中大部分方案为该频率。当在VP16治疗过程中同时使用其他引起DNA破坏的药物,如烷化剂、放射治疗等,继发白血病风险将增加[20]。本文分析的病例中VP16累积剂量中位数为3 100 mg/m2,虽然目前大部分研究认为低于2 000 m2剂量时相对较安全,但文献分析结果显示仍有6例患者累积剂量小于2 000 mg/m2,2例患者的累积剂量甚至低于1 000 mg/m2,提示没有绝对的安全剂量。本例患儿VP16累积剂量为1 100mg/m2,远低于大多数报道病例,提示临床医生在关注VP16剂量、频率、联合方案时,也应考虑患者异质性问题。
通过本病例和相关文献复习,有如下方面需要高度重视:(1)感染相关HLH是HLH继发白血病中较常见的原发病类型,除关注EB病毒等病毒感染外,对细菌感染也不容忽视;(2)在继发白血病中,以APL发生率较高;(3)针对HLH采用VP16基础化疗期间,需要关注VP16累积剂量、应用频率、联合方案以及患者个体差异等情况;(4)在VP16治疗中及治疗后,骨髓的分子生物学检测有助于监测继发白血病的发生。对上述方面的关注,也许更能提高儿童HLH的诊治效果,减少继发白血病的发生,促进儿童HLH的总体生存率。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Henter JI, Elinder G, Lübeck PO, et al. Myelodysplasia syndrome following epipodophyllotoxin therapy in familial hemophagocytic lymphohistiocytosis[J]. Pediatr Hematol Oncol, 1993, 10(2): 163-168. DOI:10.3109/08880019309016551 |
| [2] |
Stine KC, Saylors RL, Sawyer JR, et al. Secondary acute mye-logenous leukemia following safe exposure to etoposide[J]. J Clin Oncol, 1997, 15(4): 1583-1586. DOI:10.1200/JCO.1997.15.4.1583 |
| [3] |
Takahashi T, Yagasaki F, Endo K, et al. Therapy-related AML after successful chemotherapy with low dose etoposide for virus-associated hemophagocytic syndrome[J]. Int J Hematol, 1998, 68(3): 333-336. |
| [4] |
Kitazawa J, Ito E, Arai K, et al. Secondary acute myelocytic leukemia after successful chemotherapy with etoposide for Epstein-Barr virus-associated hemophagocytic lymphohistiocytosis[J]. Med Pediatr Oncol, 2001, 37(2): 153-154. DOI:10.1002/mpo.1189 |
| [5] |
Ng A, Ravetto PF, Taylor GM, et al. Coexistence of treatment-related MLL cleavage and rearrangement in a child with haemophagocytic lymphohistiocytosis[J]. Br J Cancer, 2004, 91(12): 1990-1992. DOI:10.1038/sj.bjc.6602269 |
| [6] |
Rudd E, Göransdotter Ericson K, Zheng C, et al. Spectrum and clinical implications of syntaxin 11 gene mutations in familial haemophagocytic lymphohistiocytosis: association with disease-free remissions and haematopoietic malignancies[J]. J Med Genet, 2006, 43(4): e14. |
| [7] |
Ohtake M, Suzuki R, Kondo S, et al. Etoposide-related t-AML in a case of EBV-HLH[C]. Proceedings of 16th Annual Meeting of EBV infection-related diseases. Tokyo (Japanese), 2006.
|
| [8] |
RamaChandran S, Ariffin H. Secondary acute myeloid leukemia after etoposide therapy for haemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2009, 53(3): 488-490. DOI:10.1002/pbc.22063 |
| [9] |
Shamsian BS, Gharib A, Rezaei N, et al. Development of secondary T-cell acute lymphoblastic leukemia in a child with hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2010, 55(4): 725-726. DOI:10.1002/pbc.22578 |
| [10] |
Sathiyamoorthy S, Shad A, Ozdemirli M. Acute promyelocytic leukemia following chemotherapy for EBV-associated hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2011, 56(5): 850-852. DOI:10.1002/pbc.22718 |
| [11] |
苏雁, 周翾, 张莉, 等. 噬血细胞综合征治疗后继发急性早幼粒细胞白血病一例报告并文献复习[J]. 中华儿科杂志, 2013, 51(12): 938-942. Su Y, Zhou X, Zhang L, et al. Report of a case with secondary acute promyelocytic leukemia after therapy for hemophagocytic lymphohistiocytosis and review of literature[J]. Chinese Journal of Pediatrics, 2013, 51(12): 938-942. DOI:10.3760/cma.j.issn.0578-1310.2013.12.012 |
| [12] |
Pan H, Feng DN, Song L, et al. Acute myeloid leukemia following etoposide therapy for EBV-associated hemophagocytic lymphohistiocytosis: a case report and a brief review of the literature[J]. BMC Pediatr, 2016, 16: 116. DOI:10.1186/s12887-016-0649-z |
| [13] |
李栋梁, 侯兰芬, 王志伟, 等. 原发性噬血细胞综合征治疗后转变为急性混合细胞白血病1例并文献复习[J]. 解放军医药杂志, 2016, 28(3): 113-116. Li DL, Hou LF, Wang ZW, et al. Secondary acute mixed-cell leukemia after therapy for primary hemophagocytic syndrome: a case report and literature review[J]. Medical & Pharmaceutical Journal of Chinese Peopl's Liberation Army, 2016, 28(3): 113-116. DOI:10.3969/j.issn.2095-140X.2016.03.027 |
| [14] |
潘丽丽, 李健, 乐少华, 等. 噬血细胞综合征治疗后继发急性白血病2例报告并文献复习[J]. 临床儿科杂志, 2019, 37(5): 331-335. Pan LL, Li J, Le SH, et al. Therapy-related acute leukemia after treatment for hemophagocytic lymphohistiocytosis: a report of 2 cases and literature review[J]. Journal of Clinical Pediatrics, 2019, 37(5): 331-335. DOI:10.3969/j.issn.1000-3606.2019.05.003 |
| [15] |
Sardou-Cezar I, Lopes BA, Andrade FG, et al. Therapy-related acute myeloid leukemia with KMT2A-SNX9 gene fusion associated with a hyperdiploid karyotype after hemophagocytic lymphohistiocytosis[J]. Cancer Genet, 2021, 256-257: 86-90. DOI:10.1016/j.cancergen.2021.05.001 |
| [16] |
Al-Samkari H, Berliner N. Hemophagocytic lymphohistiocytosis[J]. Annu Rev Pathol, 2018, 13: 27-49. DOI:10.1146/annurev-pathol-020117-043625 |
| [17] |
Manetos CM, Pavlidis AN, Kallistratos MS, et al. Native aortic valve endocarditis caused by Brevibacterium epidermidis in an immunocompetent patient[J]. Am J Med Sci, 2011, 342(3): 257-258. DOI:10.1097/MAJ.0b013e31821ffb9f |
| [18] |
Dass KN, Smith MA, Gill VJ, et al. Brevibacterium endocarditis: a first report[J]. Clin Infect Dis, 2002, 35(2): e20-e21. DOI:10.1086/340984 |
| [19] |
Bergsten E, Horne A, Aricó M, et al. Confirmed efficacy of etoposide and dexamethasone in HLH treatment: long-term results of the cooperative HLH-2004 study[J]. Blood, 2017, 130(25): 2728-2738. DOI:10.1182/blood-2017-06-788349 |
| [20] |
Le Deley MC, Leblanc T, Shamsaldin A, et al. Risk of se-condary leukemia after a solid tumor in childhood according to the dose of epipodophyllotoxins and anthracyclines: a case-control study by the Société Française d'Oncologie Pédiatrique[J]. J Clin Oncol, 2003, 21(6): 1074-1081. DOI:10.1200/JCO.2003.04.100 |
| [21] |
Ng A, Taylor GM, Eden OB. Secondary leukemia in a child with neuroblastoma while on oral etoposide: what is the cause?[J]. Pediatr Hematol Oncol, 2000, 17(3): 273-279. DOI:10.1080/088800100276460 |
| [22] |
Advani PG, Schonfeld SJ, Curtis RE, et al. Risk of therapy-related myelodysplastic syndrome/acute myeloid leukemia after childhood cancer: a population-based study[J]. Leukemia, 2019, 33(12): 2947-2978. DOI:10.1038/s41375-019-0520-y |
| [23] |
Haupt R, Fears TR, Heise A, et al. Risk of secondary leukemia after treatment with etoposide (VP-16) for Langerhans' cell histiocytosis in Italian and Austrian-German populations[J]. Int J Cancer, 1997, 71(1): 9-13. DOI:10.1002/(SICI)1097-0215(19970328)71:1<9::AID-IJC3>3.0.CO;2-Y |
| [24] |
Trottestam H, Horne A, Aricò M, et al. Chemoimmunothe- rapy for hemophagocytic lymphohistiocytosis: long-term results of the HLH-94 treatment protocol[J]. Blood, 2011, 118(17): 4577-4584. DOI:10.1182/blood-2011-06-356261 |
| [25] |
Imashuku S, Teramura T, Kuriyama K, et al. Risk of etoposide-related acute myeloid leukemia in the treatment of Epstein-Barr virus-associated hemophagocytic lymphohistiocytosis[J]. Int J Hematol, 2002, 75(2): 174-177. DOI:10.1007/BF02982023 |
| [26] |
Pui CH, Ribeiro RC, Hancock ML, et al. Acute myeloid leukemia in children treated with epipodophyllotoxins for acute lymphoblastic leukemia[J]. N Engl J Med, 1991, 325(24): 1682-1687. DOI:10.1056/NEJM199112123252402 |



