2. 长沙市妇幼保健院院感科, 湖南 长沙 410008
2. Department of Healthcare-associated Infection, Changsha Hospital for Maternal and Child Health Care, Changsha 410008, China
跟骨骨髓炎占骨感染的3%~10%[1],是目前治疗非常棘手的一种感染性疾病,许多患者由于感染难以控制而导致截肢。跟骨处于肢体的最远端,是负担全身体重的负重骨,仅有少量的软组织覆盖,血液循环有限,因此跟骨骨髓炎治疗困难[1-2]。临床治疗以手术治疗和药物治疗相结合,其中药物治疗包括全身用药,局部外用药等,跟骨骨髓炎感染病原菌耐药的出现,以及耐药菌在各个地区间的差异,使其经验性抗感染治疗变得更加困难。病原体的检测对于跟骨骨髓炎有效治疗,预防感染,以及避免截肢至关重要。为了解湘南地区跟骨骨髓炎致病菌特点及药敏情况,精准、有效使用抗菌药物治疗跟骨骨髓炎,本研究统计分析郴州某医院骨科收治的跟骨骨髓炎患者临床资料、病原菌分布及耐药性,现报告如下。
1 对象与方法 1.1 研究对象利用湖南省郴州某医院病历系统,查询获得2017年1月—2020年12月在出院诊断中明确标注跟骨骨髓炎的患者。按纳入与排除标准,收集符合条件患者的临床资料,包括患者年龄、性别、致病原因、营养状况、合并症、病程、感染源、异物存留、手术病灶清除史、截肢、抗菌药物、血清清蛋白、血红蛋白、细菌培养药敏结果和是否检出多重耐药菌等临床资料。
1.2 纳入与排除标准纳入标准:经X线等影像学诊断或者骨组织病理诊断为跟骨骨髓炎,且在不同时期完整地采取了表面、深部分泌物及骨组织标本进行培养和药敏试验。排除标准:①重复病例,如同一患者再次因重复致病菌感染并入院;②压疮导致的足跟溃疡,并出现医院获得性感染;③合并有恶性肿瘤或重要脏器严重器质性病变或损伤;④合并免疫功能障碍性疾病;⑤合并全身性感染者;⑥病例资料不完整者。
1.3 标本采集(1) 表面分泌物:无菌采样拭子蘸取跟骨伤口表面或者窦道周围的分泌物,一次性无菌试管保存。(2)深部脓性分泌物:采用无菌采样拭子或者一次性无菌注射器于窦道内或者伤口深处,跟骨骨皮质表面取样。(3)骨组织培养:行清创术,刮取的跟骨骨组织,应用一次性无菌试管保存。糖尿病足合并感染导致跟骨骨髓炎的病例均取骨组织进行厌氧菌培养。采取的标本均在该院检验科进行培养。
1.4 菌株鉴定及药敏试验使用该院全自动细菌鉴定仪(梅里埃VITEK 2)进行病原菌鉴定,药敏试验采用K-B纸片扩散法及最低抑菌浓度(MIC)测定法,质控菌株均来自湖南省临床检验中心。按美国国家临床和实验室标准协会(CLSI,2018年版)推荐的标准判断药敏结果,记录致病菌及抗菌药物敏感性,并标记出多重耐药菌感染的病例。多重耐药定义为:对可用药物中3类或更多(每类中的1种或更多)不敏感[3]。3种标本采集方法如果均培养出同一致病菌,记录该致病菌为该例患者的病原菌。如培养结果不是同一致病菌,则视条件再次留取样本进行培养。最终以骨组织培养结果为诊断依据,如表面或者深部分泌物培养结果与骨组织培养结果不一致,则视其结果为假阳性,不予统计为阳性结果。
1.5 统计方法应用SPSS 22.0统计学软件对数据进行分析处理,计数资料采用卡方检验进行比较,采用单因素方差分析和logistic回归分析跟骨骨髓炎患者多重耐药菌感染影响因素。单因素分析使用χ2检验或Fisher’s确切概率法。非条件logistic回归分析,采用逐步法筛选变量,P≤0.05为差异具有统计学意义。
2 结果 2.1 一般资料174例跟骨骨髓炎病例符合纳入标准,其中男性118例(67.8%),女性56例(32.2%),男女比例为2.1∶1.0;年龄5~88岁,平均(53.4±15.2)岁。所有病例均进行了一次以上的骨髓炎清创手术,16例(9.2%)患者跟骨骨髓炎感染控制失败,采取踝关节以上的截肢处理。
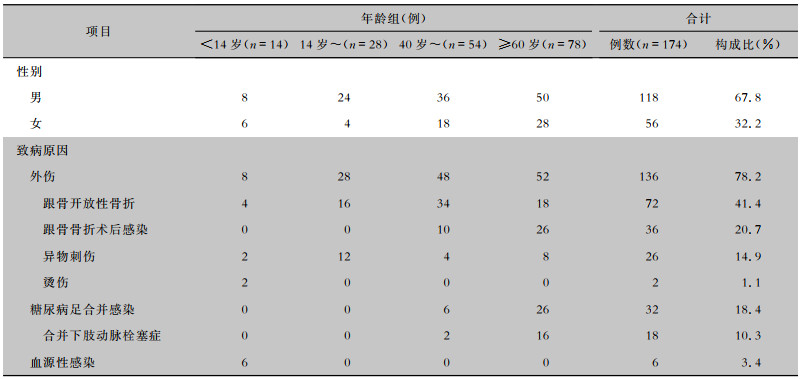
2.2 致病原因174例跟骨骨髓炎患者主要发生在40~60岁(54例,31.0%)和>60岁(78例,44.8%)年龄组。136例(78.2%)为跟骨外伤导致的骨髓炎,其中108例(79.4%)为跟骨骨折,主要为闭合性跟骨骨折行切开复位内固定术,术中感染或术后切口不愈合并感染扩散至跟骨所致;其余病例为跟骨被铁钉、竹签等异物刺伤或烫伤软组织等其他原因所致。32例(18.4%)由糖尿病足感染所致,其中18例(56.3%)患者合并下肢动脉硬化闭塞症。6例(3.4%)患者为血源性感染所致,均发生在≤14岁年龄组。见表 1。
| 表 1 不同年龄组跟骨骨髓炎患者性别及病因分布 Table 1 Distribution of gender and etiology in patients in different age groups with calcaneal osteomyelitis |
|
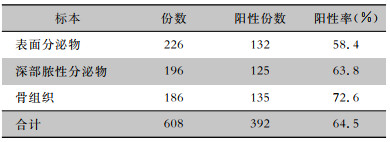
所有病例均进行3次及以上的标本培养,共采集608份标本,其中表面分泌物标本226份,深部分泌物标本196份,骨组织标本186份。64.5%的标本能获得培养和药敏结果。11.2%的标本培养结果显示存在3种以上的细菌,均为表面分泌物标本。未见表面和深部分泌物标本培养结果一致,而与骨组织标本培养结果不一致的情况,也没有出现表面分泌物、深部分泌物和骨组织标本培养出不同病原菌的情况。骨组织标本培养阳性率最高(72.6%),表面分泌物标本培养阳性率最低(58.4%)。3种标本培养阳性率比较,差异有统计学意义(χ2=9.010,P=0.011)。见表 2。32例患者为糖尿病足合并感染致跟骨骨髓炎,采集其骨组织标本进行厌氧菌培养,培养出14株厌氧菌。62例患者3种标本多次培养,均未培养出明确的致病菌。
| 表 2 跟骨骨髓炎患者不同标本微生物培养阳性情况 Table 2 Microbial positive culture of different specimens of patients with calcaneal osteomyelitis |
|
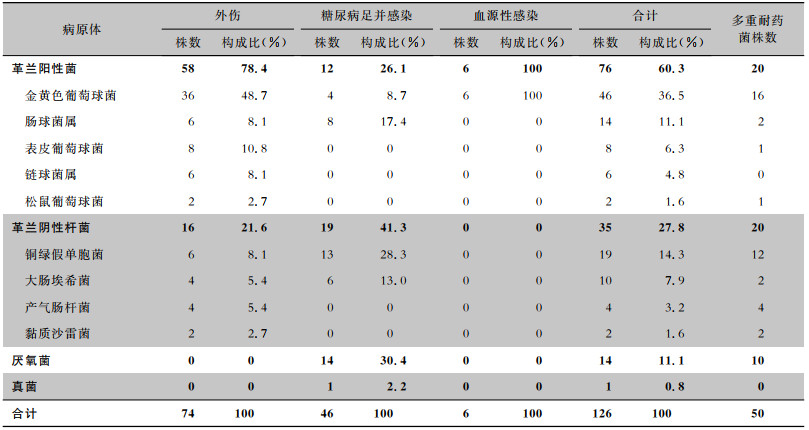
174例患者共分离126株病原菌。见表 3。跟骨外伤导致的骨髓炎主要病原菌为革兰阳性菌(78.4%),而糖尿病足合并感染的病原菌有1例仅检出厌氧菌,14例检出混合菌(其中1例为细菌与真菌,13例为细菌与厌氧菌),血源性感染均为革兰阳性菌。革兰阳性菌中金黄色葡萄菌和肠球菌属占大多数,分别为60.5%、18.4%,46株金黄色葡萄球菌对万古霉素、利奈唑胺均敏感,检出耐甲氧西林葡萄球菌(MRSA)16株(34.8%)。14株肠球菌中,2株(14.3%)肠球菌对万古霉素耐药,8株(57.1%)对庆大霉素耐药,8株(57.1%)对β-内酰胺类抗生素耐药。35株(27.8%)革兰阴性杆菌主要为铜绿假单胞菌(19株)和大肠埃希菌(10株),其中12株(63.2%)铜绿假单胞菌株对碳青霉烯类抗生素耐药,2株(20.0%)大肠埃希菌产超广谱β-内酰胺酶(ESBLs)。
| 表 3 不同病因跟骨骨髓炎致病菌构成及多重耐药菌检出情况 Table 3 Constitute of pathogrenic bacteria and detection of MDROs in calcaneal osteomyelitis with different etiologies |
|
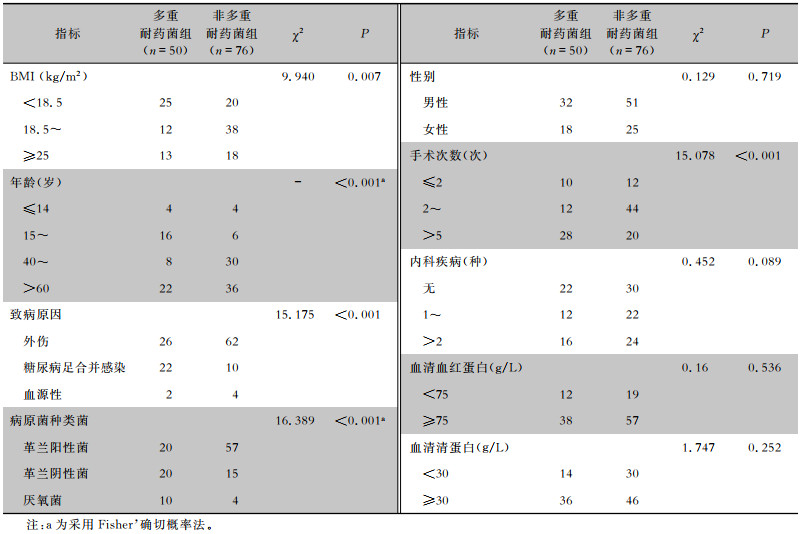
174例跟骨骨髓炎患者中50例分离出多重耐药菌,占28.7%。将跟骨骨髓炎患者按是否为多重耐药菌感染分为多重耐药菌感染组和非多重耐药菌感染组,单因素分析显示,身体质量指数(BMI)、年龄、致病原因、病原菌种类、手术次数,多重耐药菌感染组患者与非多重耐药菌组患者比较,差异均具有统计学意义(均P<0.05);性别、内科疾病、血清清蛋白和血清血红蛋白,多重耐药菌感染组患者与非多重耐药菌组患者比较,差异均无统计学意义(均P>0.05)。见表 4。
| 表 4 两组跟骨骨髓炎患者相关因素单因素分析 Table 4 Univariate analysis of relevant factors in two groups of patients with calcaneal osteomyelitis |
|
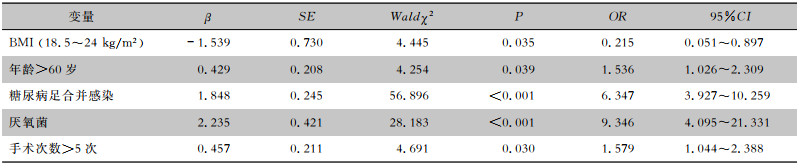
将跟骨骨髓炎多重耐药菌感染单因素分析结果有统计学意义的因素引入logistic回归分析,结果显示年龄>60岁、糖尿病足合并感染、厌氧菌感染、手术次数>5次是跟骨骨髓炎多重耐药菌感染患者的独立危险因素。BMI为18.5~24 kg/m2是跟骨骨髓炎多重耐药感染患者的独立保护因素。见表 5。
| 表 5 跟骨骨髓炎多重耐药菌感染患者影响因素logistic回归分析 Table 5 Logistic regression analysis of influencing factors for MDRO infection in patients with calcaneal osteomyelitis |
|
跟骨骨髓炎是四肢骨常见的感染,与跟骨独特的解剖和位置有关。发生全身性菌血症的儿童,因跟骨离心较远,至跟骨骨骺的血流量明显减少,细菌滞留在此处容易继发跟骨骨髓炎[4]。成人跟骨骨髓炎一般为临近部位感染扩散或者外源性感染引起的。南方医院统计34例非糖尿病足的跟骨骨髓炎患者的致病原因,20例(58.8%)为开放性跟骨骨折,11例(32.4%)为骨折术后感染,7例(20.1%)为异物刺伤[5]。60%的开放性跟骨骨折发生感染[1],跟骨骨折行切开复位内固定术出现骨髓炎的概率也较其他部位高。如果跟骨骨折行外侧方“L”形手术切口,切口皮肤坏死率为25%[6]。手术切口处的坏死组织可能延迟愈合或者不愈合,很大程度上增加了跟骨骨髓炎的发生率。对于老年患者,特别是合并糖尿病的患者,跟骨部位容易出现因继发于神经紊乱或压力并发症的慢性溃疡,糖尿病周围神经病变更是发展为慢性溃疡的主要危险因素[7],这类患者的治疗往往更加困难。Brodell等[8]研究表明,糖尿病足合并感染导致的跟骨骨髓炎进行清创手术后,治疗效果仍然很差,68.4%患者出现伤口不愈合,50%的患者需要再次手术,26.3%的患者需要切除跟骨,18.4%的患者需要截肢处理。跟骨处褥疮是临床第二常见的压疮,占压疮的19%~32%[9]。长期卧床,持续压力导致足跟褥疮、溃疡并感染。糖尿病足患者合并下肢动脉血管闭塞,足跟部软组织也可因缺血而出现坏死、溃疡并感染。溃烂的软组织处细菌扩散至薄弱皮质的跟骨,很可能快速出现骨髓炎。本研究结果显示,该院收治的跟骨骨髓炎患者中,年龄>60岁的患者占44.8%,与跟骨骨髓炎发病人口学特征相符。跟骨开放性骨折主要出现在40~60岁年龄组,此部分人群常因车祸、重物砸伤等因素导致跟骨开放性损伤,继而引起外源性感染,出现跟骨骨髓炎。儿童跟骨骨髓炎主要是由血源性感染所致,同时儿童也是意外伤害的高危人群,部分跟骨骨髓炎也可因相邻部分外伤感染扩散至跟骨所致[10]。本研究中,外伤(78.2%)是导致跟骨骨髓炎的主要原因,但此占比可能偏高。存在部分糖尿病足合并感染导致的跟骨骨髓炎患者,可能因治疗费用高、住院时间长、治疗效果差或者其他原因,放弃住院治疗或者仅在家自行换药治疗,导致此部分患者未纳入研究,因此糖尿病足合并感染导致跟骨骨髓炎的实际发病率可能更高。
骨组织检出致病菌是诊断骨髓炎的金标准。经皮穿刺骨、骨髓穿刺和手术切取骨组织均是培养标本采样方法,但培养阳性率会受采样前抗菌药物使用等因素的影响[11-12]。表面分泌物采样虽然简单、方便,但阳性率低、假阳性率高,临床参考价值备受怀疑。Senneville等[13]对69例糖尿病足骨髓炎患者,分别经皮骨穿刺获得骨组织和拭子蘸取表面分泌物进行培养,仅12个标本骨组织和表面分泌物培养结果相同,说明表面分泌物培养不能有效地确定骨髓炎感染病原体。本研究未在同期采集不同的标本进行培养,因此没有对照分析两者获得的病原菌,但来自表面分泌物培养的68份标本培养出三种以上的细菌,也体现出了表面分泌物培养的可靠性差的特点。Barshes等[14]研究表明,跟骨骨髓炎患者需要多次手术,细菌培养结果多为金黄色葡萄球菌、革兰阴性菌和厌氧菌,而肠球菌是最难清除的。因此,本研究对于糖尿病足并感染导致跟骨骨髓炎的病例除了常规培养外均取骨组织进行厌氧菌培养,阳性率达43.8%。考虑到外伤导致的骨髓炎为厌氧菌感染概率较低,没有常规进行厌氧菌培养,可能对结果产生了一定误差。本研究中,金黄色葡萄球菌仍是跟骨骨髓炎最常见的病原菌,占36.5%,与现有循证学研究[15]结果相符,对万古霉素、利奈唑胺均敏感。跟骨外伤和血源性感染所致的跟骨骨髓炎,感染病原菌主要为革兰阳性菌,占80.0%;糖尿病足并感染导致的骨髓炎,病原菌以铜绿假单胞菌为主,但有30.4%的病例为厌氧菌感染。肠球菌属细菌是本研究中最棘手的耐药菌,经过多次清创手术和抗菌药物治疗后仍可检出。16例截肢患者中,有10例为肠球菌感染所致。
174例跟骨骨髓炎患者,50例分离出多重耐药菌,占28.74%,提示跟骨骨髓炎患者中多重耐药菌感染率较高,常使临床治疗陷入窘境,可能是抗菌药物治疗失败导致截肢的重要原因。糖尿病足是诱发跟骨骨髓炎的重要原因。一项多中心研究[16]结果显示,36.8%的糖尿病足感染患者被诊断骨髓炎,病原菌培养分离结果中MRSA占金黄色葡萄球菌的31%,多重耐药菌占铜绿假单胞菌的21%,ESBLs阳性菌株占大肠埃希菌和克雷伯菌属细菌的38%。本研究跟骨骨髓炎患者多重耐药菌感染单因素分析结果显示,BMI、年龄、致病原因、病原菌种类、手术次数是其相关因素。糖尿病患者营养水平低,BMI低于正常,很大程度上增加了感染的风险。此外,糖尿病患者为免疫力低人群,是医院感染高危人群;糖尿病足跟骨骨髓炎治疗时间长,先后应用过多种抗菌药物,可能是其多重耐药菌感染的重要原因[17-18]。老年患者往往合并较多的内科疾患,自身免疫功能较为低下,住院次数多和住院时间较长,一旦进行跟骨骨折手术,术后切口不愈合、切口感染,导致多重耐药菌感染的概率也增加。手术病灶清创、局部灌洗引流或者抗生素骨水泥填塞是治疗跟骨骨髓炎的常用办法,手术次数越多,说明感染越严重,并且反复发作,住院时间长,多重耐药菌感染的可能性大,最后可能需要截肢控制感染,预后不佳。
本研究分析跟骨骨髓炎的发病原因、病原菌组成及耐药情况,结果显示跟骨骨髓炎致病菌以金黄色葡萄球菌、肠球菌和铜绿假单胞菌为主,易出现多重耐药菌感染,BMI 18.5~24 kg/m2、糖尿病、高龄、厌氧菌感染及多次手术是多重耐药菌感染的相关因素。跟骨骨髓炎感染菌耐药现象严峻,治疗难度大,截肢率高,治疗前景令人担忧。应该及时手术同时合理使用抗菌药物,减少耐药菌出现。该院为湘南地区最大的三甲医院,结果初步能反映湘南地区跟骨骨髓炎的发病情况,可以为跟骨骨髓炎的进一步研究提供支持。但尚存在一些不足,如为回顾性的单中心研究,样本量偏少,仍然有待进一步积累。下一步研究将继续增加样本量,并联合该地区其他医院开展前瞻性研究,为跟骨骨髓炎的诊断和治疗提供更详细的数据支持。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
McCann MJ, Wells A. Calcaneal osteomyelitis: current treatment concepts[J]. Int J Low Extrem Wounds, 2020, 19(3): 230-235. DOI:10.1177/1534734619895187 |
| [2] |
Tiemann AH, Hofmann GO, Steen M, et al. Adult calcaneal osteitis: incidence, etiology, diagnostics and therapy[J]. GMS Interdiscip Plast Reconstr Surg DGPW, 2012, 1: Doc11. |
| [3] |
杨启文, 吴安华, 胡必杰, 等. 临床重要耐药菌感染传播防控策略专家共识[J]. 中国感染控制杂志, 2021, 20(1): 1-14. Yang QW, Wu AH, Hu BJ, et al. Expert consensus on strate- gies for the prevention and control of spread of clinically important antimicrobial-resistant organisms[J]. Chinese Journal of Infection Control, 2021, 20(1): 1-14. |
| [4] |
Leigh W, Crawford H, Street M, et al. Pediatric calcaneal osteomyelitis[J]. J Pediatr Orthop, 2010, 30(8): 888-892. DOI:10.1097/BPO.0b013e3181fa7955 |
| [5] |
Jiang N, Zhao XQ, Wang L, et al. Single-stage debridement with implantation of antibiotic-loaded calcium sulphate in 34 cases of localized calcaneal osteomyelitis[J]. Acta Orthop, 2020, 91(3): 353-359. DOI:10.1080/17453674.2020.1745423 |
| [6] |
Clare MP, Crawford WS. Managing complications of calcaneus fractures[J]. Foot Ankle Clin, 2017, 22(1): 105-116. DOI:10.1016/j.fcl.2016.09.007 |
| [7] |
Waibel FWA, Uçkay I, Sairanen K, et al. Diabetic calcaneal osteomyelitis[J]. Infez Med, 2019, 27(3): 225-238. |
| [8] |
Brodell Jr JD, Kozakiewicz LN, Hoffman SL, et al. Intraope- rative site vancomycin powder application in infected diabetic heel ulcers with calcaneal osteomyelitis[J]. Foot Ankle Int, 2021, 42(3): 356-362. DOI:10.1177/1071100720962480 |
| [9] |
Baumgarten M, Margolis DJ, Localio AR, et al. Extrinsic risk factors for pressure ulcers early in the hospital stay: a nested case-control study[J]. J Gerontol A Biol Sci Med Sci, 2008, 63(4): 408-413. DOI:10.1093/gerona/63.4.408 |
| [10] |
Hoshina Y, Nakao H, Yoshida M, et al. Calcaneal osteomyelitis caused by Pseudomonas aeruginosa without foot injury[J]. Pediatr Int, 2021, 63(5): 601-602. DOI:10.1111/ped.14457 |
| [11] |
李萌, 张会峰, 肖二辉, 等. 糖尿病足患者骨髓炎病原菌分布特点及药敏分析[J]. 中华内分泌代谢杂志, 2020, 36(2): 120-126. Li M, Zhang HF, Xiao EH, et al. Distribution characteristics of pathogen and antibiotic susceptibility in diabetic foot osteomyelitis[J]. Chinese Journal of Endocrinology and Metabolism, 2020, 36(2): 120-126. |
| [12] |
Vemu L, Sudhaharan S, Mamidi N, et al. Need for appropria- te specimen for microbiology diagnosis of chronic osteomyelitis[J]. J Lab Physicians, 2018, 10(1): 21-25. DOI:10.4103/JLP.JLP_14_17 |
| [13] |
Senneville E, Lombart A, Beltrand E, et al. Outcome of diabetic foot osteomyelitis treated nonsurgically: a retrospective cohort study[J]. Diabetes Care, 2008, 31(4): 637-642. DOI:10.2337/dc07-1744 |
| [14] |
Barshes NR, Mindru C, Trautner BW, et al. Discordant isolates in bone specimens from patients with recurrent foot osteo- myelitis[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(4): 767-769. DOI:10.1007/s10096-019-03470-w |
| [15] |
Sabater-Martos M, Sigmund IK, Loizou C, et al. Surgical treatment and outcomes of calcaneal osteomyelitis in adults: a systematic review[J]. J Bone Jt Infect, 2019, 4(3): 146-154. DOI:10.7150/jbji.34452 |
| [16] |
Saltoglu N, Ergonul O, Tulek N, et al. Influence of multidrug resistant organisms on the outcome of diabetic foot infection[J]. Int J Infect Dis, 2018, 70: 10-14. DOI:10.1016/j.ijid.2018.02.013 |
| [17] |
章毅, 张利峰, 陈丽燕, 等. 糖尿病足溃疡患者多重耐药菌感染危险因素的Meta分析[J]. 中国感染控制杂志, 2019, 18(5): 430-438. Zhang Y, Zhang LF, Chen LY, et al. Meta-analysis on risk factors for multidrug-resistant organism infection in patients with diabetic foot ulcer[J]. Chinese Journal of Infection Control, 2019, 18(5): 430-438. |
| [18] |
李小磊, 芦永华, 黄新玲, 等. 糖尿病足溃疡病原菌分布及多重耐药菌感染的危险因素[J]. 中国感染控制杂志, 2018, 17(8): 708-712. Li XL, Lu YH, Huang XL, et al. Distribution of pathogens and risk factors of multidrug-resistant organism infection in patients with diabetic foot ulcer[J]. Chinese Journal of Infection Control, 2018, 17(8): 708-712. DOI:10.3969/j.issn.1671-9638.2018.08.011 |



