2. 遵义医科大学附属医院急诊科, 贵州 遵义 560003;
3. 遵义医科大学检验医学院, 贵州 遵义 563000
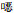 唑均耐药, 对哌拉西林/他唑巴坦、亚胺培南和美罗培南均为中介, 仅对阿米卡星敏感。此病例为国内首次从临床标本中分离出创口鲍特菌的报告, 为指导创口鲍特菌感染的快速、准确鉴定和临床合理用药提供参考。
唑均耐药, 对哌拉西林/他唑巴坦、亚胺培南和美罗培南均为中介, 仅对阿米卡星敏感。此病例为国内首次从临床标本中分离出创口鲍特菌的报告, 为指导创口鲍特菌感染的快速、准确鉴定和临床合理用药提供参考。2. Department of Emergency, Affiliated Hospital of Zunyi Medical University, Zunyi 560003, China;
3. School of Laboratory Medicine, Zunyi Medical University, Zunyi 563000, China
创口鲍特菌(Bordetella trematum)属于鲍特菌属,是一种革兰阴性短小杆菌。鲍特菌属包含的种类较多,其中最常见的是百日咳鲍特菌和副百日咳鲍特菌[1]。创口鲍特菌为专性需氧菌,营养要求不高,在普通营养琼脂平板上生长良好。Vandamme等[2]在1996年首次报道创口鲍特菌,并将其归类为鲍特菌属细菌中的一种。作为条件致病菌,其广泛存在于自然环境中。创口鲍特菌主要引起创面皮肤和软组织感染,也有报道从患者下呼吸道、耳分泌物和血液中分离到此菌。若治疗不及时,可引起严重的血流感染,导致脓毒血症,威胁患者生命[3]。目前,国内尚无关于创口鲍特菌感染的病例报道。1例上肢外伤患者伤口分泌物分离菌株,经生化鉴定、质谱鉴定,以及16S rRNA基因序列分析鉴定为创口鲍特菌,现将其临床特点和微生物特征报告如下。
1 资料与方法 1.1 仪器与试剂VITEK 2 Compact全自动微生物鉴定及药敏分析系统、VITEK MS全自动快速微生物质谱检测系统、阳性球菌鉴定卡、CHCA基质液均购自法国生物梅里埃公司, 快速革兰染色液购自珠海贝索公司,血琼脂培养基、麦康凯琼脂培养基均购自贝瑞特公司,细菌基因组提取试剂盒购自北京天根公司,PCR扩增试剂、DNA Maker购自TaKaRa公司(上海生物技术股份有限公司), 16S rRNA引物由上海生工生物工程技术服务有限公司合成。
1.2 方法 1.2.1 分离培养无菌棉拭子蘸取患者创面分泌物,采用分区划线法接种于血平板和麦康凯平板。置于36℃,5%CO2培养箱培养24~48 h,观察细菌生长情况。
1.2.2 显微镜观察挑取适量单个菌落,与适量生理盐水在载玻片上混匀,制成涂片,革兰染色后油镜观察。
1.2.3 生化鉴定挑取麦康凯平板上单个纯菌落,制成0.5麦氏单位的菌悬液。选择革兰阴性杆菌鉴定卡(GN), 根据全自动微生物鉴定及药敏分析系统VITEK 2 Compact操作说明书进行上机鉴定。
1.2.4 质谱鉴定取适量待测菌均匀涂抹于全自动快速微生物质谱检测系统VITEK MS配套靶板上,加1 μL的质谱样品处理基质液覆盖菌膜,以大肠埃希菌E.coli 8739为质控菌株,待基质液干燥后上机检测。
1.2.5 分子生物学鉴定使用全自动核酸提取仪制备细菌基因组DNA。采用16S rRNA通用引物正向引物:AGAGTTTGATCCTGGCTCAG;反向引物:ACGGCTACCTTGTTACGACTT进行PCR扩增。反应条件:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,30个循环,72℃延伸10 min。扩增产物送上海生工生物公司进行测序,并在NCBI网站进行序列比对分析。
1.2.6 药敏试验采用最低抑菌浓度(MIC)法进行药物敏感性检测。制备0.5麦氏单位菌悬液,根据革兰阴性菌药敏卡(GN09)要求进行稀释,然后使用VITEK 2 Compact仪器进行药敏试验。试验结果根据美国临床和实验室标准协会(CLSI) M100抗菌药物敏感性试验执行标准2020版进行判读。
2 结果 2.1 病例资料患者,男性,44岁,既往身体健康。2020年8月因工作时被机器绞伤致右上肢疼痛、流血伴活动受限到遵义医科大学附属医院急诊科就诊,初步诊断为“右上肢机械性绞伤”。急救创伤病房住院,经骨科医生施行右肘关节脱位复位+右尺骨骨折克氏针内固定术+右上肢外固定术,整形外科医生施行右上肢扩创+血管、神经探查+异物清除+得膜建覆盖创面+手背扩创+VSD安置术。术后病情平稳,嘱患者带外固定架出院休养,后期复查后再行后续治疗。
2020年11月患者因“右上肢外固定术2+月,返院行内固定术”。在全麻下行“右尺骨近端骨折切开复位内固定术+尺桡关节畸形愈合松解术”,术后予以抗感染、补液、止痛、换药、促进创面愈合等对症治疗。两周后临床医生检查发现其右上肢上段手术创面未愈合,手术创面红肿并且覆着脓性分泌物。患者自诉术区疼痛,偶感恶心、呕吐,无畏寒及发热,无胸闷、气促及呼吸困难,精神、饮食及睡眠可,大小便正常。实验室检查结果:血常规检查白细胞和血小板计数正常,红细胞4.03×1012/L, 血红蛋白110 g/L, 白细胞介素-6 82.5 pg/mL, 降钙素原(PCT) 0.45 ng/mL、C-反应蛋白(CRP) 36.2 mg/L,结果均提示患者可能并发术后感染。经两次引流、清创, 以及更换抗生素抗感染治疗,手术创面逐渐好转后出院,但仍有少许渗出,嘱患者院外加强换药。
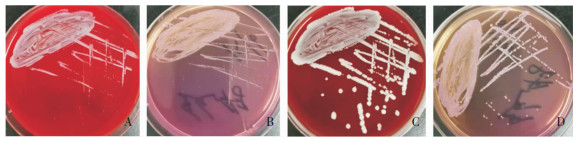
2.2 微生物学检查 2.2.1 菌落特征及镜下形态患者创面分泌物培养24 h后,观察发现血琼脂培养基上有圆形、干燥、粗糙大小不等的乳白色菌落,在麦康凯培养基上有淡粉红色、点状、干燥、针尖样大小的菌落。继续培养至48 h后观察发现血平板上的菌落呈扁平、干燥、表面粗糙、不规则、较大的乳白色菌落,在麦康凯培养基上长成较小的淡粉红色、圆形菌落。见图 1。革兰染色,油镜下观察见革兰阴性杆菌,中等大小。见图 2。
 |
| 注:A、B为培养24 h后菌落形态,C、D为培养48 h后菌落形态。 图 1 患者创面分泌物血平板和麦康凯培养基上培养的菌落形态 Figure 1 Colony morphology on blood agar plate and McConkey agar plate of patient's wound secretion |
 |
| 图 2 患者创面分泌物分离细菌革兰染色镜下形态(×1 000) Figure 2 Microscopic morphology of bacteria isolated from patient's wound secretion (×1 000) |
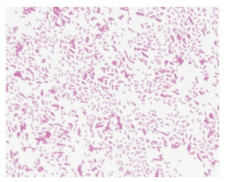
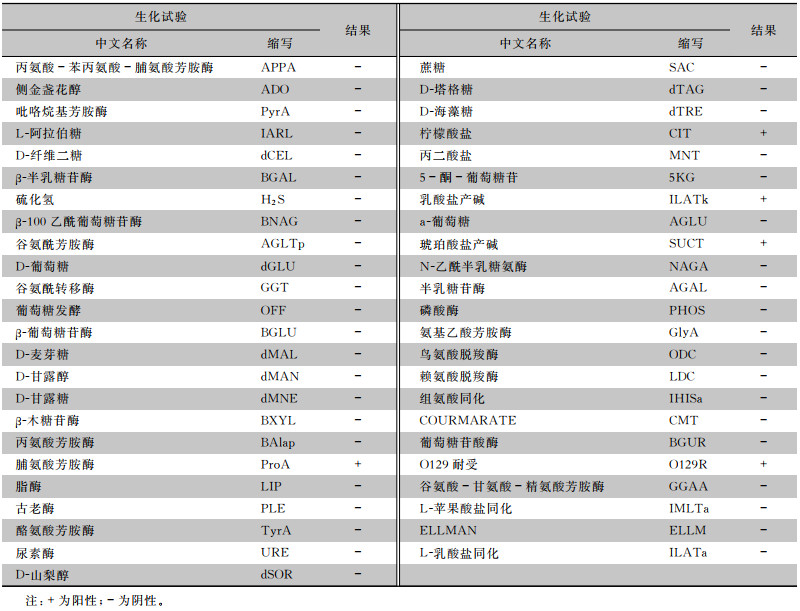
采用VITEK 2 Compact全自动细菌鉴定系统及其配套GN鉴定卡对细菌进行全面生化鉴定,见表 1。经VITEK 2 Compact AES高级专家系统进行比对,鉴定结果为鲍特菌属(置信度为97%)。
| 表 1 患者创面分泌物分离细菌VITEK 2 Compact生化试验鉴定结果 Table 1 VITEK 2 Compact biochemical identification result of bacteria from patient's wound secretion |
|
VITEK 2 Compact全自动细菌鉴定系统未能将此菌鉴定到种,进一步采用微生物质谱仪进行鉴定。经VITEK MS鉴定结果为创口鲍特菌(置信度为99.9%), 其在2 066、4 329、5 209、5 249、6 304、6 713 M/z处有特征峰谱,见图 3。
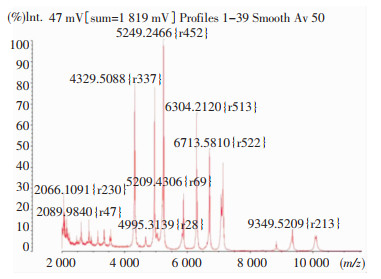 |
| 图 3 待检菌鉴定质谱图 Figure 3 Mass spectrum of isolated strain |
经琼脂糖凝胶电泳检测确证扩增成功,PCR扩增产物长度为1 500 bp。将扩增产物送测序,测序结果进行BLAST比对分析。比对发现其与创口鲍特菌的同源性为99.9%。见图 4。
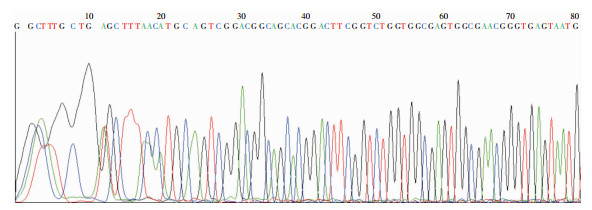 |
| 图 4 16S rRNA PCR扩增产物测序结果 Figure 4 Sequencing results of PCR-amplified products of 16S rRNA |
采用VITEK 2 Compact全自动细菌药敏系统及其配套GN09药敏卡进行药敏试验。根据CLSI 2020版药敏折点范围,结果显示创口鲍特菌对头孢唑林、头孢他啶、头孢吡肟、头孢曲松、庆大霉素、妥布霉素、左氧氟沙星以及复方磺胺甲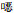
| 表 2 创口鲍特菌对常用抗菌药物的药敏结果 Table 2 Antimicrobial susceptibility testing results of Bordetella trematum to common antimicrobial agents |
|
鲍特菌属包含多个菌种,最常见的是百日咳鲍特菌和副百日咳鲍特菌。创口鲍特菌感染在临床上极为少见,主要见于创面感染,尤其是经久不愈的伤口或溃疡。查阅文献发现最近几年也有少量的文献报道。2020年Kukla等[4]报道在1例肺癌患者的呼吸道标本中分离鉴定出1株创口鲍特菌。2019年Castro等[5]报道在1例74岁女性患者的腿部溃疡和坏疽组织中分离培养出创口鲍特菌。此外,2016年Majewski等[3]在脓毒症患者血液中分离鉴定出创口鲍特菌,说明此菌不仅可以引起创面感染和呼吸道感染,而且还可进入血流,引起脓毒血症。由于创面感染通常比较复杂,混合感染较为常见,常混杂其他细菌,而且创口鲍特菌生长较为缓慢,很容易被其他细菌生长所掩盖,不易发现。本研究从1例手部创伤患者的创面分泌物中培养出创口鲍特菌,且培养物较纯,推测本例中分离到的创口鲍特菌可能具有一定的临床意义,提示在实验室分离到类似的少见菌,需要结合临床,以及流行病学和实验室检测情况进行综合分析。
根据细菌在血平板和麦康凯平板都生长的特点,初步判断是革兰阴性杆菌,革兰染色证实该结果。细菌菌落形态较为特别,与常见的革兰阴性杆菌有很大的区别,氧化酶试验结果显示为阳性。但也有文献报道氧化酶试验是阴性,其分析可能是检测方法不一样所致[6]。因此,此菌的氧化酶试验有待进一步确定,通过生化反应的差异鉴定细菌是目前的主要方法。明确该菌为革兰阴性杆菌后,研究人员立即采用梅里埃公司的革兰阴性菌鉴定卡对该菌进行系统生化鉴定,鉴定结果为鲍特菌属(置信度97%)。查阅具体生化反应,发现该菌只有5个生化项目为阳性反应,说明该菌生化反应并不活泼,有可能鉴定不准确,并且未能鉴定到具体的菌种水平,因此还需采用其他更好的检测方法进行鉴定。
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)是目前广泛用于微生物鉴定的一种快速、可靠的检测方法。Almagro-Molto等[7]研究发现,MALDI-TOF MS可用于创口鲍特菌的鉴定。通过质谱鉴定出该菌为创口鲍特菌,其置信度高达99.9%。为进一步确保鉴定结果准确无误,采取目前细菌鉴定准确度最高的分子生物学检测技术对该菌进行鉴定和分析[8]。对该致病菌进行16S rRNA的PCR扩增及产物测序,经同源性分析,BLAST比对结果显示其与创口鲍特菌的同源性为99.9%,确定鉴定结果是创口鲍特菌。在临床工作中,遇到类似具有重要临床意义的少见菌时,应充分利用目前的先进检测技术,采用多种方法进行鉴定,确保结果准确无误。
由于创口鲍特菌的感染主要发生在创面,临床医生通常会首先实施清创术,再配合使用抗菌药物,以最大程度地减少感染的发生。合理的选择抗菌药物对预防创口鲍特菌感染十分重要。根据相关研究文献报道,创口鲍特菌感染可常规使用环丙沙星和头孢菌素。但研究[9-10]报道,已出现对头孢他啶和环丙沙星耐药的菌株。目前,CLSI并无针对创口鲍特菌的药敏判断折点,通常是按照肠杆菌目细菌的折点进行药敏结果的判断。本例中药敏试验结果显示该菌对头孢菌素均为耐药,仅对亚胺培南、美罗培南和阿米卡星等少数药物敏感,表明创口鲍特菌的耐药性在逐渐发生变化。因此,临床实验室需要常规开展对该菌的药敏试验,加强对该菌的耐药性监测。
综上所述,目前国内尚未见创面创口鲍特菌感染病例报道,结合近年来国外多例报道,提示临床需重视创口鲍特菌感染,如果得不到及时控制,可能会引起脓毒血症,危及患者生命。在实验室鉴定方面,由于创口鲍特菌菌落形态特殊,且生化反应不活泼,临床实验室若分离到可疑菌株,应及时采用质谱鉴定或16S rRNA测序鉴定,以快速、准确获得结果,并进行药敏试验,指导临床用药。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies[J]. Clin Microbiol Rev, 2005, 18(2): 326-382. |
| [2] |
Vandamme P, Heyndrickx M, Vancanneyt M, et al. Bordetella trematum sp. nov., isolated from wounds and ear infections in humans, and reassessment of Alcaligenes denitrificans Rüger and Tan 1983[J]. Int J Syst Bacteriol, 1996, 46(4): 849-858. DOI:10.1099/00207713-46-4-849 |
| [3] |
Majewski LL, Nogi M, Bankowski MJ, et al. Bordetella trematum sepsis with shock in a diabetic patient with rapidly developing soft tissue infection[J]. Diagn Microbiol Infect Dis, 2016, 86(1): 112-114. DOI:10.1016/j.diagmicrobio.2016.05.019 |
| [4] |
Kukla R, Svarc M, Bolehovska R, et al. Isolation of Bordetella trematum from the respiratory tract of a patient with lung cancer: a case report[J]. Folia Microbiol (Praha), 2020, 65(3): 623-627. DOI:10.1007/s12223-020-00784-7 |
| [5] |
Castro TRY, Martins RCR, Dal Forno NLF, et al. Bordetella trematum infection: case report and review of previous cases[J]. BMC Infect Dis, 2019, 19(1): 485. DOI:10.1186/s12879-019-4046-8 |
| [6] |
Almuzara M, Barberis C, Traglia G, et al. Isolation of Bordetella species from unusual infection sites[J]. JMM Case Rep, 2015, 2(2): e000029. |
| [7] |
Almagro-Molto M, Eder W, Schubert S. Bordetella trematum in chronic ulcers: report on two cases and review of the literature[J]. Infection, 2015, 43(4): 489-494. DOI:10.1007/s15010-014-0717-y |
| [8] |
Benthien S, Schlüter C, Becker SL, et al. Detection of Bordetella trematum in a diabetic patient with a skin and soft tissue infection[J]. Int J Infect Dis, 2019, 89: 1-2. DOI:10.1016/j.ijid.2019.08.025 |
| [9] |
Saksena R, Manchanda V, Mittal M. Bordetella trematum bacteremia in an infant: a cause to look for[J]. Indian J Med Microbiol, 2015, 33(2): 305-307. DOI:10.4103/0255-0857.154891 |
| [10] |
Hernández-Porto M, Cuervo M, Miguel-Gómez MA, et al. Diabetic leg ulcer colonized by Bordetella trematum[J]. Rev Esp Quimioter, 2013, 26(1): 72-73. |



