2. 大连医科大学,辽宁 大连 11604
2. Dalian Medical University, Dalian 116044, China
2019年12月以来,新型冠状病毒(SARS-CoV-2) 引起的新型冠状病毒肺炎(COVID-19)在全球广泛传播[1]。SARS-CoV-2感染人数众多,传播速度快,存在大量的治愈者。COVID-19患者出院后的后续管理及长期随访,对于公众、各级医疗机构及社区均是一个重要的问题,也是防止出院后再传播的关键因素。
SARS-CoV-2是近20年来第三种在全球传播的导致人类严重疾病的冠状病毒,既往对严重急性呼吸综合征病毒(SARS-CoV)及中东呼吸综合征病毒(MERS-CoV)感染痊愈患者的呼吸功能随访研究发现,患者痊愈后还会出现不同程度的肺纤维化、肺间质改变[2-4],将持续影响呼吸系统的通气功能。既往对严重急性呼吸综合征(SARS)患者出院5年后进行肺功能测试,结果显示仍有患者存在弥漫性和局限性肺损伤[5]。80%以上的COVID-19患者在出院时有残余的肺损伤及未能完全吸收的胸部CT病灶,包括磨玻璃影、实变和纤维化样改变[6]。患COVID-19后6个月的随访研究[7]表明,约有四分之三的患者出院后仍有疲劳及睡眠障碍,住院期间病情危重的患者比病情较轻的患者有更高的肺弥散功能障碍和影像学异常的风险。因此,有必要对COVID-19患者患病后长期的呼吸系统状态及持续的时限,以及肺部病变改变的程度及呼吸功能恢复的进程,是否受患者基础状态如代谢、基础疾病、吸烟、运动等的影响,是否会最终形成永久的损伤还是会最终恢复通气功能等,进行长期的随访。
本研究对武汉雷神山医院部分病区320例COVID-19患者出院后进行长达24个月的密切随访,采取6分钟步行试验(6-minute walk test,6MWT)、改良医学研究会呼吸困难量表(mMRC)评分及胸部CT检查等评估COVID-19后呼吸系统功能的改变,以明确SARS-CoV-2感染对呼吸系统长期预后的影响,为COVID-19患者治疗提供依据。
1 对象与方法 1.1 研究对象选取2020年2月12日—3月31日武汉雷神山医院部分病区收治的COVID-19确诊患者,根据《新型冠状病毒肺炎诊疗方案(试行第七版)》[8](以下简称《诊疗方案》)的分型标准将患者分成普通型和重型两组。本研究方案的实施符合《赫尔辛基宣言》,并经大连医科大学附属第二医院伦理委员会批准,伦理批号为大医二院伦审2020第093号。
1.2 纳入与排除标准纳入标准:(1)按照《诊疗方案》,RT-PCR法检测咽拭子SARS-CoV-2核酸阳性;(2)患者出院时符合《诊疗方案》的统一出院标准;(3)研究对象自愿参与本研究,并签署知情同意书。排除标准:(1)依从性差、不能按要求配合随访者;(2)出现不能耐受的情况或因其他因素不能继续随访者;(3)随访时,胸部CT图像质量欠佳(IQS评分<3分[9])而影响随访评估者。
1.3 研究方法 1.3.1 一般临床资料的收集(1) 从电子病历中检索并收集患者一般资料[性别、年龄、病程、身高、体重、身体质量指数(BMI)等]。(2)基于雷神山医院病历进一步完善患者既往病史(包括既往明确诊断的基础疾病及用药情况)、家族史、新发相关伴发疾病史、吸烟状态及运动情况。(3)在患者出院后(2020年4—5月)补充完善基线mMRC评分[10],6MWT[11-12]。
1.3.2 随访方式及监测指标因雷神山医院于2020年4月15日关闭,本研究均由经过培训的医务人员以电话的方式进行随访,对每例患者或其亲属添加微信或邮箱,CT图像用微信或邮箱获得。嘱患者在出院后每6个月进行一次胸部CT检查,4次随访分别在出院后6个月(2020年10月,记为T1)、12个月(2021年4月,记为T2)、18个月(2021年10月,记为T3)、24个月(2022年4月,记为T4)进行,按照研究对象病历中记录的症状发作日期的顺序进行联系。如果错过再次预约,重新安排随访事宜。随访时询问患者一般状态、持续症状(如疲劳或乏力、咳嗽、咳痰、胸闷、气短等),并收集患者胸部CT复查结果,观察呼吸系统功能变化的影响因素及其变化情况。收集患者资料后由两名具有丰富经验的放射科医生独立阅片,评估CT图像质量及表现。每次随访均采用mMRC对患者进行评分,通过向患者及其家属发送视频的方式培训并指导患者进行6MWT,并告知如何避免急性呼吸困难等问题的发生以保证安全性。主要观察指标包括步行6分钟的距离及其占预测值的百分比。
1.4 相关定义及评价标准(1) 吸烟状态:一生主动吸烟≥100支,且基线调查30 d内正在吸烟,定义为当前吸烟;一生吸烟≥100支,但基线调查30 d前停止吸烟,定义为既往吸烟;一生吸烟 < 100支,或基线调查30 d内未处于被动吸烟环境中,定义为从不吸烟。(2)运动等级:于患者出院后采用PARS-3体育活动等级量表[13],采用运动强度、频率及时间对患者基线运动情况进行综合评估,具体如下:将运动强度按轻度、小强度、中强度、大强度、超强度5个等级计分,等级越高得分越高,计为1~5分;将运动频率分为5个等级(< 1次/月,计1分;2~3次/月,计2分;1~2次/周,计3分;3~5次/周,计4分;1次/d,计5分);每周运动时间按≤10、11~20、21~30、31~60、>60分钟,依次计为1~5分;总分=强度×频率×时间。总分≤19分为波动量,20~42分为中等运动量,≥43分为大运动量。(3)6MWT:参与本研究的医务人员根据2002年美国胸科学会(ATS)实用指南[11],录制6MWT相关教学视频,指导患者进行6MWT。每例随访患者在未吸氧情况下尽可能快地在平地上行走,并独立完成6MWT。记录每例患者6 min步行距离(以m表示)(6-minute walking distance, 6MWD),使用Enright及其同事描述的方法[12]计算患者的测量值与健康人在正常情况下的预测值之比,计算公式如下,男性预测值:6MWD=[7.57×身高(cm)-(5.02×年龄)-1.76×体重(kg)]-309 m,女性预测值:6MWD=[2.11×身高(cm)-2.29×体重(kg)]-(5.78×年龄)+667 m。
1.5 胸部CT扫描及分析研究对象胸部CT扫描复查的医院均为当地三级甲等医院,联系当地医院放射科,了解患者胸部CT复查的机器型号及参数。采用美国GE Optima、日立SCENA RIA 680、SOMATOM Definition AS以及SOMATOM Definition Flash 64排128层螺旋CT进行扫描,患者取仰卧位,于吸气后屏气扫描。扫描范围:肺尖至肺底。扫描参数:管电压100~120 kV,管电流130~200 mA,螺距0.51~1.37,层厚5 mm。由两名具有5~10年丰富工作经验的医生分别对CT图像质量进行审阅,首先采用IQS评分标准对患者CT图像质量进行评分,评分结果取两名医生评分的均值,≥3分的图像认为图像质量优良[9]。其次,两名医生对CT图像表现进行评估,当两者意见不统一时,由第三名具有20年以上工作经验的高年资医生进行再次审阅。评估并记录肺部影像密度及形态变化,包括磨玻璃影、实变影与肺纤维化及解剖分布和严重程度。基本特征如下(1)病变吸收:胸部CT病灶完全吸收;(2)病变类型:磨玻璃密度影(磨玻璃影定义为肺实质密度轻度增加,且病变区内支气管血管束仍可显示)、实变影(实变影被定义为肺实质密度增加,且病变区内血管影不可见)、纤维化样改变(存在牵引性支气管扩张、实质带和/或蜂窝影、网格影、不规则条索影、胸膜下线、小叶间隔增厚);(3)病灶分布和位置:周围型(病灶位于肺叶外周三分之一)、中央型(病灶位于肺叶中间三分之二)或弥漫型(同时涉及周围和中央区域)。同时记录其他异常的肺部病变,包括结节性病变、钙化灶、空洞、肿块影、胸腔积液等;为量化肺部异常的程度,用半定量分析法[2]对每个肺叶损伤范围进行评分,每个肺叶评分范围0~5分,总分25,具体评分标准如下:(1)0分,无病灶。(2)1分,0<病灶累及肺叶的范围≤5%。(3)2分,5%<病灶累及肺叶的范围≤25%。(4)3分,25%<病灶累及肺叶的范围≤50%。(5)4分,50%<病灶累及肺叶的范围≤75%。(6)5分,病灶累及肺叶的范围>75%。将5个肺叶的得分相加,记为总分。
1.6 统计学方法应用SPSS 26.0及Graphpad Prism 9软件进行统计分析,对计量资料均进行Shapiro-Wilk正态性检验,符合正态性分布的计量资料以x±s表示,不符合正态分布计量资料采用M(Q1,Q3)表示。正态分布计量资料进行两组间比较时采用独立样本t检验,多组间比较采用单因素方差分析;非正态分布计量资料两组间比较采用Mann-Whitney U检验,多组间采用Kruskal Wallis秩和检验,如有统计学意义,再用Bonferroni法或LSD-t法进行两两比较。计数资料使用频数及百分率表示,组间率比较采用卡方检验或Fisher's确切概率检验,多组率两两比较采用Bonferroni法。采用Kaplan-Meier法描绘生存曲线,用log-rank进行差异性检验。采用单因素Cox比例风险回归模型评估变量对预后价值,单因素Cox比例风险回归模型分析设置变量P < 0.1进入多因素Cox比例风险回归模型,多因素Cox比例风险回归模型分析影响患者预后的危险因素,并按体育活动等级、高血压、糖尿病及吸烟情况进行亚组内分层的Cox比例风险回归分析。
2 结果 2.1 基线临床特征本研究共纳入320例患者,普通型组179例(55.9%),重型组141例(44.1%)。普通型组男性81例(45.3%),女性98例(54.7%);重型组男性68例(48.2%),女性73例(51.8%),两组患者性别比较,差异无统计学意义(P>0.05)。重型组患者年龄、BMI高于普通型组(均P < 0.001)。普通型组患者中等运动量及以上等级的比例高于重型组患者(P < 0.001)。普通型组中合并高血压患者的比率低于重型组(18.4% VS 44.7%,P < 0.001);两组患者吸烟、合并糖尿病情况比较,差异无统计学意义(均P>0.05)。普通型组患者中位住院日数短于重型患者(P < 0.001)。普通型组患者红细胞计数(RBC)、血红蛋白(HB)、淋巴细胞绝对值(LMY)较重型组患者高,中性粒细胞绝对值(NEU)较重型组偏低(均P < 0.05);血白细胞计数(WBC)、血小板计数(PLT)、单核细胞绝对值(MO)、嗜碱性粒细胞绝对值(BAS)两组比较,差异均无统计学意义(均P < 0.05)。肝生化检查中,普通型组患者清蛋白(ALB)、清蛋白/球蛋白比值(A/G)高于重型组患者(P < 0.001);丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总蛋白(TP)两组患者比较,差异均无统计学意义(均P>0.05)。重型组患者降钙素原(PCT)、C反应蛋白(CRP)、血沉(ESR)三项炎症指标均高于普通型组患者(均P < 0.001)。见表 1。
| 表 1 两组COVID-19患者的基线特征 Table 1 Baseline characteristics of two groups of COVID-19 patients |
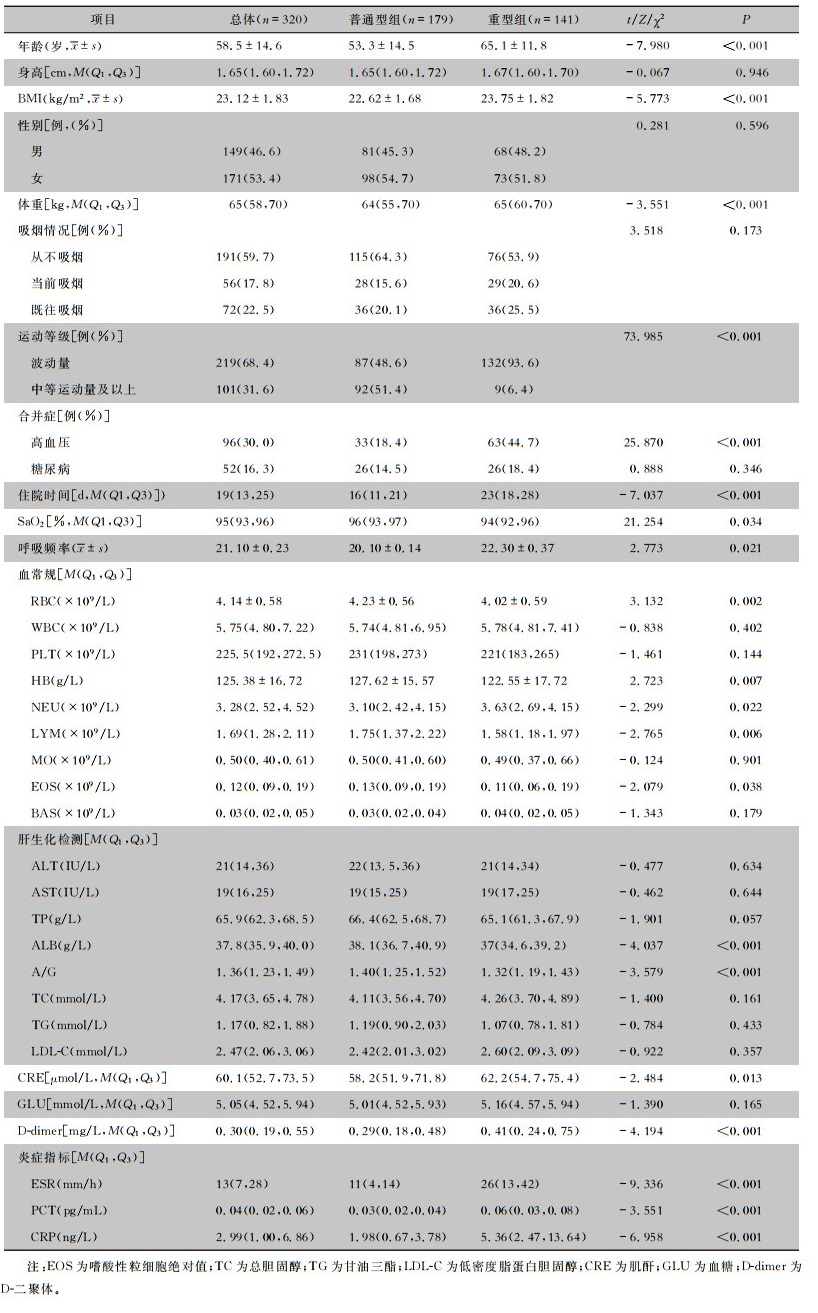
|
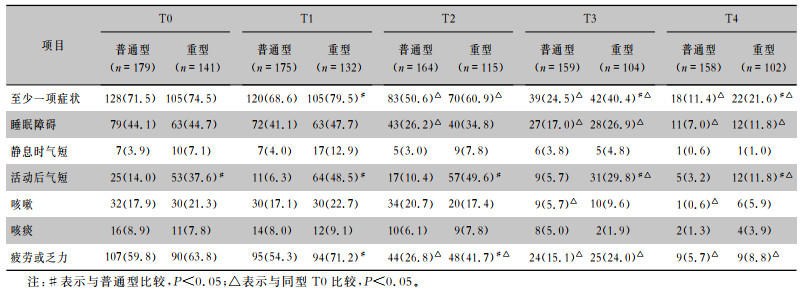
纳入患者流程图见图 1。在出院6、18、24个月时,普通型组患者存在至少1项持续症状的患者比例均比重型组低(均P<0.05);疲劳或乏力为主要临床症状,在出院6、12个月时,普通型组患者疲劳或乏力的比例均低于重型组患者(均P<0.05)。两组患者存在至少1项持续症状的比例在出院后12个月下降;普通型组患者中疲劳或乏力症状、睡眠障碍于出院后12个月好转(均P < 0.05),咳嗽患者的比例于出院后18个月下降(P < 0.05);重型组患者疲劳或乏力比例于出院后12个月下降(P < 0.05),睡眠障碍及活动后气短患者的比例于出院后18个月下降(均P < 0.05)。见表 2。
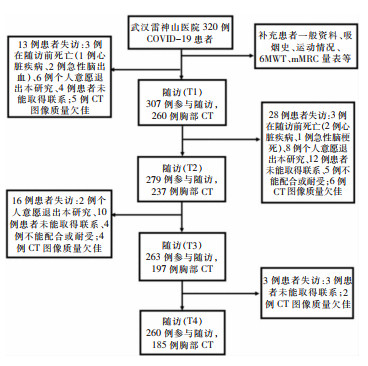 |
| 图 1 320例COVID-19患者随访流程图 Figure 1 Flow chart of follow up of 320 COVID-19 patients |
| 表 2 两组COVID-19患者持续症状发生率的基线及随访情况[例(%)] Table 2 Baseline and follow-up conditions of the incidence of persistent symptoms of two groups of COVID-19 patients (No. of cases[%]) |
|
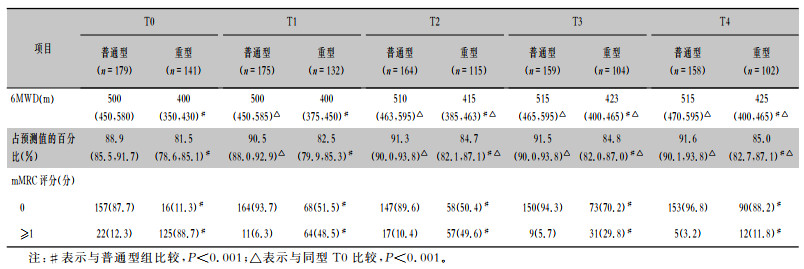
患者在出院及出院后6、12、18、24个月时,分别有45.9%(147/320)、24.4%(75/307)、26.5%(74/279)、15.2%(40/263)、6.5%(17/260)的患者mMRC评分≥1,重型组患者在5个时间点mMRC评分≥1分的比例均高于普通型组患者(均P < 0.001)。见表 3、图 2。
| 表 3 COVID-19患者活动耐量基线及随访结果 Table 3 Baseline and follow-up results of activity tolerance of two groups of COVID-19 patients |
|
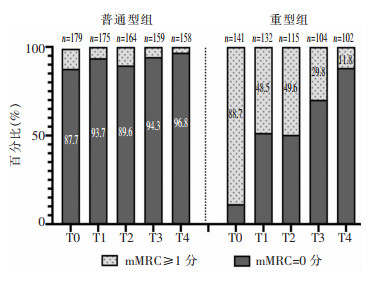 |
| 图 2 两组COVID-19患者基线及随访期mMRC评分结果 Figure 2 mMRC score results at baseline and follow-up period of two groups of COVID-19 patients |
在5个时间点普通型组患者6 min步行距离及其占预测值的百分比均高于重型组(均P < 0.001)。将5个时间点的6MWD两两比较,所有患者出院后12个月较出院时提高(均P < 0.001)。6MWD占预测值的百分比,出院后6个月较出院时提高(P=0.007),出院后24个月较出院后6个月提高(P < 0.001)。普通型患者6MWD及其占预测值的百分比,在出院后6个月较基线提高(均P < 0.001);重型患者6MWD及其占预测值的百分比,在出院后12个月较基线提高(均P < 0.001)。见表 3、图 3。
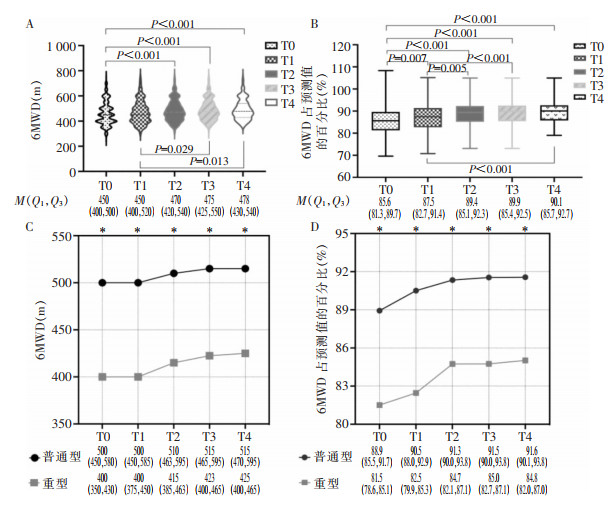 |
| 注:A为总体6MWD;B为总体6MWD占预测值的百分比;C为普通型组及重型组6MWD;D为普通型组及重型组6MWD占预测值的百分比;*表示对应时间点两组间比较,P < 0.05。 图 3 两组COVID-19患者6MWD基线及随访结果 Figure 3 Baseline and follow-up results of 6MWD of two groups of COVID-19 patients |
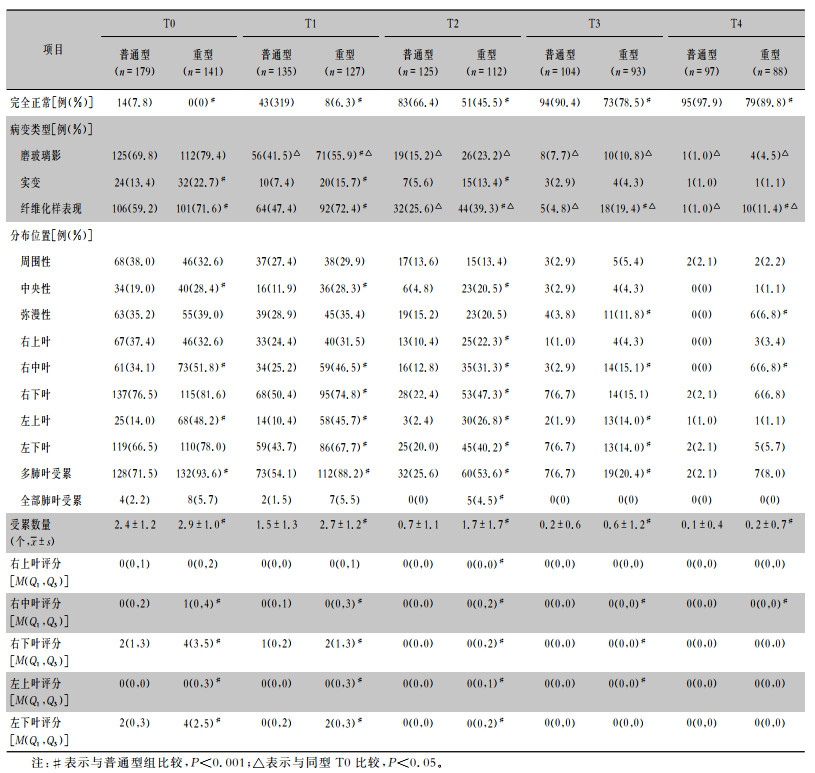
基线(T0)、第一次随访(T1)、第二次随访(T2)、第三次随访(T3)、第四次随访(T4)的结果表明,普通型组患者胸部CT完全正常的比例均高于重型组(均P < 0.05),见表 4,图 4(A)。普通型组及重型组患者5个不同时间点,胸部CT完全正常的比例比较,差异均有统计学意义(均P < 0.001)。在出院时,胸部CT最常见的改变为磨玻璃影(237/320,74.1%)及纤维化样改变(207/320,64.7%)。普通型组及重型组患者,磨玻璃影在出院后6个月时较出院时明显吸收,纤维化样改变均在出院后12个月较出院时明显吸收(均P < 0.05);在随访5个时间点,重型组患者胸部CT累积肺叶个数及胸部CT半定量评分均高于普通型组(均P < 0.001)。见图 4(B、C)。
| 表 4 COVID-19患者胸部CT检查基线及随访结果 Table 4 Baseline and follow-up results of chest CT examination of COVID-19 patients |
|
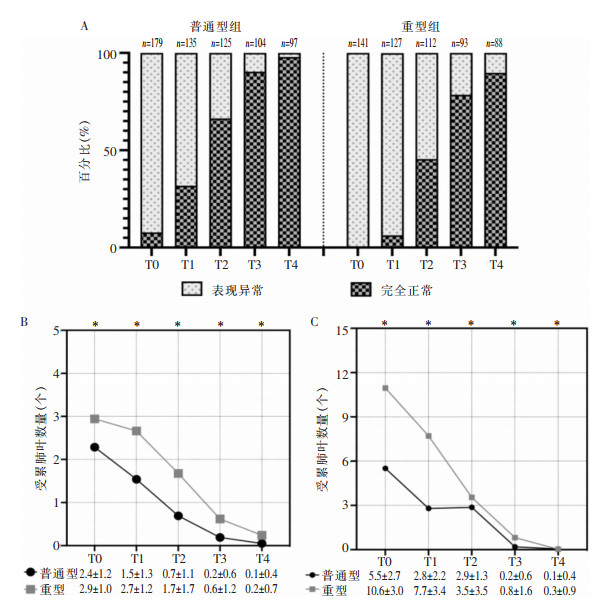 |
| 注:A为胸部CT表现正常的百分比;B为胸部CT受累肺叶数量;C为胸部CT半定量评分;*对应时间点两组比较,P < 0.05。 图 4 两组COVID-19患者胸部CT检查基线及随访结果 Figure 4 Baseline and follow-up results of chest CT examination of two groups of COVID-19 patients |
Kaplan-Meier分析结果显示,普通型组患者出院后6、12、18、24个月时,胸部CT累积吸收率分别为31.9%(43/135)、66.4%(83/125)、90.4%(94/104)、97.9%(95/97);而重型组患者出院后6、12、18、24个月时,胸部CT累积吸收率分别为6.3%(8/127)、45.5%(51/112)、78.5% (73/93)、89.8%(79/88);经log-rank检验,两组胸部CT累积吸收率差异有统计学意义(χlog-rank2= 40.82,P < 0.001),见图 5。
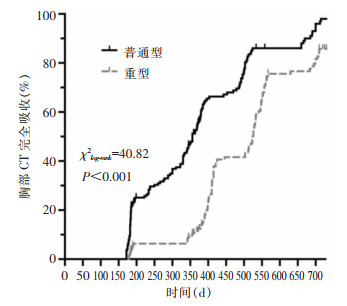 |
| 图 5 Kaplan-Meier生存曲线 Figure 5 Kaplan Meier survival curve |
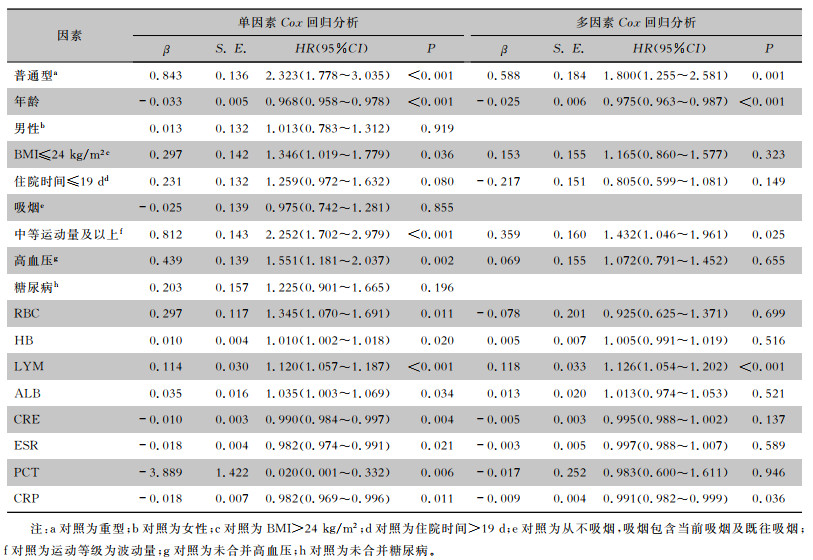
以胸部CT完全吸收为因变量,对基线疾病严重程度、年龄、性别、BMI、住院日数、吸烟状态、运动等级、高血压等19个变量,逐一进行单因素Cox回归分析,其中疾病严重程度、年龄、运动等级、高血压等16个变量(均P < 0.1);为排除各因素之间的相互影响,将上述16个变量作为预测变量,以胸部CT完全吸收作为结局变量,构建多因素Cox回归分析模型,分析影响COVID-19胸部CT完全吸收的因素。结果显示:年龄较小(HR=0.975,95%CI:0.963~0.987,P < 0.001)、疾病严重程度较轻(普通型/重型组,HR=1.800,95%CI:1.255~2.581,P=0.001)、运动等级较高(中等活动量/波动量,HR=1.432,95%CI:1.046~1.961,P=0.025)、基线LYM较高(HR=1.126,95%CI:1.054~1.202,P < 0.001)、基线CRP水平较低(HR=0.991,95%CI:0.982~0.999,P=0.036)是COVID-19患者胸部CT异常表现完全吸收的独立保护因素。见表 5。
| 表 5 胸部CT异常表现完全吸收的单因素及多因素Cox回归分析 Table 5 Univariate and multivariate Cox regression analysis on complete absorption of abnormal chest CT findings |
|
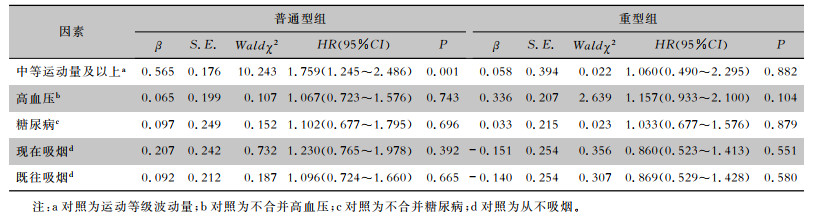
对两组患者按运动等级、高血压、糖尿病及吸烟状态进行组内分层分析,以胸部CT完全吸收为因变量,进行Cox回归分析,结果显示:普通型组中,按运动等级分层(中等运动量及以上/波动量)(HR=1.759,95%CI:1.245~ 2.486,P=0.001),表明运动等级越高是普通型组患者胸部CT完全吸收的独立保护因素。重型组分层,差异均无统计学意义(均P>0.05)。见表 6。
| 表 6 按体育活动等级、高血压、糖尿病及吸烟情况组内分层的Cox回归分析 Table 6 Cox regression analysis stratified by physical activity level, hypertension, diabetes and smoking |
|
COVID-19患者伴有肺功能下降、肺间质改变肺纤维化等呼吸系统远期并发症,但SARS-CoV-2引起的呼吸系统功能损伤的严重程度,以及疾病转归尚不清楚。目前,关于COVID-19患者呼吸系统的长期随访情况较少,且预后的随访都存在病例数及地域性的差异。本研究旨在总结雷神山医院COVID-19康复患者出院后24个月的呼吸系统随访情况,更好地更长期地揭示COVID-19患者的呼吸系统远期预后,为今后疫情常态化管理及预后管理提供临床参考。
本研究发现,武汉雷神山医院COVID-19患者在出院后6个月最常见的症状为疲劳或乏力、睡眠障碍及活动后气短,少部分患者也表现出较为明显的静息时气短,在重型组患者中较多见;出院后12个月随访时,仍有近一半的患者疲劳或乏力及睡眠障碍症状仍持续存在,与相关研究结果一致[14-15]。出院后24个月第4次随访时睡眠障碍及疲劳或乏力仍稳居持续症状的前两名,但比例较前下降(P<0.05)。据报道,疲劳是严重急性呼吸综合征(SARS)患者最常见的症状,可能会持续4年之久[16]。本研究随访截止时间为24个月,仅有8.8%的重型患者存在慢性疲劳问题,其原因可能与COVID-19所引起的脏器功能损伤不及SARS广泛,且严重程度较低有关[17]。COVID-19引起慢性疲劳的病因和发病机制尚不清楚,但基于先前SARS的证据,肺弥散功能障碍和一些肺外原因,包括在初始阶段的病毒诱导性肌炎、细胞因子风暴、肌肉消瘦和去适应、皮质类固醇肌病,或这些因素的组合,都可能导致该情况[3-4, 18]。本研究纳入的武汉雷神山医院患者,在急性期及住院期间则较少使用类固醇激素。本研究中睡眠障碍为持续存在的第二大临床症状,COVID-19患者存在的睡眠障碍可能与心理健康问题或创伤后应激相关,一项对中国社区老年人心理状态研究[19]表明,COVID-19流行期间,老年人焦虑症状发生率较疫情前增长了约1倍。此外,出院6个月时约五分之一的患者咳嗽、咳痰也持续存在,出院后18个月明显减轻,出院后24个月基本消失。
mMRC为改良呼吸困难量表,用于记录体力活动时的呼吸困难水平,因其简便易行性被广泛应用于慢性阻塞性肺疾病(COPD)、哮喘等呼吸系统疾病临床研究,对康复期患者而言,mMRC评分可用于自评呼吸困难导致的运动限制程度[20],更有利于基层医疗机构使用[21]。本研究队列中,在出院以及6、12、18、24个月时,分别有45.9%、24.4%、26.5%、15.2%、6.5%的患者mMRC评分≥1分。本研究的百分比柱状图也可直观地展示基线及4次随访时间点,重型患者mMRC评分≥1分所占的比例均大于普通型(P<0.05),且每次随访mMRC评分≥1分的比例下降。Wu等[22]研究表明,在6个月30%的患者mMRC评分≥1分,在12个月5%的患者存在与运动相关的呼吸困难。6MWD为大多数随访研究测试活动耐量的重要方法。本研究总体人群中,出院后6个月较出院时无明显提高,出院后12个月较基线出院时有明显提高,存在统计学差异,提示COVID-19患者的活动耐量改善需要1年甚至更长的时间。在出院时和四次随访对应的时间点,在行6MWD时,普通型均优于重型患者,普通型患者于出院后6个月得到明显改善,而重型患者于出院后12个月得到明显改善,可能与部分重型患者年龄较大、BMI较高有关。
本研究进行了生存分析,以胸部CT完全吸收为终点事件,出院时有14例患者表现为胸部CT完全正常,随着时间的延长患者胸部CT异常表现完全吸收的比例增加。本研究绘制的生存曲线可直观展示普通型患者在出院后6个月后吸收的比例明显增高,在出院后12个月随访时,重型患者胸部CT才表现出较大幅度的吸收,且普通型患者的胸部CT累积吸收率高于重型组患者。本研究发现出院1年后有43.5%的患者胸部CT异常未完全吸收。文献[23]报道,COVID-19患者出院1年时有24%的患者尚未完全吸收好转,可能与患者基础疾病和免疫状态有关。在出院后24个月的随访中,仍有5.9%的患者胸部CT仍存在残留的纤维化、磨玻璃影或实变,重型患者占绝大多数。其原因可能为呼吸道病毒感染会在恢复期诱发成纤维细胞活化,导致肺部间质性改变。经过24个月的随访,虽然仍有少部分患者遗留间质性病变及纤维化样改变,本研究采用胸部CT半定量评分法,可见患者胸部CT受累肺叶数量、各个肺叶的受累范围及总评分均比出院时降低(P<0.05)。COVID-19患者肺部病变是否能够完全吸收,仍需更长时间的随访研究证实。本研究经Cox单因素及多因素回归分析均显示年龄、体育活动等级、疾病严重程度、基线LYM、基线CRP水平是影响患者胸部CT完全吸收的独立影响因素,其中年龄较大与胸部CT的完全吸收呈负相关,与文献[24]报道结果一致,免疫系统老化是老年人容易受SARS-CoV-2感染的主要原因,生理功能随着年龄的增长而减弱,抵抗疾病的能力下降。COVID-19患者常有淋巴细胞计数下降,且重症患者高于非重症患者[25],可能是由于SARS-CoV-2对淋巴细胞的直接或间接杀伤或对其生成的抑制。研究[26]表明,基线T淋巴细胞水平可作为预测COVID-19患者严重程度和预后的指标。淋巴细胞计数及T淋巴细胞亚群计数明显降低,与肺部受损的程度具有一定的相关性。另外,细胞因子炎症风暴是COVID-19病情进展恶化的重要原因,临床上常通过检测血清CRP判断炎症反应程度,CRP在各种炎症、感染、组织损伤等疾病中迅速升高,且升高程度与炎症、组织损伤的程度呈正相关。本研究结果也显示,基线LYM水平较高、CRP水平较低与胸部CT的完全吸收呈正相关。本研究发现,总体人群基线运动等级大多数集中于波动量、中等运动量,且运动等级越高发生重型感染的概率越低,Cox回归分析中也得出运动等级较高是胸部CT的完全吸收的独立保护因素。此外,一项对40例COVID-19患者的临床研究[27]表明,早期肺康复训练可能有助于普通型COVID-19患者临床症状改善及胸部CT影像吸收。本研究纳入的武汉雷神山医院320例COVID-19患者,在其出院后对患者既往运动等级强度进行补充调查,提示基线运动等级较高,对康复期肺病灶的吸收较有益。既往文献[28]表明,合并高血压或糖尿病等可能会影响COVID-19患者预后,为探究肺部病变及变化程度及呼吸功能恢复的进程,是否受患者基础疾病、吸烟、运动等影响,本研究经多因素Cox回归分析并按高血压、糖尿病、运动等级、吸烟状态进行组内分层,仅获得普通型组中运动等级高是胸部CT完全吸收的独立保护因素,可能与本研究纳入的合并高血压及糖尿病的患者较少,合并症程度较轻有关。
本研究在一定程度上揭示了COVID-19患者的预后进展情况,仍存在一定的局限性。本研究是一项单中心研究,纳入的研究对象仅代表雷神山医院一部分病区,不能代表整个雷神山医院,限制了这一队列的代表性。此外,本研究仅纳入普通型及重型的患者,缺乏轻型和危重型的患者,限制了研究结果在此特定人群中的普遍性,未来期望能有更多的大样本、多中心研究揭示不同严重程度COVID-19患者的长期预后。
综上所述,武汉雷神山医院320例患者呼吸系统功能,包括症状、活动耐力及胸部CT三个方面的随访研究表明,普通型患者于出院6个月身体活动耐量得到明显改善,12个月症状明显改善,18个月胸部CT病灶基本完全吸收。重型患者于出院后12个月活动耐量及症状得到明显改善,18个月少数重型患者胸部CT仍存在吸收延迟和纤维化样改变。大多数COVID-19患者在24个月的随访中呼吸系统功能恢复良好,普通型组比重型组恢复得更快。年龄较小、运动等级较高、基线淋巴细胞水平较高、CRP水平较低、疾病严重程度较低是患者胸部CT病灶完全吸收的独立保护因素。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Li Q, Guan XH, Wu P, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia[J]. N Engl J Med, 2020, 382(13): 1199-1207. DOI:10.1056/NEJMoa2001316 |
| [2] |
Chang YC, Yu CJ, Chang SC, et al. Pulmonary sequelae in convalescent patients after severe acute respiratory syndrome: evaluation with thin-section CT[J]. Radiology, 2005, 236(3): 1067-1075. DOI:10.1148/radiol.2363040958 |
| [3] |
Hui DS, Joynt GM, Wong KT, et al. Impact of severe acute respiratory syndrome (SARS) on pulmonary function, functional capacity and quality of life in a cohort of survivors[J]. Thorax, 2005, 60(5): 401-409. DOI:10.1136/thx.2004.030205 |
| [4] |
Hui DS, Wong KT, Ko FW, et al. The 1-year impact of severe acute respiratory syndrome on pulmonary function, exercise capacity, and quality of life in a cohort of survivors[J]. Chest, 2005, 128(4): 2247-2261. DOI:10.1378/chest.128.4.2247 |
| [5] |
Ngai JC, Ko FW, Ng SS, et al. The long-term impact of severe acute respiratory syndrome on pulmonary function, exercise capacity and health status[J]. Respirology, 2010, 15(3): 543-550. DOI:10.1111/j.1440-1843.2010.01720.x |
| [6] |
Wang YH, Dong CJ, Hu Y, et al. Temporal changes of CT findings in 90 patients with COVID-19 pneumonia: a longitudinal study[J]. Radiology, 2020, 296(2): E55-E64. DOI:10.1148/radiol.2020200843 |
| [7] |
Huang CL, Huang LX, Wang YM, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study[J]. Lancet, 2021, 397(10270): 220-232. DOI:10.1016/S0140-6736(20)32656-8 |
| [8] |
国家卫生健康委办公厅. 新型冠状病毒肺炎诊疗方案(试行第七版)[J]. 传染病信息, 2020, 33(1): 1-6, 26. General Office of National Health Commission. Treatment protocol for novel coronavirus pneumonia (trial version 7)[J]. Infectious Disease Information, 2020, 33(1): 1-6, 26. DOI:10.3969/j.issn.1007-8134.2020.01.001 |
| [9] |
蒋超, 单飞, 郭莉. MDCT不同螺距选择在新型冠状病毒肺炎患者胸部CT检查中的应用[J]. 临床肺科杂志, 2020, 25(12): 1783-1786. Jiang C, Shan F, Guo L. Application of different MDCT pitch selection for CT examination of novel coronavirus pneumonia patients[J]. Journal of Clinical Pulmonary Medicine, 2020, 25(12): 1783-1786. DOI:10.3969/j.issn.1009-6663.2020.12.001 |
| [10] |
Mahler DA, Wells CK. Evaluation of clinical methods for ra-ting dyspnea[J]. Chest, 1988, 93(3): 580-586. DOI:10.1378/chest.93.3.580 |
| [11] |
ATS Committee on Proficiency Standards for Clinical Pulmonary Function Laboratories. ATS statement: guidelines for the six-minute walk test[J]. Am J Respir Crit Care Med, 2002, 166(1): 111-117. DOI:10.1164/ajrccm.166.1.at1102 |
| [12] |
Enright PL, Sherrill DL. Reference equations for the six-minute walk in healthy adults[J]. Am J Respir Crit Care Med, 1998, 158(5 Pt 1): 1384-1387. |
| [13] |
梁德清. 高校学生应激水平及其与体育锻炼的关系[J]. 中国心理卫生杂志, 1994, 8(1): 5-6. Liang DQ. Stress levels of college students and their relationship with physical exercise[J]. Chinese Mental Health Journal, 1994, 8(1): 5-6. DOI:10.3321/j.issn:1000-6729.1994.01.020 |
| [14] |
Huang LX, Yao Q, Gu XY, et al. 1-year outcomes in hospital survivors with COVID-19: a longitudinal cohort study[J]. Lancet, 2021, 398(10302): 747-758. DOI:10.1016/S0140-6736(21)01755-4 |
| [15] |
Betschart M, Rezek S, Unger I, et al. One year follow-up of physical performance and quality of life in patients surviving COVID-19: a prospective cohort study[J]. Swiss Med Wkly, 2021, 151: w30072. |
| [16] |
Lam MHB, Wing YK, Yu MWM, et al. Mental morbidities and chronic fatigue in severe acute respiratory syndrome survivors: long-term follow-up[J]. Arch Intern Med, 2009, 169(22): 2142-2147. DOI:10.1001/archinternmed.2009.384 |
| [17] |
Wiersinga WJ, Rhodes A, Cheng AC, et al. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): a review[J]. JAMA, 2020, 324(8): 782-793. DOI:10.1001/jama.2020.12839 |
| [18] |
Moldofsky H, Patcai J. Chronic widespread musculoskeletal pain, fatigue, depression and disordered sleep in chronic post-SARS syndrome; a case-controlled study[J]. BMC Neurol, 2011, 11: 37. DOI:10.1186/1471-2377-11-37 |
| [19] |
王志会, 齐士格, 张晗, 等. 新型冠状病毒肺炎对社区老年人焦虑症状的影响[J]. 中华医学杂志, 2020, 100(40): 3179-3185. Wang ZH, Qi SG, Zhang H, et al. Impact of the COVID-19 epidemic on anxiety among the elderly in community[J]. National Medical Journal of China, 2020, 100(40): 3179-3185. DOI:10.3760/cma.j.cn112137-20200720-02167 |
| [20] |
Munari AB, Gulart AA, Araújo J, et al. Modified medical research council and COPD assessment test cutoff points[J]. Respir Care, 2021, 66(12): 1876-1884. DOI:10.4187/respcare.08889 |
| [21] |
李海燕, 杨汀, 姚反修, 等. 社区慢性阻塞性肺疾病患者运动能力及预后评估方法研究[J]. 中国全科医学, 2021, 24(10): 1294-1297. Li HY, Yang T, Yao FX, et al. Exercise capacity and prognosis evaluation methods for patients with chronic obstructive pulmonary disease in the community[J]. Chinese General Practice, 2021, 24(10): 1294-1297. DOI:10.12114/j.issn.1007-9572.2021.00.031 |
| [22] |
Wu XJ, Liu XF, Zhou YL, et al. 3-month, 6-month, 9-month, and 12-month respiratory outcomes in patients follo-wing COVID-19-related hospitalisation: a prospective study[J]. Lancet Respir Med, 2021, 9(7): 747-754. DOI:10.1016/S2213-2600(21)00174-0 |
| [23] |
Sami R, Soltaninejad F, Amra B, et al. A one-year hospital-based prospective COVID-19 open-cohort in the Eastern Mediterranean region: the Khorshid COVID cohort (KCC) study[J]. PLoS One, 2020, 15(11): e0241537. DOI:10.1371/journal.pone.0241537 |
| [24] |
Yu MH, Liu Y, Xu D, et al. Prediction of the development of pulmonary fibrosis using serial thin-section CT and clinical features in patients discharged after treatment for COVID-19 pneumonia[J]. Korean J Radiol, 2020, 21(6): 746-755. DOI:10.3348/kjr.2020.0215 |
| [25] |
Jiang F, Deng LH, Zhang LQ, et al. Review of the clinical characteristics of coronavirus disease 2019 (COVID-19)[J]. J Gen Intern Med, 2020, 35(5): 1545-1549. DOI:10.1007/s11606-020-05762-w |
| [26] |
He RY, Lu ZL, Zhang L, et al. The clinical course and its correlated immune status in COVID-19 pneumonia[J]. J Clin Virol, 2020, 127: 104361. DOI:10.1016/j.jcv.2020.104361 |
| [27] |
赵京梅, 王伯丽, 王永红, 等. 早期肺康复训练对普通型新型冠状病毒肺炎患者临床症状及胸部CT影像变化相关性临床研究[J]. 国际呼吸杂志, 2021, 41(2): 121-126. Zhao JM, Wang BL, Wang YH, et al. Clinical study of correlation between clinical symstoms and changes of chest CT ima-ge applying pulmonary rehabilitaion training at early stage in the COVID-19 patients[J]. International Journal of Respiration, 2021, 41(2): 121-126. DOI:10.3760/cma.j.cn131368-20200425-00335 |
| [28] |
Sinha M, Zabini D, Guntur D, et al. Chloride channels in the lung: challenges and perspectives for viral infections, pulmonary arterial hypertension, and cystic fibrosis[J]. Pharmacol Ther, 2022, 237: 108249. DOI:10.1016/j.pharmthera.2022.108249 |



