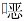 唑、氟康唑治疗好转。本文就该例惠普尔养障体肺炎病例进行报告及文献复习,旨在提高临床对惠普尔养障体感染的认识,做到早诊断、早治疗。
唑、氟康唑治疗好转。本文就该例惠普尔养障体肺炎病例进行报告及文献复习,旨在提高临床对惠普尔养障体感染的认识,做到早诊断、早治疗。惠普尔养障体是一种革兰染色阳性杆菌,属于条件致病菌,在免疫缺陷患者中可以引起一种少见病—惠普尔氏病,肠道是其主要的靶器官,肺部受累罕见。本文报告1例长期应用糖皮质激素的重症肺炎患者,经肺泡灌洗液宏基因测序证实为惠普尔养障体并热带念珠菌混合感染。
1 临床资料 1.1 病史患者女性,69岁,以“发热、咳嗽伴呼吸困难8 d,加重4 d”为主诉于2021年10月28日入院。患者于入院前8 d “感冒”后出现发热,体温37.8℃,伴咳嗽,无咳痰,伴呼吸困难,活动后明显,活动耐力明显下降,无畏寒、寒战,无咳嗽、咳痰,无胸痛、咯血等。自服感冒灵、布洛芬等药物治疗,效果欠佳,症状逐渐加重,10月24日至当地医院行胸部CT提示“双肺炎症改变”,遂至淄博市中心医院急诊科,给予莫西沙星、哌拉西林/他唑巴坦、痰热清等治疗,仍反复发热,体温最高38.4℃,为进一步诊治以“重症肺炎”收入该院呼吸科。发病以来,进食量少,睡眠质量差,大小便正常,体重无明显变化。
既往史:肾病综合征病史30余年,规律口服糖皮质激素治疗,现口服甲泼尼龙(20 mg,qod)。1977年行剖宫产术,2002年行双眼白内障手术,2006年行甲状腺瘤切除术,否认高血压、糖尿病、冠心病等病史;否认结核病、乙型病毒性肝炎等传染病史。
1.2 入院查体及辅助检查体温37.5℃,脉搏90次/min,呼吸23次/min,血压157/84 mmHg。满月脸,神志清,精神差。口腔未见白苔,双肺呼吸音粗,双侧肺底闻及广泛湿性啰音。心腹查体未见明显异常。双侧下肢无水肿。
2021年10月24日急诊科送检实验室检查结果:pH 7.42,PaO2 70 mmHg,PaCO2 37 mmHg,乳酸3.1 mmol/L(鼻导管吸氧3 L/min),血常规白细胞10.5×109/L,中性粒细胞百分比72%,降钙素原0.078 ng/mL,血糖10.5 mmol/L,前脑利钠肽(pro-BNP)136 pg/mL,乳酸脱氢酶387 U/L。肝肾功能、电解质基本正常。10月24日当地医院胸部CT提示:①双肺弥漫性间质性改变,以双下肺和外周为主;②纵膈淋巴结轻度肿大;③主动脉及冠状动脉硬化。
入院诊断:①间质性肺炎;②低氧血症;③肾病综合征。
1.3 治疗经过入院后予以心电监护、高流量气道湿化治疗,予甲泼尼龙(40 mg/日,静脉滴注)平喘抗炎,护胃,纠正电解质紊乱等对症支持治疗,经验性给予复方磺胺甲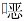
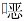
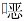
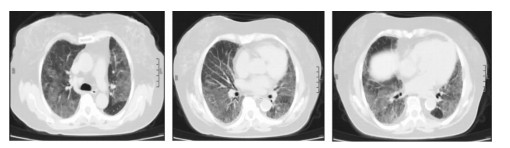 |
| 图 1 患者入院时胸部CT:双肺弥漫性磨玻璃影 Figure 1 Chest CT findings of patient at admission: diffuse ground glass shadow of bilateral lungs |
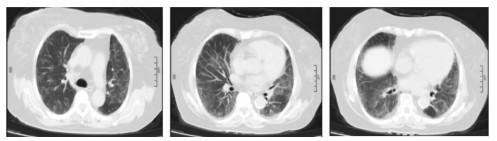 |
| 图 2 患者治疗10 d后胸部CT:双肺磨玻璃影较前明显吸收 Figure 2 Chest CT findings of patient after 10 days of treatment: ground-glass shadows of bilateral lungs were significantly absorbed |
出院诊断:①惠普尔养障体、热带念珠菌重症肺炎;②Ⅰ型呼吸衰竭;③肾病综合征;④电解质紊乱(低钠低氯血症)。
2 讨论惠普尔养障体是一种革兰阳性杆菌, 于1997年首次培养出[1]。研究[2]证实惠普尔养障体需要特殊的培养基,生长缓慢,平均培养时间为30 d。惠普尔氏病的流行病学数据获取较为困难,发病率约为1/100万,每年发病率为1/1 000万~6/1 000万[3]。由于临床医务人员对其认识的提高以及诊断工具的改进,近年来病例报告的数量不断增加,但国内仅有散在的病例报道。
惠普尔养障体病典型临床表现主要在胃肠道(腹痛、吸收不良腹泻和体重下降)或肌肉骨骼系统(以小关节游走性疼痛为主的血清阴性关节病),低热、贫血和淋巴结病是不常见的症状,少见可累及神经系统、心脏和肺部[4]。国外报道的呼吸道感染率仅为13%~14%[5],惠普尔养障体肺炎,临床表现常见有胸膜炎性胸痛、慢性咳嗽和呼吸困难[6],胸片可显示胸腔积液或肺浸润[7]。Zhang等[8]总结上海交通大学附属第六人民医院20例惠普尔养障体肺炎最常见的胸部影像学表现为结节(50.0%),可单发或弥漫性、磨玻璃样或实性,包括小结节或数厘米大结节。其次是间质改变(25%)和斑片状浸润(25%),4例(20.0%)为肺门、纵隔淋巴结肿大。胸膜增厚/黏连4例(20.0%),胸腔积液2例(10.0%),1例(5.0%) 为空洞。本例患者胸部CT主要表现为双肺弥漫性磨玻璃影,伴纵膈淋巴结轻度肿大,少许胸腔积液,无明显结节影及空洞影。
经典惠普尔氏病是由惠普尔养障体引起的一种慢性多系统感染性疾病。肠道是惠普尔养障体最常见的定植部位。一旦进入肠道黏膜,细菌就会被巨噬细胞吞噬,然后在巨噬细胞中进行复制[9]。该病原体的传播可能与粪-口途径有关[10]。其明确诊断通常是通过对小肠黏膜活检的组织病理学检查, 特征是肠黏膜固有层中含有致密PAS阳性颗粒的泡沫状巨噬细胞的大量浸润[11]。聚合酶链反应(PCR)的基因分析提高了常规检测方法的敏感性和特异性。宏基因测序(mNGS)是近年来发展起来的一项新技术,在诊断少见细菌、病毒及混合感染等方面有显著的优势。本例患者即是通过mNGS迅速明确了肺部感染的病原体。
惠普尔养障体病推荐的标准治疗是头孢曲松(2 g,qd)或美罗培南(1 g,tid)静脉滴注,口服甲氧苄啶/磺胺甲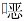
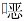
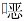
惠普尔养障体感染患者可以存在肺部混合感染,Li等[16]总结了吉林大学第二医院2例无胃肠道症状、免疫缺陷疾病史或使用免疫抑制剂的成年患者病历资料,患者发热、咳嗽和进行性呼吸困难,经常规检查和治疗,治疗效果欠佳。支气管肺泡灌洗液mNGS检出惠普尔养障体和念珠菌(1例为白念珠菌,1例为光滑念珠菌和热带念珠菌),其中1例患者39岁,既往体健,并发呼吸衰竭,给予磺胺甲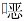
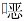
对于免疫缺陷患者,发热伴喘憋,双肺CT提示弥漫性磨玻璃影,临床往往会首先考虑为病毒(如甲型流感病毒、巨细胞病毒)、肺孢子菌感染或非感染性因素如药物性肺损伤,此例患者入院时加用复方磺胺甲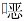
对于严重感染或未知少见病原体,mNGS能快速、灵敏获得病原体,常显著优于微生物培养,使更多的临床医生逐渐认识到少见病原体,特别是免疫力低下患者的重症感染,能早期诊断,精准治疗,减少抗菌药物的滥用。
惠普尔氏病往往引起多系统受损,胃肠道是最常受累的靶器官,此患者无腹泻等消化道症状,因此本病例未行胃肠镜进一步确诊,是该病例的缺陷,此后有类似病例时医务人员需积极与患者及家属沟通,取得更完整的临床资料。
抗菌药物治疗惠普尔养障体感染通常能迅速改善临床症状,但根除惠普尔养障体需要长期治疗。惠普尔氏病目前公认的治疗方案是复方磺胺甲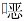
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Schoedon G, Goldenberger D, Forrer R, et al. Deactivation of macrophages with interleukin-4 is the key to the isolation of Tropheryma whippelii[J]. J Infect Dis, 1997, 176(3): 672-677. DOI:10.1086/514089 |
| [2] |
Fenollar F, Birg ML, Gauduchon V, et al. Culture of Trophe-ryma whipplei from human samples: a 3-year experience (1999 to 2002)[J]. J Clin Microbiol, 2003, 41(8): 3816-3822. DOI:10.1128/JCM.41.8.3816-3822.2003 |
| [3] |
von Herbay A, Otto HF, Stolte M, et al. Epidemiology of Whipple's disease in Germany. Analysis of 110 patients diagnosed in 1965-95[J]. Scand J Gastroenterol, 1997, 32(1): 52-57. DOI:10.3109/00365529709025063 |
| [4] |
Dolmans RAV, Boel CHE, Lacle MM, et al. Clinical manifestations, treatment, and diagnosis of Tropheryma whipplei infections[J]. Clin Microbiol Rev, 2017, 30(2): 529-555. DOI:10.1128/CMR.00033-16 |
| [5] |
Marth T. Whipple's disease[P]. Acta Clin Belg, 2016, 71(6): 373-378.
|
| [6] |
Dutly F, Altwegg M. Whipple's disease and "Tropheryma whippelii"[J]. Clin Microbiol Rev, 2001, 14(3): 561-583. DOI:10.1128/CMR.14.3.561-583.2001 |
| [7] |
Kelly CA, Egan M, Rawlinson J. Whipple's disease presenting with lung involvement[J]. Thorax, 1996, 51(3): 343-344. DOI:10.1136/thx.51.3.343 |
| [8] |
Zhang WM, Xu L. Pulmonary parenchymal involvement caused by Tropheryma whipplei[J]. Open Med (Wars), 2021, 16(1): 843-846. DOI:10.1515/med-2021-0297 |
| [9] |
Fenollar F, Puéchal X, Raoult D. Whipple's disease[J]. N Engl J Med, 2007, 356(1): 55-66. DOI:10.1056/NEJMra062477 |
| [10] |
Lagier JC, Lepidi H, Raoult D, et al. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center[J]. Medicine (Baltimore), 2010, 89(5): 337-345. DOI:10.1097/MD.0b013e3181f204a8 |
| [11] |
Lagier JC, Fenollar F, Lepidi H, et al. Treatment of classic Whipple's disease: from in vitro results to clinical outcome[J]. J Antimicrob Chemother, 2014, 69(1): 219-227. DOI:10.1093/jac/dkt310 |
| [12] |
Feurle GE, Junga NS, Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple's disease[J]. Gastroenterology, 2010, 138(2): 478-486; quiz 11-12. DOI:10.1053/j.gastro.2009.10.041 |
| [13] |
Keinath RD, Merrell DE, Vlietstra R, et al. Antibiotic treatment and relapse in Whipple's disease. Long-term follow-up of 88 patients[J]. Gastroenterology, 1985, 88(6): 1867-1873. DOI:10.1016/0016-5085(85)90012-5 |
| [14] |
Fenollar F, Perreal C, Raoult D. Tropheryma whipplei natural resistance to trimethoprim and sulphonamides in vitro[J]. Int J Antimicrob Agents, 2014, 43(4): 388-390. DOI:10.1016/j.ijantimicag.2014.01.015 |
| [15] |
Bakkali N, Fenollar F, Biswas S, et al. Acquired resistance to trimethoprim-sulfamethoxazole during Whipple disease and expression of the causative target gene[J]. J Infect Dis, 2008, 198(1): 101-108. DOI:10.1086/588706 |
| [16] |
Li W, Zhang Q, Xu YL, et al. Severe pneumonia in adults caused by Tropheryma whipplei and Candida sp. infection: a 2019 case series[J]. BMC Pulm Med, 2021, 21(1): 29. |



