近年来,全球早产率呈逐年上升趋势,我国早产儿出生率达7.1%[1],而其中胎膜早破(premature rupture of membranes,PROM)是导致早产的主要原因之一,由胎膜早破导致的早产占早产总数的40%~50%[2-4],胎膜早破后在各种因素作用下易发生宫内感染,继发绒毛膜羊膜炎,对胎儿产生影响,在此过程中有大量的炎症因子参与。新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)是早产儿最常见疾病之一,该病是由于肺表面活性物质(pulmonary surfactant,PS)缺乏引起,多见于胎龄<32周的极早产儿,发病率随胎龄减小而增加,胎膜早破、炎症因子对早产儿肺发育有重要影响,白冰等[5]研究证实在孕鼠动物模型上,当羊膜腔内注射脂多糖诱导绒毛膜羊膜炎时,可促进早产大鼠胎肺成熟,国外研究[6]也发现暴露于绒毛膜羊膜炎的新生儿,NRDS发病率降低,但有不一致的报道,提示暴露于绒毛膜羊膜炎的新生儿由于肺发育不成熟,NRDS发病率增加[7-8],且更易发生重度呼吸窘迫综合征[9];而国外一项Meta分析[10]发现组织学绒毛膜羊膜炎对NRDS的发生没有影响;因此,对于绒毛膜羊膜炎对胎儿肺发育的影响存在不一致结论,且有关研究多为基础研究,临床研究较少。同时,针对胎龄 < 32周的早产儿发生NRDS与胎膜早破合并绒毛膜羊膜炎关系的研究尚无报道。本研究通过回顾性分析某院2016年6月—2019年6月收治的胎龄<32周早产儿的临床资料,探讨孕母PROM时有无合并绒毛膜羊膜炎对极早产儿发生NRDS的影响。
1 对象与方法 1.1 研究对象选取2016年6月—2019年6月该院新生儿重症监护病房收治的胎龄<32周的新生儿。入选新生儿产前均规范使用地塞米松促进胎肺成熟。排除标准:(1)胎龄≥32周的新生儿;(2)遗传代谢性疾病、先天性畸形者;(3)产前未使用或未规范使用地塞米松者;(4)病历资料不全者。根据孕母是否发生PROM分为PROM组和对照组,对照组为因孕母妊娠期高血压、胆汁淤积、前置胎盘等因素而早产者,PROM组再根据孕母是否确诊为绒毛膜羊膜炎,分为PROM合并绒毛膜羊膜炎组(PROM感染组)和PROM未合并绒毛膜羊膜炎组(PROM无感染组),其中对照组和PROM无感染组的孕母及新生儿均无感染。本研究获得中国人民解放军陆军军医大学第一附属医院伦理委员会批准(KY20200043)。
1.2 研究方法比较三组新生儿NRDS发病情况。采用随机数列表,从三组中选取NRDS新生儿。
收集以上三组新生儿临床资料,包括性别、胎龄、出生体重等一般情况,同时,记录三组新生儿以下指标,以比较三组新生儿NRDS严重程度:①胃液泡沫试验:入院后取胃液进行泡沫试验,无泡沫者为阴性,表示PS缺乏,泡沫少于试管周围一圈为弱阳性,试管周围一圈或双侧泡沫为阳性,表示PS较多;②PS使用次数:在三组NRDS新生儿中,若出生后需有创呼吸机辅助通气者,均给予70 mg/kg牛肺表面活性物质经气管插管滴入,其余NRDS新生儿若使用无创呼吸机无法改善呼吸困难者,给予70 mg/kg PS经气管插管滴入,部分新生儿使用1次PS后复查胸片仍可见明显NRDS改变,或呼吸机参数无法下调者给予第2次甚至第3次PS治疗;③胸片:PS使用后8~12 h复查胸片以了解肺部情况,胸片提示双肺未见透光度减低者为无NRDS,双肺透光度降低或出现支气管充气征为轻度NRDS,胸片提示双肺透光度明显降低,伴心缘模糊或呈“白肺”为重度NRDS;④呼吸机使用情况:超低出生体重儿、出生后自主呼吸弱或面罩气囊正压通气无效者,出生后直接给予有创呼吸机联合PS治疗;其余NRDS新生儿,先给予无创呼吸机辅助通气,当无创呼吸机辅助通气不能改善呼吸困难或经皮血氧饱和度维持不佳者,采用INSURE技术,即气管插管-PS-拔管,拔管后给予无创呼吸机辅助通气,当无创呼吸机无法维持时,改为有创呼吸机辅助通气。
1.3 PROM诊断标准PROM诊断根据病史和体格检查确诊,当观察到羊水经阴道流出,阴道液pH值呈碱性,或阴道液涂片后镜检出现羊齿状结晶,当临床诊断不确定时,采用实验室检查来确诊[11]。
1.4 绒毛膜羊膜炎诊断标准包括组织学绒毛膜羊膜炎和临床型绒毛膜羊膜炎;组织学绒毛膜羊膜炎的诊断标准为胎盘病理诊断发现有中性粒细胞弥漫浸润在绒毛膜及羊膜组织中,临床型绒毛膜羊膜炎诊断标准为孕妇有发热,并至少有下列4项中的1项即可诊断:①母体心率≥100次/分,胎儿心率≥160次/分;②子宫压痛;③宫腔内羊水恶臭;④孕妇白细胞计数≥15×109/L、中性粒细胞≥90%。
1.5 NRDS诊断标准参照《实用新生儿学》(第四版)中NRDS诊断标准[12],即出生后出现进行性呼吸困难,结合胃液泡沫振荡试验及胸片结果等确诊。
1.6 统计学方法应用SPSS 19.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,多组比较采用单因素方差分析(ANOVA),方差齐性采用F检验,方差异质性采用Welch检验;计数资料采用频数及百分数表示,采用卡方检验进行比较。P≤0.05为差异有统计学意义。
2 结果 2.1 新生儿一般情况2016年6月—2019年6月共收治胎龄<32周满足入选条件的早产儿284例。其中胎膜早破组148例(PROM感染组51例,PROM无感染组97例),对照组136例。PROM感染组中42例确诊NRDS,发病率82.4%;PROM无感染组中66例确诊NRDS,发病率68.0%;对照组101例确诊NRDS,NRDS发病率74.3%。对照组与PROM无感染组早产儿NRDS发病率比较,差异无统计学意义(χ2=1.080,P=0.299);PROM感染组与PROM无感染组早产儿NRDS发病率比较,差异有统计学意义(χ2=3.471,P=0.062)。采用随机数列表,从三组中选取NRDS新生儿,分别为对照组(50例)、PROM无感染组(50例)、PROM感染组(42例)。比较对照组、PROM无感染组及PROM感染组早产儿的性别、胎龄、出生体重,差异均无统计学意义(均P>0.05),见表 1。
| 表 1 三组早产儿一般情况 Table 1 General conditions of three groups of VPIs |
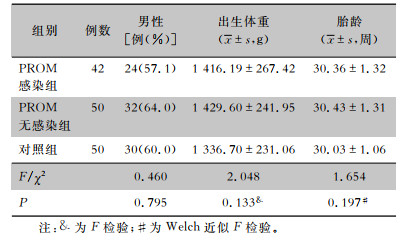
|
三组早产儿胃液泡沫试验结果比较,差异无统计学意义(χ2=4.259,P=0.372),但PROM无感染组早产儿阴性例数为35例,阴性率(70.0%)较低,弱阳性及阳性者为15例,阳性率(30.0%)较高,见表 2。
| 表 2 三组早产儿胃液泡沫试验结果 Table 2 Gastric foam test of three groups of VPIs |

|
使用无创呼吸机者对照组17例(34.0%),PROM无感染组37例(74.0%),PROM感染组11例(26.2%),而PROM感染组使用有创呼吸机者31例(73.8%),使用率最高,三组早产儿呼吸机使用情况比较,差异有统计学意义(χ2=25.331,P<0.01)。PROM无感染组无创呼吸机使用率最高,对照组次之,PROM感染组最低。见表 3。
| 表 3 三组早产儿呼吸机使用情况 Table 3 Ventilator use in three groups of VPIs |
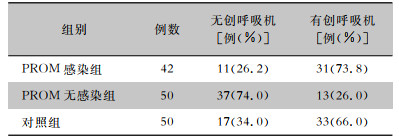
|
三组早产儿PS使用率比较,差异有统计学意义(χ2=13.904,P=0.031)。PROM无感染组早产儿未使用PS人数(8例)最多,而PROM感染组早产儿中PS使用2次及以上比率最高(16.7%);PROM无感染组早产儿PS使用率(84.0%)最低,对照组早产儿PS使用率为98.0%,PROM感染组早产儿PS使用率为97.6%。见表 4。
| 表 4 三组早产儿PS使用次数 Table 4 PS use times in three groups of VPIs |
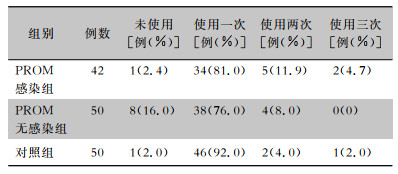
|
使用PS后8~12 h复查胸片以了解肺部情况,结果显示三组早产儿使用PS后呼吸窘迫综合征发生情况比较,差异有统计学意义(χ2=11.173,P=0.025)。PROM无感染组早产儿复查胸片未见NRDS表现者比率(88.0%)较高,无重度NRDS者;对照组早产儿未见NRDS表现者比率为82.0%;而PROM感染组早产儿复查胸片仍可见重度NRDS表现者比率(9.5%)较高。见表 5。
| 表 5 三组早产儿复查胸片NRDS发生情况 Table 5 Occurrence of NRDS showed in chest radiography re-examination in three groups of VPIs |
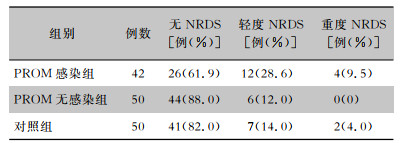
|
PROM是早产合并NRDS的重要诱发因素,而PROM多与感染有关,其中微生物感染是最主要的原因[13-14],另外,物理性及化学性因子、异物、变态反应等非生物学因素也可诱导炎症,引起PROM。PROM与宫内感染相辅相成,孕妇合并宫内感染时,易发生PROM;而PROM发生后病原体可直接通过宫颈进入羊膜腔,进一步加重宫内感染,发生绒毛膜羊膜炎。目前,PROM的发病机制尚不明确,大多数学者认为促进PROM发动的一个重要原因是炎症反应,诱发炎症因子分泌,引起炎症反应加强或失衡导致分娩提前启动[15]。国内外研究[16-17]表明,发生PROM孕妇的羊水及血清中白细胞介素(interleukin,IL)-1、IL-6、IL-8、肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)等炎症因子水平升高,而PROM、炎症因子与早产儿肺发育存在密切关系。Kallapur等[18]发现在羊膜腔内注射内毒素可引起肺部炎症细胞浸润和炎症因子升高,促进肺成熟。Bry等[19]发现在羊膜腔内注射IL-1可以诱导肺表面活性物质蛋白(surfactant-associated protein,SP)的表达,从而促进肺成熟。体外试验发现IL-1可以增加早期兔胎肺组织中SP-A、SP-B、SP-C的表达,由此推测炎症因子对促进肺成熟发挥重要作用[20];然而,也有研究[21]表明,炎症不利于胎儿肺成熟;在宫内感染新生大鼠的动物模型研究[22]中发现,宫内感染组新生大鼠肺组织肺泡数目减少、体积变大,同时新生大鼠肺组织内TNF-αmRNA和IL-1β mRNA水平的增高,提示宫内感染可能通过胎肺内炎症细胞因子的大量生成与释放影响肺泡发育;在转基因小鼠模型研究[23-24]中发现,IL-1β在肺组织内过度表达可干扰正常肺血管发育和肺泡化进程;TNF-α的过度表达可导致肺部炎症、肺气肿、肺纤维化等,上述结果表明,一方面炎症刺激可能阻碍肺发育,导致NRDS;另一方面,炎症反应可能促进PS生成,降低NRDS的发病率。因此,这些炎症因子在什么情况下对胎肺发育有益,从而减少NRDS的发生值得深入研究。
NRDS是由于PS缺乏引起,多见于胎龄<32周的极早产儿,NRDS发生与胎龄、性别、出生体重等因素有关,本次研究早产儿胎龄、性别、出生体重比较差异均无统计学意义,PROM无感染组NRDS发病率最低,PROM无感染组NRDS早产儿无创呼吸机使用最多,PS使用次数最少,且使用PS后复查胸片NRDS程度最轻,病情恢复最快,对照组次之,三组间比较,差异均有统计学意义(均P<0.05),提示PROM无感染早产儿NRDS发病率低,程度较轻,对有创呼吸机依赖小,且使用PS后恢复快。结合本研究结果及国外研究[21, 25],本研究推断PROM未伴有感染时,IL-1、IL-6、IL-8、TNF-α等炎症因子适当分泌增多,而这些适度的炎症可促进肺成熟,增加PS的分泌,降低NRDS发病率及严重程度,而当PROM孕妇发生明显感染(如绒毛膜羊膜炎)时,孕妇羊水及血清中上述炎症因子水平显著升高[26],体内炎症反应平衡打破,炎症介质释放明显增多,形成“瀑布效应”样炎症级联反应,出现过度炎症反应,而引起广泛性肺组织细胞损伤,从而增加NRDS发病率及严重程度。
综上所述,当孕母PROM无感染时,早产儿NRDS发病率低,且程度较轻,而当PROM孕母合并绒毛膜羊膜炎时,NRDS发病率升高,且程度较重;因此,当临床上发生PROM时,应密切监测孕妇炎症指标变化,指标正常者可尽量延长孕周,可通过监测羊水、血清内炎症因子变化预测胎儿NRDS发病率,IL-1、TNF-α等炎症因子轻度升高,可使早产儿肺组织处于最佳状态,NRDS发生率降低,严重程度较轻,该类胎儿出生后可尝试仅给予无创呼吸机支持治疗,避免气管插管造成对新生儿的损伤,同时,不盲目使用PS,以减轻家属经济负担,即使病情需要使用PS后也可尝试尽早拔管,改为无创呼吸机;而当PROM孕母炎症指标明显升高时,尤其是考虑绒毛膜羊膜炎时,应及时终止妊娠,以阻止炎症因子过度表达对肺组织造成损伤,以降低NRDS发病率和严重程度,若该类胎儿出生后确诊NRDS,通过本研究结果,提示可能该类胎儿出生后NRDS程度较重,应尽早给予PS和呼吸机辅助支持治疗,以提高存活率。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Zou LY, Wang X, Ruan Y, et al. Preterm birth and neonatal mortality in China in 2011[J]. Int J Gynaecol Obstet, 2014, 127(3): 243-247. DOI:10.1016/j.ijgo.2014.06.018 |
| [2] |
Roberts CL, Wagland P, Torvaldsen S, et al. Childhood outcomes following preterm prelabor rupture of the membranes (PPROM): a population-based record linkage cohort study[J]. J Perinatol, 2017, 37(11): 1230-1235. DOI:10.1038/jp.2017.123 |
| [3] |
张瑞雪, 杨海澜, 籍静茹. 611例胎膜早破危险因素及妊娠结局的临床回顾性分析[J]. 中华妇幼临床医学杂志(电子版), 2014, 10(1): 53-56. Zhang RX, Yang HL, Ji JR. Retrospective analyze of clinical risk factors and pregnancy outcome of 611 cases premature rupture of membranes[J]. Chinese Journal of Obstetrics & Gynecology and Pediatrics(Electronic Edition), 2014, 10(1): 53-56. DOI:10.3877/cma.j.issn.1673-5250.2014.01.012 |
| [4] |
吴甜, 石晶, 鲍珊, 等. 胎膜早破对孕母感染及早产儿结局的影响[J]. 中国当代儿科杂志, 2017, 19(8): 861-865. Wu T, Shi J, Bao S, et al. Effect of premature rupture of membranes on maternal infections and outcome of preterm infants[J]. Chinese Journal of Contemporary Pediatrics, 2017, 19(8): 861-865. |
| [5] |
白冰, 罗欣, 杨中玫, 等. 孕鼠羊膜囊内注射脂多糖诱导组织学绒毛膜羊膜炎对早产大鼠胎肺成熟与发育的影响[J]. 中华围产医学杂志, 2014, 17(1): 29-35. Bai B, Luo X, Yang ZM, et al. Effects of histologic chorioamnionitis induced by lipopolysaccharide intra-amniotic injection on fetal lung maturation and development in preterm fetal rats[J]. Chinese Journal of Perinatal Medicine, 2014, 17(1): 29-35. |
| [6] |
Moss TJM, Westover AJ. Inflammation-induced preterm lung maturation: lessons from animal experimentation[J]. Paediatr Respir Rev, 2017, 23: 72-77. |
| [7] |
Ryan E, Eves D, Menon PJ, et al. Histological chorioamnioni- tis is predicted by early infant C-reactive protein in preterm infants and correlates with neonatal outcomes[J]. Acta Paediatr, 2020, 109(4): 720-727. DOI:10.1111/apa.15038 |
| [8] |
Metcalfe A, Lisonkova S, Sabr Y, et al. Neonatal respiratory morbidity following exposure to chorioamnionitis[J]. BMC Pediatr, 2017, 17(1): 128. DOI:10.1186/s12887-017-0878-9 |
| [9] |
Speer CP. Neonatal respiratory distress syndrome: an inflammatory disease?[J]. Neonatology, 2011, 99(4): 316-319. DOI:10.1159/000326619 |
| [10] |
Sarno L, Della Corte L, Saccone G, et al. Histological chorioamnionitis and risk of pulmonary complications in preterm births: a systematic review and Meta-analysis[J]. J Matern Fetal Neonatal Med, 2021, 34(22): 3803-3812. DOI:10.1080/14767058.2019.1689945 |
| [11] |
刘騱遥, 漆洪波. 美国妇产科医师学会"胎膜早破指南2018版"解读[J]. 中国实用妇科与产科杂志, 2018, 34(3): 266-269. Liu XY, Qi HB. Interpretation of the ACOG guidelines to premature rupture of membranes(2018 edition)[J]. Chinese Journal of Practical Gynecology and Obstetrics, 2018, 34(3): 266-269. |
| [12] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 4版. 北京: 人民卫生出版社, 2011: 395-398. Shao XM, Ye HM, Qiu XS. Practice of neonatology[M]. 4th ed. Beijing: People's Medical Publishing House, 2011: 395-398. |
| [13] |
Sheikh IA, Ahmad E, Jamal MS, et al. Spontaneous preterm birth and single nucleotide gene polymorphisms: a recent update[J]. BMC Genomics, 2016, 17((Suppl 9): 759. |
| [14] |
Nadeau-Vallée M, Obari D, Quiniou C, et al. A critical role of interleukin-1 in preterm labor[J]. Cytokine Growth Factor Rev, 2016, 28: 37-51. DOI:10.1016/j.cytogfr.2015.11.001 |
| [15] |
Kobayashi H. The entry of fetal and amniotic fluid components into the uterine vessel circulation leads to sterile inflammatory processes during parturition[J]. Front Immunol, 2012, 3: 321. |
| [16] |
Kemp MW, Miura Y, Payne MS, et al. Repeated maternal intramuscular or intraamniotic erythromycin incompletely resolves intrauterine Ureaplasma parvum infection in a sheep model of pregnancy[J]. Am J Obstet Gynecol, 2014, 211(2): 134.e1-134.e9. DOI:10.1016/j.ajog.2014.02.025 |
| [17] |
Stinson LF, Ireland DJ, Kemp MW, et al. Effects of cytokine-suppressive anti-inflammatory drugs on inflammatory activation in ex vivo human and ovine fetal membranes[J]. Reproduction, 2014, 147(3): 313-320. DOI:10.1530/REP-13-0576 |
| [18] |
Kallapur SG, Willet KE, Jobe AH, et al. Intra-amniotic endotoxin: chorioamnionitis precedes lung maturation in preterm lambs[J]. Am J Physiol Lung Cell Mol Physiol, 2001, 280(3): L527-L536. DOI:10.1152/ajplung.2001.280.3.L527 |
| [19] |
Bry K, Lappalainen U, Hallman M. Intraamniotic interleukin-1 accelerates surfactant protein synthesis in fetal rabbits and improves lung stability after premature birth[J]. J Clin Invest, 1997, 99(12): 2992-2999. DOI:10.1172/JCI119494 |
| [20] |
Väyrynen O, Glumoff V, Hallman M. Regulation of surfactant proteins by LPS and proinflammatory cytokines in fetal and newborn lung[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 282(4): L803-L810. DOI:10.1152/ajplung.00274.2001 |
| [21] |
Thomas W, Speer CP. Chorioamnionitis: important risk factor or innocent bystander for neonatal outcome?[J]. Neonatology, 2011, 99(3): 177-187. DOI:10.1159/000320170 |
| [22] |
Muratore CS, Luks FI, Zhou YH, et al. Endotoxin alters early fetal lung morphogenesis[J]. J Surg Res, 2009, 155(2): 225-230. DOI:10.1016/j.jss.2008.06.043 |
| [23] |
Bry K, Whitsett JA, Lappalainen U. IL-1beta disrupts postnatal lung morphogenesis in the mouse[J]. Am J Respir Cell Mol Biol, 2007, 36(1): 32-42. DOI:10.1165/rcmb.2006-0116OC |
| [24] |
Lundblad LKA, Thompson-Figueroa J, Leclair T, et al. Tumor necrosis factor-alpha overexpression in lung disease: a single cause behind a complex phenotype[J]. Am J Respir Crit Care Med, 2005, 171(12): 1363-1370. DOI:10.1164/rccm.200410-1349OC |
| [25] |
Kaukola T, Tuimala J, Herva R, et al. Cord immunoproteins as predictors of respiratory outcome in preterm infants[J]. Am J Obstet Gynecol, 2009, 200(1): 100.e1-100.e8. DOI:10.1016/j.ajog.2008.07.070 |
| [26] |
黄波, 罗小平. 宫内炎性因子暴露与胎肺发育[J]. 中华围产医学杂志, 2005, 8(6): 426-428. Huang B, Luo XP. Intrauterine inflammatory factor exposure and fetal lung development[J]. Chinese Journal of Perinatal Medicine, 2005, 8(6): 426-428. DOI:10.3760/cma.j.issn.1007-9408.2005.06.023 |



