耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales,CRE)因其与死亡率和发病率高度相关而被世界卫生组织(WHO)列为高度优先病原体。CRE最普遍存在的耐药因子为碳青霉烯酶。依据Ambler分类,碳青霉烯酶可分为A、B、D三类,目前临床分离的CRE以产A类肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemase,KPC)为主[1]。由于CRE感染治疗可选用的抗菌药物有限,致死率高,导致临床用药选择困难,多粘菌素类抗生素越来越多的被用作CRE感染治疗的最后选择。既往发现多粘菌素耐药机制大多数为染色体上基因突变(如PmrA/PmrB、PhoP/PhoQ和mgrB/mgrR突变),这种基因突变不会在细菌间相互传播。然而,2015年中国率先报道[2]质粒介导的多粘菌素耐药基因(mobile colistin resistance genes-1,mcr-1),该基因可在不同菌种之间相互传播,并且介导低浓度的多粘菌素耐药性,导致携带mcr-1的CRE感染治疗无药可用。此后,世界范围内陆续发现数十种多粘菌素耐药基因(mcr-1~mcr-9)[3],其中mcr-9在肠杆菌中往往为沉默表达,可在低浓度多粘菌素诱导下呈现表型耐药,使体外药敏试验结果产生偏差。故研究某地区省级综合性三甲医院CRE临床分离株,回顾性分析CRE耐药性、患者临床感染特征、碳青霉烯酶表型及基因型分布情况,分析该地区多粘菌素耐药基因特征,可为临床防治CRE感染提供参考。
1 材料与方法 1.1 实验材料 1.1.1 菌株来源及临床资料收集收集2021年7月—2022年6月安徽省某省级综合性三级甲等医院住院患者临床分离的非重复CRE菌株。同时收集相应患者年龄、性别、入住重症监护病房(ICU)日数、侵袭性操作、抗菌药物使用情况、基础疾病及预后等临床资料。判定标准为对任意一种碳青霉烯类抗生素耐药,或为产碳青霉烯酶的肠杆菌。该院伦理委员会审核同意此研究(伦理号SZR 2021048)。
1.1.2 主要仪器和试剂Microflex-LT/SH型质谱分析仪(德国BRUKER公司),VITEK 2 Compact全自动细菌分析仪(法国BioMérieux公司),生物安全柜(上海力申科学仪器有限公司),Biometra型梯度PCR扩增仪(德国Analytik Jena公司),凝胶成像仪Tanon 1600型(上海天能科技有限公司),药敏纸片(英国Oxoid公司),多粘菌素B(PB)标准药物(上海源叶公司)药敏检测(MIC法)试剂(温州康泰公司),琼脂糖、染料和PCR引物(均为上海生工生物公司)。
1.2 方法 1.2.1 菌种鉴定及药敏试验使用基质辅助激光解吸飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF-MS)对所有菌株进行鉴定。使用VITEK 2 Compact全自动微生物分析系统检测菌株药物敏感性,结果判定参照美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)2020年版[4]标准。采用PB药敏检测试剂检测多粘菌素最低抑菌浓度(minimal inhibitory concentration,MIC),替加环素及PB的耐药折点参考欧洲抗菌药物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)2020版[5]标准判断。质控菌株为大肠埃希菌(ATCC 25922)和肺炎克雷伯菌(ATCC 700603),菌株来源于安徽省细菌耐药监控中心。
1.2.2 碳青霉烯酶表型及耐药基因检测采用改良碳青霉烯灭活(mCIM)试验和改良EDTA碳青霉烯灭活(eCIM)试验检测碳青霉烯酶表型[4]。高温煮沸提取细菌DNA模版,应用聚合酶链式反应(polymerase chain reaction,PCR)检测常见碳青霉烯酶基因(blaKPC、blaIMP、blaVIM、blaNDM和blaOXA-48基因)、染色体上突变基因mgrB和质粒介导的多粘菌素耐药基因(mcr-1~mcr-9),引物及反应条件参考文献[6-8],采用琼脂糖凝胶电泳分析PCR产物。选取阳性结果送上海生工生物技术有限公司测序,结果上传至BLAST网站进行分析。阴性对照为大肠埃希菌(ATCC 25922),阳性对照为试验前期测序验证通过的临床菌株。
| 表 1 耐药基因PCR检测引物序列 Table 1 Primer sequences for PCR detection of drug resis-tance genes |
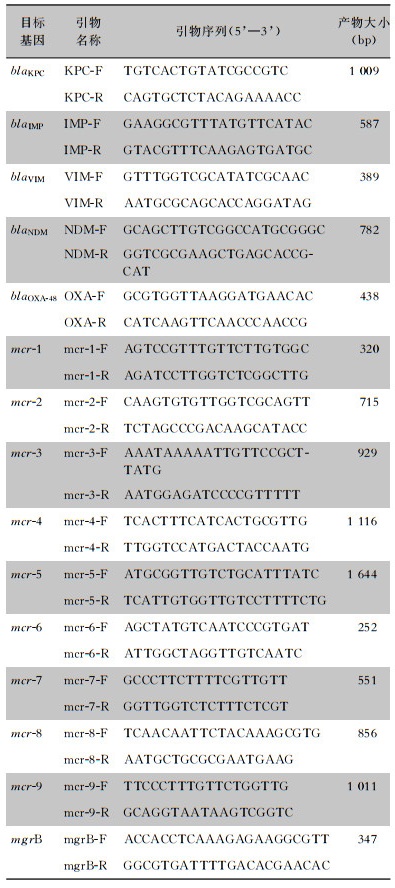
|
采用Akata等[9]方法改良后进行诱导试验。将上述携带mcr-9的菌株过夜培养,取单个菌落,配0.5麦氏单位菌液,取0.3 mL接种到10 mL MHB肉汤中,37℃ 150 r/min的轨道振荡培养1 h,加入PB至药物终浓度为0.125 μg/mL,再培养3 h。用PB药敏检测试剂(MIC法)测定诱导前后菌株PB的MIC值。
1.3 统计分析应用WHONET 2021软件分析药敏试验数据。应用GraphPad Prism 8.0及SPSS 25.0软件进行统计。采用例数或率表示计数资料,平均数或标准差表示计量资料,比较组间样本采用卡方检验,P≤0.05为差异有统计学意义。多因素分析采用多项logistic回归分析,P≤0.05为携带不同碳青霉烯耐药基因(KPC和NDM)CRE感染患者预后的独立影响因素。
2 结果 2.1 菌种及临床患者基本分布共纳入CRE 167株,以肺炎克雷伯菌、阴沟肠杆菌和大肠埃希菌为主。见表 2。标本来源主要为痰、尿、腹腔积液、分泌物及血,分别为74、26、19、15、14株。CRE感染的临床患者年龄16~92岁,平均年龄63.5±16.4岁,男性占63.5%,女性占36.5%。患者住院科室以ICU(41.32%)、普通外科(8.38%)和呼吸科(8.38%)为主,广泛分布于各临床科室。
| 表 2 CRE感染患者菌种分布情况 Table 2 Distribution of bacterial species in patients infected with CRE |
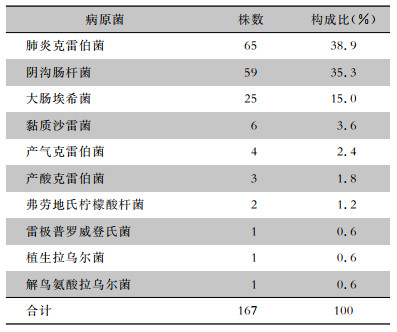
|
CRE菌株对头孢菌素类以及β-内酰胺+酶抑制剂类药物的耐药率≥95.8%,对单环β-内酰胺类药物的耐药率为80.8%,对氟喹诺酮类药物的耐药率为84.4%~99.4%,对氨基糖苷类药物的耐药率为32.9%~63.5%,对替加环素的耐药率为21.0%。3株CRE(1.8%)对PB耐药,且均为肺炎克雷伯菌。肺炎克雷伯菌、阴沟肠杆菌、大肠埃希菌对阿米卡星、妥布霉素及氨曲南的耐药率各组比较,差异均有统计学意义(均P < 0.05),肺炎克雷伯菌对于3种抗菌药物的耐药率均高于阴沟肠杆菌和大肠埃希菌(均P < 0.05)。见表 3。
| 表 3 CRE对抗菌药物的耐药率(%) Table 3 Antimicrobial resistance rates of CRE (%) |
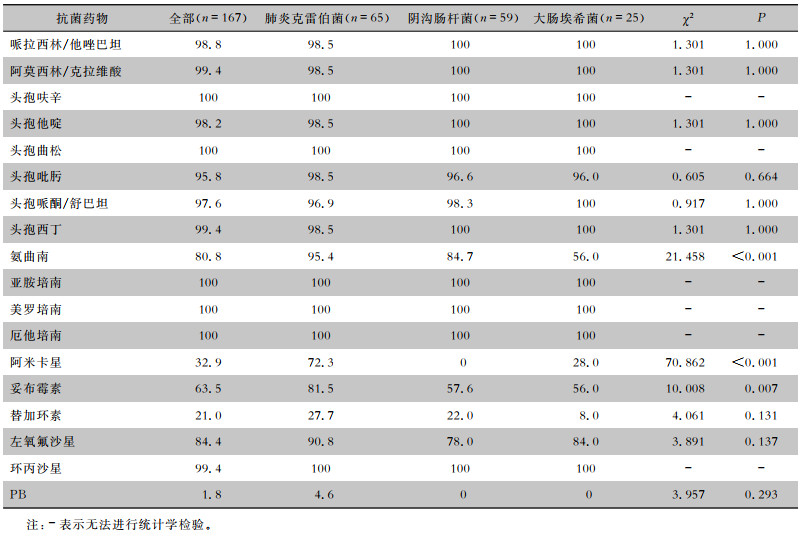
|
mCIM和eCIM试验结果显示,145株菌(86.8%)产碳青霉烯酶。mCIM试验检出58株阳性菌株,eCIM试验检出89株阳性菌株。PCR及测序结果显示,58株(34.7%)blaKPC-2阳性,与mCIM试验结果一致;87株(52.1%)blaNDM阳性(包括blaNDM-1 52株、blaNDM-5 27株、blaNDM-7 5株、blaNDM-13 2株、blaNDM-4 1株),2株(1.2%)blaIMP-4阳性,与eCIM试验结果一致。其中,2株菌同时携带2种碳青霉烯酶耐药基因(blaNDM-5+blaKPC-2或blaKPC-2+blaIMP-4)。58株产KPC型碳青霉烯酶菌株主要为肺炎克雷伯菌(51株,87.9%),87株产NDM型碳青霉烯酶菌株以阴沟肠杆菌(55株,63.2%)和大肠埃希菌(20株,23.0%)为主。见图 1。产KPC型酶的肺炎克雷伯菌主要来源于痰(30株,40.5%),产NDM型酶的大肠埃希菌和阴沟肠杆菌主要来源于尿及分泌物(25株,53.2%)。
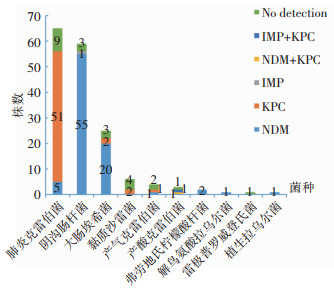 |
| 图 1 菌种及碳青霉烯耐药基因分布 Figure 1 Distribution of bacterial species and carbapenem-resistance genes |
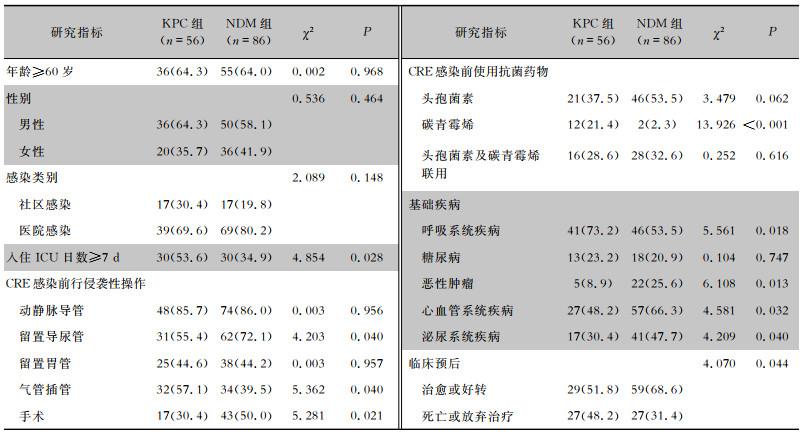
根据主要碳青霉烯酶基因,将菌株分为KPC组(56株)和NDM组(86株),排除同时携带2种碳青霉烯酶耐药基因的2株菌。KPC组患者入住ICU日数≥7 d的比例高于NDM组,KPC组患者行气管插管比例高于NDM组,留置导尿管及手术比例低于NDM组,CRE感染前KPC组患者单独使用碳青霉烯类药物比例高于NDM组,KPC组患者伴有呼吸系统疾病比例高于NDM组,伴有恶性肿瘤、心血管系统疾病、泌尿生殖系统疾病比例均低于NDM组(均P < 0.05)。比较两组患者临床预后,KPC组患者临床治愈或好转比例低于NDM组(P < 0.05)。见表 4。
| 表 4 KPC组和NDM组CRE患者临床特征[例(%)] Table 4 Clinical characteristics of patients in KPC and NDM groups (No. of cases[%]) |
|
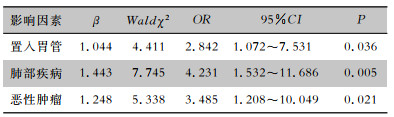
根据预后不同将携带KPC或NDM基因患者分为预后良好和预后不佳两组,进行多因素logistic回归分析,结果显示置入胃管、肺部疾病及恶性肿瘤为影响携带不同碳青霉烯酶基因CRE感染患者预后的独立危险因素(P < 0.05)。见表 5。
| 表 5 CRE感染患者预后的多因素分析结果 Table 5 Multivariate analysis on the prognosis of patients with CRE infection |
|
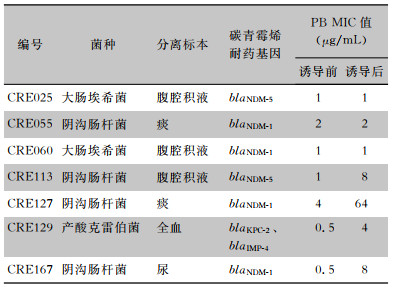
药敏结果显示,3株CRE菌株PB耐药;PCR及测序结果显示,其均未携带mcr-1~mcr-9基因,而染色体上存在mgrB点突变,与药敏结果一致。共7株mcr-9阳性CRE菌株。使用1/8 MIC的PB处理7株携带mcr-9基因的CRE菌株3 h后,4株菌的PB MIC值升高:CRE113号、CRE127号、CRE129号、CRE167号菌株原始MIC值为分别为1、4、0.5、0.5 μg/mL,诱导后分别为8、64、4、8 μg/mL。见表 6。
| 表 6 7株mcr-9阳性CRE菌株特征及PB诱导试验结果 Table 6 Characteristics of 7 mcr-9-positive CRE strains and results of polymyxin B induction test |
|
肠杆菌目细菌是一类致社区和医院感染的常见机会致病菌,主要导致肺炎、尿路感染、腹腔感染及血流感染等。碳青霉烯类抗生素是目前临床上治疗肠杆菌目细菌感染的主要抗菌药物。近年来全球相继报道CRE菌株,且其耐药性问题日趋严重。基于此,研究收集临床CRE菌株并探究其耐药机制。
本研究中,肺炎克雷伯菌检出率最高,阴沟肠杆菌次之,可能是因为纳入呼吸道来源的临床标本居多,而肺炎克雷伯菌为呼吸道常见机会致病菌。2020年CHINET[10]数据显示,近年来肺炎克雷伯菌的检出率稳居第一,耐药率缓慢上升,阴沟肠杆菌碳青霉烯类耐药检出率有所上升,大肠埃希菌对碳青霉烯类耐药检出率有所下降。本研究发现肺炎克雷伯菌的检出率第一,阴沟肠杆菌检出率高于大肠埃希菌,是大肠埃希菌的2倍左右,值得重点关注本地区阴沟肠杆菌检出率,预防暴发流行的可能。阴沟肠杆菌是一类肠道条件致病菌,临床侵入性操作、免疫力下降及抗菌药物的使用可增加其感染风险。阴沟肠杆菌检出率高可能是医院感染所致,可对检出菌株科室环境及物品进行检测,预防病原菌传播。药敏结果显示,所有CRE菌株对头孢菌素类以及β-内酰胺+酶抑制剂类抗生素均有高耐药率,氨基糖苷类药物耐药率较氟喹诺酮类低,对替加环素敏感性较高,对PB具有高敏感性,耐药率仅为1.8%。多粘菌素是半世纪前发现的阳离子脂肽类抗生素,主要通过破坏细菌细胞膜而杀菌,为CRE重症感染的最后治疗选择。然而,多粘菌素耐药基因mcr的出现打破了此局面,需要重点关注。
CRE的耐药机制有:(1)产生碳青霉烯酶;(2)孔蛋白编码基因表达缺失,染色体编码孔蛋白基因突变;(3)外排泵编码基因过表达;(4)细菌生物膜系统等。其中产碳青霉烯酶是分布最广泛的耐药机制。研究[11-12]表明,我国目前CRE临床分离株中存在最广泛的碳青霉烯酶为KPC(A类)。本组CRE主要以产NDM和产KPC菌株为主,可能与菌种地区分布差异有关。研究[10]发现,CRE以大肠埃希菌及肺炎克雷伯菌为主,阴沟肠杆菌次之。本研究中阴沟肠杆菌检出率高于大肠埃希菌,可能与菌种地域分布有关,尚需进一步研究。本研究显示产KPC菌种以肺炎克雷伯菌为主,产NDM菌种以阴沟肠杆菌和大肠埃希菌居多,与研究[11-15]结论基本一致,浙江地区及皖南地区肺炎克雷伯菌以产KPC型酶为主,大肠埃希菌和阴沟肠杆菌以产NDM型酶为主。多粘菌素的耐药机制包括[16]:(1)通过活化双组分调控系统改善细菌细胞膜上脂多糖功能,从而降低多粘菌素吸收;(2)通过广谱外排泵功能,使药物迅速排出细胞,从而减少细胞内含量;(3)调节染色体基因突变;(4)酶解蛋白;(5)生物膜保护;(6)质粒介导的mcr等。近年来,mcr家族基因(mcr-1~mcr-9)在世界各地陆续发现,以mcr-1和mcr-9基因分布最广泛[3]。与其他基因不同,携带mcr-9的菌株多粘菌素体外表型敏感,但在低浓度PB诱导下,mcr-9表达量升高,进而表型耐药[17]。本研究检出3株PB表型耐药的肺炎克雷伯菌,其染色体上存在mgrB点突变,且未发现mcr-1~mcr-8阳性菌株;7株PB敏感菌株携带mcr-9,其中6株同时携带blaNDM基因,1株携带2种碳青霉烯酶(blaKPC-2和blaIMP-4)。在低浓度PB诱导下,有4株菌PB的MIC值出现了升高,证实mcr-9可被诱导表达。
本研究结果显示,延长入住ICU时间可能会增加产KPC型CRE感染概率;CRE感染前KPC组患者行气管插管比例高于NDM组,留置导尿管及手术比例低于NDM组,表明气管插管更易引起产KPC酶的CRE感染,而留置导尿管及手术更易引起产NDM型CRE感染;KPC组患者伴有呼吸系统疾病比例高于NDM组,伴有恶性肿瘤、心血管系统疾病、泌尿生殖系统疾病比例均低于NDM组。通过标本来源分析不同组患者感染菌种分布,结合临床特征推测KPC组患者呼吸系统基础疾病占比高可能因为肺炎克雷伯菌为呼吸道常驻菌群,而肺炎克雷伯菌中以产KPC为主;而NDM组患者泌尿生殖系统疾病占比高,主要由于阴沟肠杆菌和大肠埃希菌为泌尿道及皮肤感染致病菌株,二者以产NDM型酶为主,且侵入性操作作为感染危险因素也增加了感染概率。根据感染前抗菌药物使用及治愈情况推断,感染前合理使用抗菌药物可能会提高治愈率,故可根据患者基础疾病情况及侵入性操作针对性预防和治疗感染,治疗过程中要增强无菌意识,及时拔管,防止操作导致医院感染。
综上所述,本研究对该地区CRE耐药性、临床感染特征、碳青霉烯酶表型及基因型进行分析,并对mcr家族基因进行初步筛查。发现以产NDM菌株检出率最高,阴沟肠杆菌占比较高。98.2%的菌株PB表型敏感,且未携带mcr基因,仅4.2%的CRE携带mcr-9基因。但考虑到本研究时间跨度较短,菌株为单中心来源,结果存在一定局限性。后续将继续收集CRE,扩大样本量,丰富样本来源,同时对检出的mcr-9阳性菌株进行全基因组测序,更加深入了解该地区mcr-9阳性CRE的分子生物学特征,为临床防治CRE感染提供参考。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Zhang YW, Wang Q, Yin YY, et al. Epidemiology of carbapenem-resistant Enterobacteriaceae infections: report from the China CRE network[J]. Antimicrob Agents Chemother, 2018, 62(2): e01882-17. DOI:10.1128/AAC.01882-17 |
| [2] |
Liu YY, Wang Y, Walsh TR, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161-168. DOI:10.1016/S1473-3099(15)00424-7 |
| [3] |
Ling ZR, Yin WJ, Shen ZQ, et al. Epidemiology of mobile colistin resistance genes mcr-1 to mcr-9[J]. J Antimicrob Chemother, 2020, 75(11): 3087-3095. DOI:10.1093/jac/dkaa205 |
| [4] |
Humphries R, Bobenchik AM, Hindler JA, et al. Overview of changes to the clinical and laboratory standards institute Performance Standards for Antimicrobial Susceptibility Testing, M100, 31st edition[J]. J Clin Microbiol, 2021, 59(12): e0021321. DOI:10.1128/JCM.00213-21 |
| [5] |
Li J, Huang ZY, Tang ML, et al. Clonal dissemination of multiple carbapenemase genes in carbapenem-resistant Enterobacterales mediated by multiple plasmids in China[J]. Infect Drug Resist, 2021, 14: 3287-3295. |
| [6] |
Meletis G. Carbapenem resistance: overview of the problem and future perspectives[J]. Ther Adv Infect Dis, 2016, 3(1): 15-21. |
| [7] |
Satlin MJ, Lewis JS, Weinstein MP, et al. Clinical and Laboratory Standards Institute and European Committee on Antimicrobial Susceptibility Testing Position statements on polymy-xin B and colistin clinical breakpoints[J]. Clin Infect Dis, 2020, 71(9): e523-e529. |
| [8] |
Ali S, Hussain W, Ahmed F, et al. ChromagarTM Col-Apse for detection of colistin resistance in clinical isolates of multidrug resistant Gram negative bacilli[J]. J Coll Physicians Surg Pak, 2022, 32(2): 177-180. DOI:10.29271/jcpsp.2022.02.177 |
| [9] |
Akata K, Muratani T, Yatera K, et al. Induction of plasmid-mediated AmpC β-lactamase DHA-1 by piperacillin/tazobactam and other β-lactams in Enterobacteriaceae[J]. PLoS One, 2019, 14(7): e0218589. DOI:10.1371/journal.pone.0218589 |
| [10] |
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of bacterial resistance: results of 2020[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(4): 377-387. DOI:10.16718/j.1009-7708.2021.04.001 |
| [11] |
Han RR, Shi QY, Wu S, et al. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Microbiol, 2020, 10: 314. DOI:10.3389/fcimb.2020.00314 |
| [12] |
黄家祥, 王中新, 潘亚萍, 等. 耐碳青霉烯大肠埃希菌分子特征和同源性分析[J]. 安徽医科大学学报, 2022, 57(4): 574-578. Huang JX, Wang ZX, Pan YP, et al. Molecular characteristics and homology analysis of carbapenem-resistant Escherichia coli[J]. Acta Universitatis Medicinalis Anhui, 2022, 57(4): 574-578. |
| [13] |
龙华婧, 邱芳华, 刘道利, 等. 中国2017-2019年耐碳青霉烯类肺炎克雷伯菌耐药基因及流行克隆特征[J]. 中国感染控制杂志, 2021, 20(11): 1008-1015. Long HJ, Qiu FH, Liu DL, et al. Resistance genes and prevalence clone characteristics of carbapenem-resistant Klebsiella pneumoniae in China from 2017 to 2019[J]. Chinese Journal of Infection Control, 2021, 20(11): 1008-1015. DOI:10.12138/j.issn.1671-9638.20217980 |
| [14] |
黄建胜, 余璟璐, 朱艳, 等. 浙江省丽水地区NDM菌株的耐药特征及基因背景研究[J]. 中华临床感染病杂志, 2018, 11(4): 287-293. Huang JS, Yu JL, Zhu Y, et al. Drug resistance and genetic background of New Delhi metallo-β-lactamase (NDM)-producing bacterial strains in Lishui area of Zhejiang Province[J]. Chinese Journal of Clinical Infectious Diseases, 2018, 11(4): 287-293. DOI:10.3760/cma.j.issn.1674-2397.2018.04.007 |
| [15] |
张鹏, 李婕, 单泳源, 等. 产KPC酶肺炎克雷伯菌耐碳青霉烯类药物的分子机制研究[J]. 中国抗生素杂志, 2022, 47(9): 946-950. Zhang P, Li J, Shan YY, et al. Molecular mechanism of carbapenem resistance in KPC producing Klebsiella pneumoniae[J]. Chinese Journal of Antibiotics, 2022, 47(9): 946-950. DOI:10.3969/j.issn.1001-8689.2022.09.012 |
| [16] |
Silva KED, Rossato L, Leite AF, et al. Overview of polymy-xin resistance in Enterobacteriaceae[J]. Rev Soc Bras Med Trop, 2022, 55: e0349. |
| [17] |
Kieffer N, Royer G, Decousser JW, et al. mcr-9, an inducible gene encoding an acquired phosphoethanolamine transferase in Escherichia coli, and its origin[J]. Antimicrob Agents Chemother, 2019, 63(9): e00965-19. |



