2. 湖南中医药大学药学院, 湖南 长沙 410208
2. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
糖苷水解酶是指参与糖苷类化合物水解反应的一类酶,可特异性水解糖苷类化合物及碳水化合物的糖苷键,协助营养物质或药物的代谢和利用[1]。β-D-葡萄糖苷酶(β-D-glucosidase, EC 3.2.1.21)和β-D-葡萄糖醛酸酶(β-D-glucuronidase, EC 3.2.1.31)是重要的糖苷水解酶,与食物和药物的代谢及肠道疾病相关[2]。由宿主基因表达的糖苷水解酶数量有限,而肠道菌群能产生数量庞大的糖苷水解酶。长期大量使用抗菌药物会破坏肠道菌群稳态,改变肠道菌群分泌糖苷水解酶的数量及活性,造成营养物质代谢不充分,从而引起腹泻[3]。而腹泻的同时会排出大量的肠道常居菌,使肠道菌群失衡,腹泻加重。由此可见,肠道菌群紊乱与腹泻可互为因果,恢复肠道菌群稳态是治疗抗生素相关性腹泻(AAD)的重要靶点。
七味白术散具有健脾益气、和胃生津的功效,主治脾虚泄泻。临床上常用于治疗多种原因所致的腹泻,对抗AAD亦有显著疗效。研究[4]表明,七味白术散能通过扶植如酵母菌(Saccharomyces)、乳酸菌(Lactobacillius)、双歧杆菌(Bifidobacterium)等肠道有益菌的生长,抑制艰难梭菌(Clostridium difficile)等致病菌,以及大肠埃希菌(Escherichia coli)等条件致病菌的生长,上调蔗糖酶、纤维素酶、乳糖酶和淀粉酶等消化酶活性,降低木聚糖酶和蛋白酶的活性,恢复肠道菌群稳态从而治疗腹泻。中医方剂在临床上多数以汤剂给药,汤剂中主要为极性较大的糖苷类成分,进入体内在糖苷水解酶的作用下生成极性较小的单糖、次级苷或苷元。其中次级苷及苷元可被机体吸收利用而发挥其药理作用[5]。此外,AAD与机体能量代谢、氧化应激及炎症反应均存在一定程度的关联。因此,本研究将能量代谢功能相关指标琥珀酸脱氢酶(SDH)和乳酸脱氢酶(LDH),氧化应激功能相关指标丙二醛(MDA),以及炎症相关指标白细胞介素-17(IL-17)和脂多糖(LPS)纳入研究,探究糖苷水解酶的活性变化,为明确AAD发生发展的过程及药物疗效发挥的机制提供依据。
1 材料与方法 1.1 试验动物SPF级昆明雄性小鼠25只,体质量18~22 g,购于湖南斯莱克景达实验动物有限公司,动物许可证编号为:SCXK(湘)2019—0004。分笼饲养于湖南中医药大学实验动物中心。
1.2 主要药物及试剂盒头孢拉定胶囊(批号H13020787,石药集团欧意药业有限公司)、硫酸庆大霉素注射液(批号:5150307,山东鲁抗辰欣药业有限公司)、对硝基苯基β-D-葡萄糖苷(p-NPG,上海麦克林生化科技有限公司)、对硝基苯酚(PNP,上海麦克林生化科技有限公司)、β-葡萄糖醛酸酚酞(美国Sigma公司)、酚酞(国药集团化学试剂有限公司)。炒白术(湖南,批号:20201014)、木香(云南,批号:20201011)、人参(东北,批号:20200610)、广藿香(广东,批号:20200816)、葛根(湖南,批号:20201020)、茯苓(湖南,批号:20201109)、甘草(内蒙古,批号:20200610)均购于湖南中医药大学附属第一医院。LDH酶联免疫酶吸附试验(ELISA)试剂盒(批号:JM-11330M1,江苏晶美生物科技有限公司)、SDH ELISA试剂盒(批号:JM-11331M1,江苏晶美生物科技有限公司)、LPS ELISA试剂盒(批号:JM-02914M1,江苏晶美生物科技有限公司)、IL-17 ELISA试剂盒(批号:JM-02453M1,江苏晶美生物科技有限公司)、MDA TBA微板法检测试剂盒(批号:LDA2101,北京雷根生物技术有限公司)。
1.3 主要仪器紫外分光光度计(Nano-drop 2000/2000C,美国Thermo Scientific公司)、立式压力蒸汽灭菌器(SQ510C,重庆雅马拓科技有限公司)、电热恒温干燥箱(202-2AB,天津市泰斯特仪器有限公司)、涡旋混合器(VORTEX-5,Kylin-bell公司)、三用恒温水箱(HA-600,金坛市神科仪器厂)、多功能酶标仪(SPAPK公司)。
1.4 七味白术散汤剂制备按照《中华人民共和国药典》(2010版)称取七味白术散全方饮片,冷水浸泡30 min,全火煎煮至沸腾后文火继续煎煮30 min,煎煮2次,将2次药液混合浓缩至生药浓度为0.34 g/mL,4℃保存备用。
1.5 动物模型制备及分组给药25只小鼠适应性喂养3 d后,随机分成正常组和模型组,正常组10只,模型组15只。按课题组建立的方法制备AAD模型[6]:采用头孢拉定胶囊联合硫酸庆大霉素注射液配制成浓度为62.5 g/L的抗生素混合液,模型组小鼠按23.33 mL/kg的剂量灌胃,0.35 mL/(只·次),2次/d,连续5 d。正常组小鼠给予等体积的无菌水,当模型小鼠出现便次增多、粪便稀湿、肛周不洁等症状时,提示造模成功。造模成功后取正常组及模型组各5只,随后将模型组剩余小鼠随机分为自愈组和治疗组(每组各5只)。治疗组参考文献[7-8]进行七味白术散汤剂灌胃治疗,根据临床等效剂量按0.16 g/(kg·d)进行灌胃,0.35 mL/(只·次),2次/d,连续3 d,正常组和自愈组小鼠给予等体积的无菌水。
1.6 粗酶液制备[7]分别于造模5 d及治疗3 d后将小鼠脱颈处死。无菌采集各组小鼠的小肠内容物(SC)、小肠黏膜(SM)、结肠内容物(CC)和结肠黏膜(CM),分装于无菌离心管中,加入适量无菌水低速匀浆后,3 000 r/min离心15 min,上清液即为粗酶液。
1.7 小鼠肝脏组织匀浆MDA含量的检测剪取适量肝组织至无菌EP管中,加入适量磷酸盐缓冲液(PBS)匀浆后1 600 r/min离心15 min,取上清液。按照试剂盒说明书要求,采用TBA法检测肝组织匀浆中MDA的含量。
1.8 小鼠血清活性物质的检测眼球取血,制备血清,按照试剂盒说明书要求加样、温育、洗板、终止反应,在一定波长下上机检测各孔OD值,绘制标准曲线,使用ELISA法检测小鼠血清LDH、SDH、IL-17和LPS的含量。
1.9 对硝基苯酚标准曲线绘制分别往7支试管中加入1 mmol/L对硝基苯酚标准液0、1、2、3、4、5、6 mL,用蒸馏水定容至10 mL,每支试管中分别加入1 mL 1 mol/L碳酸钠溶液,显色5 min,以第1管为空白,400 nm处测吸光值(A)。以对硝基苯酚的浓度为横坐标,OD400吸光值为纵坐标,获得对硝基苯酚-光密度标准曲线方程为Y=0.168 8X+0.004 3,R2=0.999 9。
1.10 β-D-葡萄糖苷酶活性检测[9-10]取0.1 mL待测样品酶液、0.9 mL 0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液(pH 4.5)和1 mL 5 mmol/L对硝基苯基β-D-葡萄糖苷溶液分别于50℃恒温水浴10 min后混合均匀,置于50℃水浴锅中继续反应10 min,立即加入1 mL 1 mol/L的碳酸钠溶液显色,摇匀后400 nm处测其A值。以高温灭活的粗酶液为空白对照。每克肠道内容物/黏膜在50℃,10 min水解对硝基苯基β-D-葡萄糖苷产生1 μmoL的对硝基苯酚定义为一个酶活力单位(U/g)。
1.11 酚酞标准曲线绘制取6支试管分别加入20 μg/mL的酚酞储备液0、0.2、0.4、0.6、0.8、1.0 mL,用醋酸缓冲液定容至1 mL,分别加入3 mL碱性甘氨酸溶液显色,静置10 min,以第1管为空白在560 nm处测A值。以酚酞浓度为横坐标,OD560吸光值为纵坐标,获得酚酞光密度标准曲线方程为Y=0.083 8X+0.001 1,R2=0.999 8。
1.12 β-D-葡萄糖醛酸酶活性检测[11]测定管中加入0.1 mL待测样品酶液,0.8 mL pH 5.0醋酸缓冲液,0.01 mol/L β-葡萄糖醛酸酚酞基质液0.1 mL,混合均匀,37℃水浴24 h,立即加入3 mL pH 10.4的甘氨酸-氢氧化钠缓冲液终止反应,540 nm处测A值;另取测定管加入0.1 mL灭活粗酶液,pH 5.0醋酸缓冲液0.8 mL,混合均匀,37℃水浴24 h,立即加入3 mL pH 10.4的甘氨酸-氢氧化钠缓冲液作为空白对照。每克肠道内容物/黏膜在37℃、水浴24 h水解β-葡萄糖醛酸酚酞产生1 μg酚酞定义为一个酶活力单位(U/g)。
1.13 统计学分析应用SPSS 21.0软件进行分析,计量数据采用均值±标准差(x±s)表示,数据符合正态性分布时,两组间比较采用独立样本t检验。数据符合正态性及方差齐性时,三组间比较采用单因素方差分析,进一步比较采用LSD-t法,否则采用Kruskal-Wallis H秩和检验。检验水准α=0.05。
2 结果 2.1 小鼠形态及行为学变化造模前,各组小鼠均正常摄食饮水,行动灵活,被毛平整,粪便呈黑褐色,干燥成形。混合抗生素造模后,模型组小鼠出现精神萎靡,毛发光泽度降低,便次数增多,粪便稀释成水样,肛周不洁等症状。七味白术散治疗3 d后,小鼠腹泻症状明显缓解,精神状态明显好转,粪便色黄质软成形,毛发平整度和光泽度增加,肛周干净。
2.2 七味白术散对AAD小鼠肠道氧化应激功能的影响自愈组小鼠MDA水平较正常组升高,七味白术散干预后MDA值下降,但三组MDA水平较比较,差异无统计学意义(P>0.05)。见图 1。
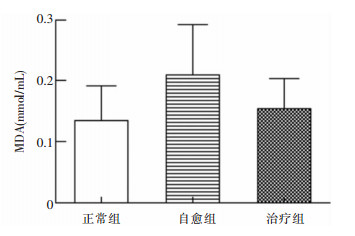 |
| 图 1 七味白术散对AAD小鼠肠道氧化应激功能的影响 Figure 1 Effect of Qiwei Baizhu Powder on intestinal oxidative stress in AAD mice |
自愈组小鼠血清中LDH水平较正常组升高,七味白术散干预后LDH值下降,但三组LDH水平较比较,差异无统计学意义(P>0.05)。与正常组相比,自愈组小鼠血清SDH活力较正常组降低(P<0.05),治疗组中SDH值较自愈组升高(P<0.05),但与正常组水平比较差异无统计学意义(P>0.05)。见图 2。
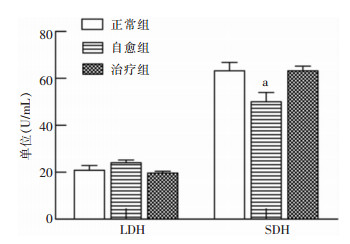 |
| 注:a表示与正常组比较,P<0.05。 图 2 七味白术散对AAD小鼠肠道能量代谢功能的影响 Figure 2 Effect of Qiwei Baizhu Powder on intestinal energy metabolism in AAD mice |
与正常组相比,自愈组小鼠血清中LPS含量升高(P<0.01),经过3 d的自然恢复LPS仍未回到正常水平。七味白术散能降低LPS的水平(P<0.01)。见图 3。
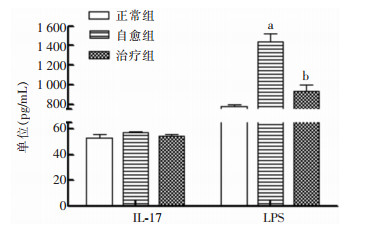 |
| 注:a表示与正常组比较,P<0.01;b表示与自愈组比较,P<0.01。 图 3 七味白术散对AAD小鼠血清炎性因子的影响 Figure 3 Effect of Qiwei Baizhu Powder on serum infla-mmatory factors in AAD mice |
β-D-葡萄糖苷酶的总体酶活性在小鼠小肠中高于结肠,黏膜中高于内容物。混合抗生素造模后,模型组小鼠SC、SM和CC中β-D-葡萄糖苷酶活性均低于正常组(均P<0.05),而CM中β-D-葡萄糖苷酶活性高于正常组(P<0.05)。见表 1。
| 表 1 抗生素造模对小鼠肠道β-D-葡萄糖苷酶活性的影响(U/g) Table 1 Effect of antibiotic modeling on mice intestinal β-D-glucosidase activity (U/g) |

|
小鼠肠道β-D-葡萄糖醛酸酶的总体酶活性在结肠中高于小肠,黏膜中高于内容物。抗生素造模结束后,β-D-葡萄糖醛酸酶活性与β-D-葡萄糖苷酶活性变化趋势一致,即模型组小鼠的SC、SM和CC中酶活性均降低(均P<0.05),CM中酶活性升高(P<0.01)。见表 2。
| 表 2 抗生素造模对小鼠肠道β-D-葡萄糖醛酸酶活性的影响(U/g) Table 2 Effect of antibiotic modeling on mice intestinal β-D-glucuronidase activity (U/g) |

|
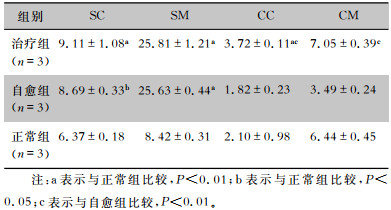
经过3 d的自愈期,小鼠SC和SM中β-D-葡萄糖苷酶活性均高于正常组(均P<0.05)。治疗组不同肠段黏膜及内容物的β-D-葡萄糖苷酶活性均高于正常组(SC、SM和CC均P<0.05)和自愈组(CC和CM均P<0.05)。见表 3。
| 表 3 七味白术散对AAD小鼠肠道β-D-葡萄糖苷酶活性的影响(U/g) Table 3 Effect of Qiwei Baizhu Powder on intestinal β-D-glucosidase activity in AAD mice (U/g) |
|
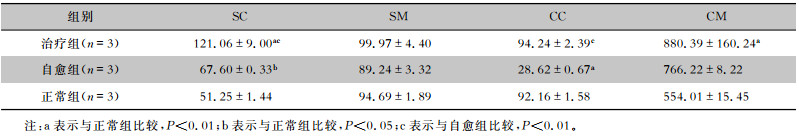
经过3 d的自愈期,SC的酶活性升高(P<0.05),CC中的酶活性降低(P<0.01)。七味白术散治疗提高了不同肠段黏膜及内容物β-D-葡萄糖醛酸酶的活性,其中SC的酶活性高于自愈组和正常组(均P<0.01),CC中的酶活性高于自愈组(P<0.01),CM中的酶活性高于正常组(P<0.01)。见表 4。
| 表 4 七味白术散对AAD小鼠肠道β-D-葡萄糖醛酸酶活性的影响(U/g) Table 4 Effect of Qiwei Baizhu Powder on intestinal β-D-glucuronidase activity in AAD mice (U/g) |
|
人类肠道中约含有1 000~1 150种细菌,共同维持宿主消化、代谢、免疫调节、能量转换、黏膜发育和屏障维持等功能[12]。肠道菌群作为人体的“微生物器官”,分泌数量庞大的糖苷水解酶,不同肠段中表达糖苷水解酶的微生物种类和数量存在差异。β-D-葡萄糖苷酶主要由小肠上皮绒毛膜刷状沿及结肠的肠道菌群分泌[13],而β-D-葡萄糖醛酸酶广泛存在于肠黏膜中[14]。肠道菌群中不同菌属能表达不同的糖苷水解酶,β-D-葡萄糖苷酶主要由霉菌、酵母菌和乳酸菌等分泌,其中双歧杆菌和多形拟杆菌对其有较高的表达。肠道中葡萄球菌、乳酸菌、瘤胃球菌等细菌,青霉、曲霉、酵母菌等真菌皆可分泌β-D-葡萄糖醛酸酶,其中肠道厚壁菌门内的梭菌分泌大量的β-D-葡萄糖醛酸酶。艰难梭菌为严格的结肠厌氧菌,是引起菌群失调腹泻的主要原因[15],且β-D-葡萄糖醛酸酶对大肠埃希菌具有高度的特异性[16]。因此,糖苷水解酶活性的变化与肠道菌群的改变密切相关。
本研究发现小鼠肠道β-D-葡萄糖苷酶的酶活性在小肠中高于结肠,而β-D-葡萄糖醛酸酶的酶活性在结肠中高于小肠,两种酶在肠黏膜中的酶活性均高于肠内容物,与相关研究[13-14]结果一致。课题组前期对头孢拉定联合硫酸庆大霉素造模AAD小鼠发现,肠内容物菌群变化主要表现为厚壁菌门及拟杆菌门数量急剧减少,以肠球菌和梭状芽孢杆菌的数量升高尤为显著,与黏膜中的菌群变化较为一致[7]。此外,课题组前期对肠内容物可培养微生物菌落研究[8]结果显示,抗生素还会导致大肠埃希菌数和乳酸菌的菌落数急剧减少。本研究中,抗生素造模后小鼠肠道β-D-葡萄糖苷酶活性在小肠、结肠内容物及小肠黏膜中均降低,此与抗生素导致对其表达的乳酸菌受到抑制有关。由于β-D-葡萄糖醛酸酶对大肠埃希菌具有高度的特异性,可推测本研究中抗生素造模后小鼠肠道β-D-葡萄糖醛酶活性在SC、CC及SM中明显降低,可能与抗生素导致大肠埃希菌数量显著减少有关。抗生素造模后小鼠CM中两种酶活性显著升高,可能是由于梭菌大量繁殖并移位至CM所致。腹泻是以消化系统紊乱为主要表现的代谢性疾病,小肠是消化吸收的主要部位,抗生素造模后β-D-葡萄糖苷酶和β-D-葡萄糖醛酸酶活性在小肠中均显著降低,说明抗生素降低了小鼠的代谢能力,导致食物代谢受阻,是引发腹泻的原因之一。
现代药理研究表明,七味白术散能提高肠道消化酶活性,缓解肠道炎症,促进肠道受损黏膜恢复[17],在治疗AAD上疗效显著。七味白术散含有丰富黄酮苷和皂苷,其中人参和甘草被证实是七味白术散的抑菌成分,对大肠埃希菌、铜绿假单胞菌及肠道酵母菌均有明显的抑菌效果[18]。β-D-葡萄糖苷酶和β-D-葡萄糖醛酸酶均能将人参皂苷转化为药理作用更强的稀有人参皂苷或苷元,β-D-葡萄糖醛酸酶能将甘草的主要药性成分甘草酸(GL)C3位的两个葡萄糖醛酸基和外端一个葡萄糖醛酸基脱去,分别生成抗炎和抗过敏等药理活性更优的甘草次酸(GA)和单葡萄糖醛酸甘草次酸(GAMG)[19]。由此可见,七味白术散药效的发挥与糖苷水解酶活性有关。在整个试验过程中,结肠中的糖苷水解酶活性较小肠稳定,黏膜中的酶活性较内容物稳定,此与结肠比小肠的微生物丰度和多样性更高有关[20];与肠内容物相比,黏膜具有结构完整、免疫健康、菌群定植相对稳定、受外界因素影响较小等诸多优点[21]。综上所述,两种糖苷水解酶活性的变化与肠道菌群的改变密切相关,七味白术散能在调节肠道菌群的基础上提高AAD小鼠不同肠段黏膜及内容物的糖苷水解酶的活性,促进食物和药物的代谢吸收,从而治疗腹泻。
肠道菌群失调时肠黏膜通透性增加,内毒素通过肠-肝轴进入体循环,从而诱导释放一系列炎症介质,激活体内炎症反应[22]。MDA作为血清中自由基-脂质过氧化代谢产物能刺激肠道液体的分泌,其水平越高,说明自由基损伤越严重;LPS高浓度时可以穿过肠道黏膜屏障进入血液循环,与免疫细胞CD14表面的Toll样受体结合而激活免疫细胞,可诱导全身性炎症,即内毒素血症[23];低浓度的LPS与IL-17还可协同促进IL-8的表达[24];机体炎性因子升高时可进一步诱导免疫应答,通过抑制肠道钠和钾-ATP酶的活性,进而抑制水、钠吸收[25],同时增加肠黏膜通透性,促进肠壁液体的渗出,这些过程均可引发或加重腹泻[26]。LDH是机体细胞质氧化还原酶,同时也是机体组织损伤和炎症反应的标志[27]。Zhang等[28]研究发现,LPS能使断奶仔猪和大鼠血清中LDH含量增加。本试验中模型组小鼠LDH水平高于正常组,与上述研究一致,说明混合抗生素处理引起小鼠炎症损伤,导致LDH升高。本研究中抗生素造模后小鼠MDA、LPS和IL-17均升高,而七味白术散的干预能使其下降,其中对LPS的影响尤为显著,目前越来越多的证据表明,肠道菌群失调引起的内毒素血症是代谢性疾病发生的一个重要因素[29]。由此可推断,抗生素导致机体的氧化应激和黏膜细胞损伤,触发小鼠机体的炎症反应,可能与大肠埃希菌分泌的LPS及其诱导的代谢性内毒素血症有关,具体机制有待进一步研究。而七味白术散能缓解肠道炎症,促进肠道受损黏膜恢复,从而缓解腹泻。
本研究从糖苷水解酶的活性着手,研究AAD疾病的病因,同时阐释了七味白术散对AAD的治疗机制,以及其与机体能量代谢、氧化应激和炎症反应之间的关联,深入探讨七味白术散治疗AAD的药效机制,为肠道糖苷水解酶参与药物食物代谢的相关研究提供了新的思路。肠道是一个高度复杂的生态系统,菌群之间,以及菌群与宿主之间存在着巨大的相互依赖和相互作用,菌群的丰度和多样性的变化也会引起其表达的糖苷水解酶的活性发生变化,且酶活性易受反应温度、反应时间和底物浓度等反应条件的影响,小鼠的个体差异以及自愈能力也会造成酶活性的波动。后续研究可借助高通量测序技术进一步明确菌与酶的相关性,以全面反映AAD形成及七味白术散疗效的肠道微生态机制。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
王振丽, 李书华, 王婷婷. β-葡萄糖苷酶固体发酵培养条件的优化[J]. 食品安全导刊, 2021(29): 141, 144. Wang ZL, Li SH, Wang TT. Optimization of solid fermentation conditions for β-glucosidase[J]. China Food Safety Magazine, 2021(29): 141. DOI:10.16043/j.cnki.cfs.2021.29.089 |
| [2] |
Chen TT, Lv JJ, Chen L, et al. Role of heparinase in the gastrointestinal dysfunction of sepsis (review)[J]. Exp Ther Med, 2022, 23(2): 119. |
| [3] |
龙承星. 七味白术散对菌群失调腹泻小鼠肠道黏膜细菌及乳糖酶基因多样性的影响[D]. 长沙: 湖南中医药大学, 2019. Long CX. Effects of Qiwei Baizhu Powder on intestinal mucosal bacteria and lactase gene diversity in mice with dysbiosis diarrhea[D]. Changsha: Hunan University of Chinese Medicine, 2019. |
| [4] |
Qiao B, Liu J, Xiao NQ, et al. Effects of sweeteners on host physiology by intestinal mucosal microbiota: example-addition sweeteners in Qiweibaizhu Powder on intestinal mucosal microbiota of mice with antibiotic-associated diarrhea[J]. Front Nutr, 2022, 9: 1038364. DOI:10.3389/fnut.2022.1038364 |
| [5] |
谢果珍, 黄莉莉, 张水寒, 等. 肠道微生物代谢苷类化合物的研究进展[J]. 天然产物研究与开发, 2022, 34(7): 1261-1271. Xie GZ, Huang LL, Zhang SH, et al. Advances in metabolism of glycosides by gut microbiota[J]. Natural Product Research and Development, 2022, 34(7): 1261-1271. |
| [6] |
Xie GZ, Tan K, Peng MJ, et al. Bacterial diversity in intestinal mucosa of antibiotic-associated diarrhea mice[J]. 3 Biotech, 2019, 9(12): 444. DOI:10.1007/s13205-019-1967-2 |
| [7] |
郭抗萧, 彭昕欣, 毛娅男, 等. 七味白术散对菌群失调腹泻小鼠肠道蔗糖酶活性的影响[J]. 中国微生态学杂志, 2019, 31(10): 1130-1134. Guo KX, Peng XX, Mao YN, et al. Effect of Qiwei Baizhu San on intestinal sucrase activity in mice with diarrhea[J]. Chinese Journal of Microecology, 2019, 31(10): 1130-1134. DOI:10.13381/j.cnki.cjm.201910003 |
| [8] |
谭周进, 张华玲, 周赛男, 等. 菌群失调小鼠腹泻造模及超微中药干预过程中肠道微生物的变化[J]. 应用与环境生物学报, 2013, 19(3): 449-453. Tan ZJ, Zhang HL, Zhou SN, et al. Change of intestinal microbes in dysbacteriosis-modeled mice treated with ultra-micro powder of Qiweibaizhusan[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(3): 449-453. |
| [9] |
张浩忠. 肠球菌中β-D-葡萄糖苷酶的分离纯化及酶学性质研究[D]. 济南: 山东轻工业学院, 2010. Zhang HZ. Purification and characterization of β-D-glucosidase in enterococcus faecium[D]. Jinan: Shandong Institute of Light Industry, 2010. |
| [10] |
李平, 宛晓春, 丁霄霖, 等. 黑曲霉β-葡萄糖苷酶的活力测定和酶学性质[J]. 安徽农业大学学报, 1998, 25(3): 304-309. Li P, Wan XC, Ding XL, et al. Determination of β-glucosidase activity and enzymatic properties of Aspergillus niger[J]. Journal of Anhui Agricultural University, 1998, 25(3): 304-309. |
| [11] |
丁友法. 胃液pH对β-葡萄糖醛酸苷酶活性的影响[J]. 临床检验杂志, 1993, 11(3): 126. Ding YF. The influence of gastric PH on the activity of β-glucosalbinase[J]. Journal of Clinical Laboratory Science, 1993, 11(3): 126. |
| [12] |
Perler BK, Friedman ES, Wu GD. The role of the gut microbiota in the relationship between diet and human health[J]. Annu Rev Physiol, 2023, 85: 449-468. DOI:10.1146/annurev-physiol-031522-092054 |
| [13] |
Baglioni M, Breccia JD, Mazzaferro LS. Peculiarities and systematics of microbial diglycosidases, and their applications in food technology[J]. Appl Microbiol Biotechnol, 2021, 105(7): 2693-2700. |
| [14] |
Little MS, Pellock SJ, Walton WG, et al. Structural basis for the regulation of β-glucuronidase expression by human gut Enterobacteriaceae[J]. Proc Natl Acad Sci U S A, 2018, 115(2): E152-E161. |
| [15] |
朱佳源, 谭周进, 郑淘, 等. 艰难梭菌与抗生素相关腹泻的研究进展[J]. 中国感染控制杂志, 2021, 20(12): 1168-1173. Zhu JY, Tan ZJ, Zheng T, et al. Advances in Clostridium difficile and antibiotic-associated diarrhea[J]. Chinese Journal of Infection Control, 2021, 20(12): 1168-1173. |
| [16] |
Letertre MPM, Bhatt AP, Harvey M, et al. Characterizing the metabolic effects of the selective inhibition of gut microbial β-glucuronidases in mice[J]. Sci Rep, 2022, 12(1): 17435. |
| [17] |
王威, 王静. 基于网络药理学对七味白术散治疗菌群失调性腹泻的作用机制研究[J]. 世界中西医结合杂志, 2021, 16(7): 1251-1255, 1264. Wang W, Wang J. Study on the mechanism of Qiwei Baizhu Powder in the treatment of dysbacterial diarrhea based on network pharmacology[J]. World Journal of Integrated Traditional and Western Medicine, 2021, 16(7): 1251-1255, 1264. |
| [18] |
蒋婕, 郭抗萧, 龙玲, 等. 超微七味白术散体外抑菌作用研究[J]. 中国中医药信息杂志, 2013, 20(11): 28-30. Jiang J, Guo KX, Long L, et al. Inhibiting effect of ultra-micro powder Qiweibaizhusan on bacteria in vitro[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2013, 20(11): 28-30. |
| [19] |
赵子璇, 李春峰, 杨洪旺, 等. 五环三萜类化合物微生物转化研究进展[J]. 天然产物研究与开发, 2021, 33(8): 1415-1426. Zhao ZX, Li CF, Yang HW, et al. Advances in microbial transformation of pentacyclic triterpenes[J]. Natural Product Research and Development, 2021, 33(8): 1415-1426. |
| [20] |
Martinez-Guryn K, Leone V, Chang EB. Regional diversity of the gastrointestinal microbiome[J]. Cell Host Microbe, 2019, 26(3): 314-324. |
| [21] |
Long CX, Shao HQ, Luo CY, et al. Bacterial diversity in the intestinal mucosa of dysbiosis diarrhea mice treated with Qiweibaizhu Powder[J]. Gastroenterol Res Pract, 2020, 2020: 9420129. |
| [22] |
Gao J, Chen HF, Xu LY, et al. Effects of intestinal microorganisms on influenza-infected mice with antibiotic-induced intestinal dysbiosis, through the TLR7 signaling pathway[J]. Front Biosci (Landmark Ed), 2023, 28(3): 43. |
| [23] |
Deng MH, Scott MJ, Loughran P, et al. Lipopolysaccharide clearance, bacterial clearance, and systemic inflammatory responses are regulated by cell type-specific functions of TLR4 during sepsis[J]. J Immunol, 2013, 190(10): 5152-5160. |
| [24] |
林艳华, 周平, 马培娥, 等. IL-17在炎性肠病中的表达及其与LPS协同诱导肠上皮细胞表达IL-8的作用机制[J]. 世界华人消化杂志, 2012, 20(12): 991-997. Lin YH, Zhou P, Ma PE, et al. Expression of IL-17 in inflammatory bowel disease and synergistic action of IL-17 and LPS on IL-8 expression in intestinal epithelial cells[J]. World Chinese Journal of Digestology, 2012, 20(12): 991-997. |
| [25] |
Qin H, Zhang Y, Wang R, et al. Puerarin suppresses Na+-K+-ATPase-mediated systemic inflammation and CD36 expression, and alleviates cardiac lipotoxicity in vitro and in vivo[J]. J Cardiovasc Pharmacol, 2016, 68(6): 465-472. |
| [26] |
Li CR, Xiao NQ, Deng N, et al. Dose of sucrose affects the efficacy of Qiweibaizhu Powder on antibiotic-associated diarrhea: association with intestinal mucosal microbiota, short-chain fatty acids, IL-17, and MUC2[J]. Front Microbiol, 2023, 14: 1108398. |
| [27] |
牛现琇, 杨维仁, 黄丽波, 等. 不同锌源及水平对生长肥育猪血清酶活性和组织器官锌沉积量的影响[J]. 动物营养学报, 2018, 30(3): 910-917. Niu XX, Yang WR, Huang LB, et al. Effects of different Zinc sources and levels on serum enzyme activities, tissue and organ zinc accumulations of growing-finishing pigs[J]. Chinese Journal of Animal Nutrition, 2018, 30(3): 910-917. |
| [28] |
Zhang Y, Deng ZX, He ML, et al. Olive oil cake extract stabilizes the physiological condition of lipopolysaccharide-challenged piglets by reducing oxidative stress and inflammatory responses and modulating the ileal microbiome[J]. Food Funct, 2021, 12(20): 10171-10183. |
| [29] |
Liu YJ, Zeng YH, Liu YX, et al. Regulatory effect of isomaltodextrin on a high-fat diet mouse model with LPS-induced low-grade chronic inflammation[J]. J Agric Food Chem, 2022, 70(36): 11258-11273. |



