2. 铜陵市人民医院感染管理办公室,安徽 铜陵 244002
2. Department of Healthcare-associated Infection Management, Anhui Tongling People's Hospital, Tongling 244002, China
耳念珠菌(Candida auris)是2009年首次发现于日本的真菌,能引发血液、肺部、尿道、伤口等部位感染,多数对现有抗真菌药物耐药,感染患者的病死率接近68%[1]。该菌耐盐、耐高温,可长期存在于医院的环境、物体表面,并定植于人体皮肤表面,极易导致免疫力低及接受侵袭性治疗的高风险人群感染,甚至引起医院感染暴发,故被称为“超级真菌”[2-3]。耳念珠菌常规方法鉴定困难,容易漏诊,基质辅助激光解吸电离飞行时间质谱技术(matrix-assisted laser desorption ionization-time of flight mass spectrometry, MALDI-TOF MS)可检测真菌蛋白,基因测序技术可对核糖体内26S rDNA转录间隔区(internal transcribed space, ITS)或28S rDNA的D1/D2区序列进行鉴定,故质谱和测序均能有效鉴定耳念珠菌[4]。根据基因序列可将全球耳念珠菌分为五大分支:南亚分支(Ⅰ)、东亚分支(Ⅱ)、南非分支(Ⅲ)、南美分支(Ⅳ),以及近期出现的伊朗分支(Ⅴ)[5]。医疗机构需重视耳念珠菌的防控工作,对其可能带来的环境污染及人员体表定植情况进行及时准确的监测,有助于针对性采取消毒、去定植及隔离等措施,对阻断耳念珠菌传播尤其关键。
我国2018在北京首次发现耳念珠菌感染病例,近年在沈阳、厦门也有零散病例报道,研究内容主要集中在临床分离株的耐药特点、毒力及分子分型等方面,对耳念珠菌在环境及患者体表的存在情况及相应消杀措施报道甚少[6-10]。某院2022年6月6日于重症监护病房(ICU)发现1例耳念珠菌血流感染患者(1号患者),随即第一时间对耳念珠菌在病房环境及患者体表的定植情况进行了主动筛查,启动各项医院感染防控措施,并收到一定成效[11]。针对该院主动筛查中从ICU环境和患者体表分离的环境/定植菌株,本研究探索鉴定耳念珠菌的有效方法,并比较其与1号患者血液中分离的耳念珠菌菌株(临床分离株)的基因组和药敏特点,初步探讨该院耳念珠菌的来源及同源性,以期为耳念珠菌的监测、防控提供经验和依据。
1 材料与方法 1.1 仪器与试剂真菌鉴定采用中元汇吉EXS1000质谱仪和梅里埃公司Vitek 2 Compact全自动微生物鉴定仪;测序采用ABI 3730XL测序仪;药敏分析采用迪尔细菌鉴定及药敏分析系统DL-96A及配套的DL-96FUNGUS真菌试剂板;真菌培养采用江门市凯林贸易有限公司提供的真菌肉汤型培养基和念珠菌属真菌显色培养基;药敏纸片由赛默飞世尔科技有限公司提供。
1.2 标本采集及培养6月8—17日感染管理办公室联合ICU及微生物室对感染患者周围96处环境和14例ICU患者体表进行了采样及培养,环境选择高频接触环境物体表面,包括监护仪、输液泵、呼吸机、吊塔台面、床单元、电脑鼠标与键盘、水龙头、地面、门把手、电源开关、空调风口、治疗车、工作台面等,患者体表选择口腔、鼻腔、双侧腋窝、双侧腹股沟和肛门。采集方法按《医院感染预防与控制标准操作流程》[12]规范操作,用无菌棉签拭子采样后置于1~2 mL生理盐水中保存,2 h内送至微生物室。培养采取选择性增菌法,即将采集后的棉拭子用振荡器震荡后加入等体积的真菌液体培养基,同时加入万古霉素(30 μg/片)、亚胺培南(10 μg/片)药敏纸片各1片,37℃培养24 h后3 000 r/min离心3 min,取沉淀接种于真菌显色培养基上,37℃培养过夜。
1.3 质谱和生化鉴定挑取真菌显色平板上奶油色菌落,顺时针涂于靶板上相应孔位,加入1 μL 70%的甲酸溶液,干燥后再加入1 μL基质溶液,再次干燥后质谱鉴定。生化鉴定采用Vitek 2 Compact全自动微生物鉴定系统,选取质谱鉴定后的耳念珠菌纯菌落使用无菌盐水配置浊度为3.0的菌液,自动填充于真菌鉴定卡后上机培养48 h鉴定。
1.4 测序菌株鉴定采用ITS测序和全基因组测序(WGS)。委托金域医学检验实验室提取菌株基因组,使用通用引物ITS1和ITS4(ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTATGATAGC-3’)扩增ITS序列,扩增产物经1%琼脂糖凝胶电泳回收目的条带,纯化产物通过双脱氧链终止法进行测序,并与NCBI数据库BLAST比对。应用FastANI工具比对分析该院所有分离菌株与不同分支[南亚分支B8441(Ⅰ)、东亚分支B11809(Ⅱ)、南非分支B11221(Ⅲ)、南美分支B11243(Ⅳ)、伊朗分支IFRC2087(Ⅴ)]的全基因组序列,计算平均核苷酸相似度(average nucleotide identity, ANI),比较菌株相似性。
1.5 药敏试验采用最低抑菌浓度(minimum inhibitory concentration, MIC)法对鉴定为耳念珠菌的菌株进行药敏检测。挑取纯培养单个菌落于稀释液瓶内研磨至菌悬液(1个麦氏单位),用药敏液稀释后加入药敏板相应孔位,不干胶封板后上机,35℃孵育24~72 h读取结果。药敏结果根据仪器自带真菌药敏判读标准报告,判读标准参考2020年美国临床实验室标准化协会(Clinical and Laboratory Stan-dards Institute, CLSI)其他念珠菌属的推荐文献[13]。
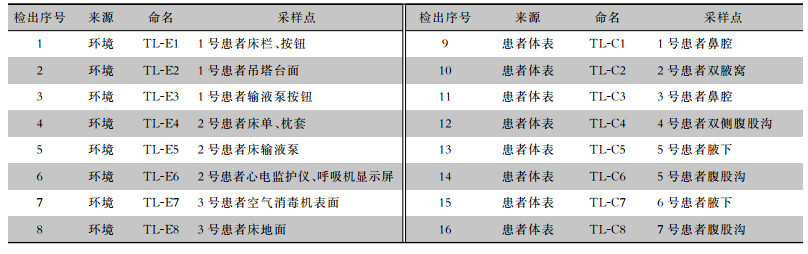
2 结果 2.1 环境/定植耳念珠菌检出情况根据质谱鉴定结果,主动筛查共检出耳念珠菌16株,包括环境来源8株,患者体表来源8株。环境中耳念珠菌检出率为8.3%(8/96),主要集中在1号患者(耳念珠菌感染者)和与其相邻的2号、3号患者的床单元及周围仪器和环境中。14例患者中,7例患者(50.0%)体表检出耳念珠菌,除了1号患者,其余患者体表耳念珠菌均以定植方式存在,并未引起感染,主要检出部位集中在腋窝、腹股沟及鼻腔,口腔及肛门均未检出。见表 1。耳念珠菌在真菌显色培养基上呈奶油或粉色光滑菌落(图 1A),镜下为卵圆形或长圆形酵母孢子(图 1B)。
| 表 1 环境/定植的耳念珠菌检出情况 Table 1 Detection of environmental/colonized C. auris |
|
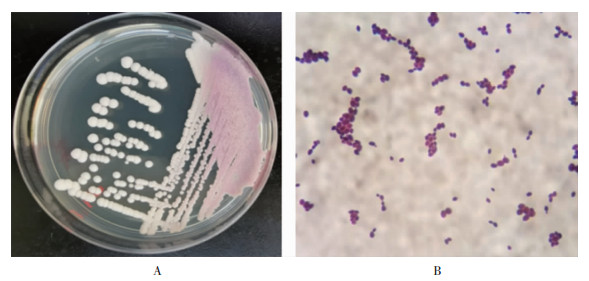 |
| 图 1 耳念珠菌菌落(A)及镜下形态(B) Figure 1 Colony(A) and microscopic (B) morphology of C. auris |
质谱鉴定出16株耳念珠菌,得分值均>2,显示鉴定效果可信。16株环境/定植耳念珠菌及临床分离株的质谱峰形高度相似,其中21个峰具有完全相同的质荷比。比较耳念珠菌与其他种属念珠菌的鉴定峰形发现,耳念珠菌与希木龙念珠菌、克柔念珠菌、白念珠菌和热带念珠菌差异明显,见图 2。Vitek 2 Compact系统鉴定上述16株耳念珠菌,仅5株被鉴定为耳念珠菌,5株被鉴定为希木龙念珠菌,另外6株未鉴定出菌种。
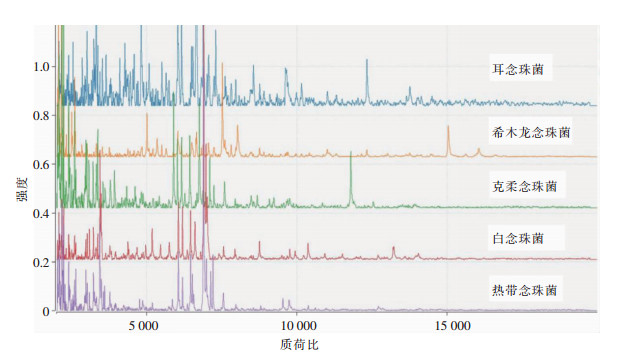 |
| 图 2 不同念珠菌质谱鉴定峰型 Figure 2 Mass spectrometry peak patterns of different C. auris |
16株耳念珠菌分离株ITS区域经扩增后可见单一清晰目的条带,扩增产物序列经BLAST比对,与韩国分离耳念珠菌(GenBank登录号MK294583.1)、印度分离耳念珠菌(GenBank登录号KC692049.1)、中国北京分离耳念珠菌(GenBank登录号MH161341.1/BJCA001)相似性为100%。WGS结果显示,包括1号患者血液中分离株在内的17株耳念珠菌基因组与南亚分离株B8441(Ⅰ)基因组相似性均>99.97%,与东亚分支B11809(Ⅱ)、南非分支B11221(Ⅲ)、南美分支B11243(Ⅳ),以及伊朗分支IFRC2087(Ⅴ)的相似性≤99.60%,进一步证实该院分离的耳念珠菌属于南亚分支。
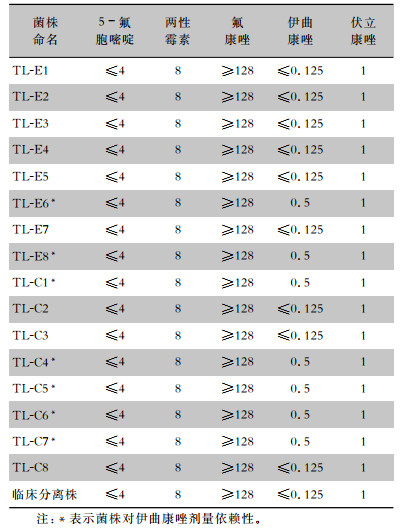
2.4 药敏结果16株环境/定植耳念珠菌及临床分离株药敏结果相似,均对5-氟胞嘧啶和伏立康唑均敏感,均对两性霉素和氟康唑均耐药。2株环境株和5株定植株对伊曲康唑中介,呈药物剂量依赖性,余10株均敏感。见表 2。
| 表 2 17株耳念珠菌对不同抗真菌药物的MIC值(μg/mL) Table 2 MIC values of 17 C. auris strains against different antifungal agents (μg/mL) |
|
耳念珠菌对多种抗真菌药物耐药,且极易对患者周围环境、医务人员高频接触的物体表面,公共医疗器械,以及患者体表等造成污染[14],增加住院患者感染的风险,给医疗机构带来严峻挑战。及时准确地筛查耳念珠菌存在的病区环境,对可能感染/定植的患者进行病原监测,及早确定耳念珠菌存在,并采取隔离、消毒、去定植等措施,可有效阻断其传播。然而,由于环境和体表定植微生物复杂多样,且耳念珠菌用常规检测方法不易检出,从环境和患者体表分离、鉴定耳念珠菌具有一定难度。美国一项研究[15]收集了2016年6月—2018年6月纽约市各医疗单位的540株临床分离株、11 035份患者监测标本和3 672份环境监测标本,其中,对环境标本采用选择性培养和实时PCR检测两种方法进行监测。与金标准培养法相比,实时PCR检测的诊断准确度、灵敏度和特异度分别为98.36%、93.32%和98.38%,是较为理想的快速筛查方法。本研究最初采取直接培养法,即将标本直接接种于真菌显色平板,但真菌生长比例较低,平板通常会被更具生存优势的肺炎克雷伯菌等覆盖,导致耳念珠菌检出率低下;另一方面,可能由于耳念珠菌在抗菌药物的筛选作用下生存优势增加,选择性增菌法具有更高的检出率,更适用于ICU复杂环境的标本检测。但选择性增菌法具有耗时长、成本高的局限性,后期应探索快速筛查方法如实时PCR检测等。
本研究最初针对1号患者以及临近的2、3号患者的环境及体表进行了筛查,发现1号患者鼻腔、床单元、床边仪器均检出耳念珠菌,2、3号患者未感染耳念珠菌,但病床周围环境及患者体表有耳念珠菌检出(2号患者双腋窝,3号患者鼻腔),提示可能存在耳念珠菌的接触性传播。为避免耳念珠菌在病房中暴发,对病房中所有患者体表进行主动筛查后发现另外4例患者体表也有耳念珠菌定植。腹股沟和腋窝耳念珠菌检出率较高,可能因其潮湿较适合耳念珠菌生长,但耳念珠菌定植部位与感染关系还有待进一步探讨。考虑到ICU患者长期卧床,定植的耳念珠菌可随皮肤细胞脱落散布于床单元及周围环境,易带来传播风险,早期根据监测结果采取积极去定植及消杀措施,可有效阻断耳念珠菌传播。
常规真菌鉴定方法无法有效识别耳念珠菌。国内实验室多采用基于生化反应的鉴定系统,对耳念珠菌鉴定率不高,易误判为希木龙念珠菌或假希木龙念珠菌。该院实验室已常规开展质谱用于微生物鉴定,对包括希木龙念珠菌在内的多种酵母菌有良好的区分效果,而Vitek 2 Compact鉴定系统鉴定耳念珠菌效果不佳,提示如用生化方法鉴定出希木龙念珠菌时应考虑进一步排除耳念珠菌的可能。
基因测序是鉴定病原体的可靠方法。ITS序列检测不仅可以鉴定耳念珠菌,还可与GenBank数据库中耳念珠菌任一分支基因序列比对,相似性>98% 则可初步考虑为同一种属[16]。本研究中,16株环境/定植株及临床分离株的ITS序列经BLAST比对,与来自韩国、印度、中国北京的菌株相似性100%,可确认为耳念珠菌。韩国、印度及北京菌株均属南亚分支(Ⅰ),基于ITS序列的初步分析推断该院菌株可能属于南亚分支(Ⅰ)。为进一步研究,将所有菌株行WGS后与其他五种分支耳念珠菌基因组比对,显示该院分离的耳念珠菌临床株和环境/定植株高度同源,且与南亚分支相似性最高(Ⅰ),与南非分支(Ⅲ)、东亚分支(Ⅱ)、南美分支(Ⅳ)、伊朗分支(Ⅴ)的相似性逐级递减,故应均属于南亚分支(Ⅰ)。
我国发现的耳念珠菌大多数仅对氟康唑耐药,少数对两性霉素B和棘白菌素MIC较高[17]。该院临床分离株和环境/定植分离株药敏特点相似,对两性霉素B和氟康唑均耐药,与国内其他耳念珠菌不同;对伊曲康唑敏感,部分中介,具有一定剂量依赖性。该差别可能与菌株的适应性进化相关[18],后续可通过分析耐药基因进一步阐明不同耐药表型的差异原因。此外,我国大多数机构尚未开展棘白菌素的药敏试验,缺少棘白菌素作用效果的试验依据,且目前仍没有专门针对耳念珠菌的药敏判读标准,这些都有待进一步发展。
综上所述,本研究建立了环境/定植来源耳念珠菌的监测方法,发现耳念珠菌易定植于感染患者及临近患者的腹股沟、腋窝和鼻腔中,患者床单元及周边环境也容易出现耳念珠菌污染,为耳念珠菌医院感染目标性监控指明了方向。初步探讨了该院耳念珠菌的耐药性特点及基因组特征,推断菌株为同一来源,为更好控制传染源、切断传播链提供了实验室依据。下一步应建立耳念珠菌的快速筛查方法,针对WGS结果对其耐药性和同源性深入分析,为耳念珠菌的医院感染防控提供技术支持。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Vila T, Sultan AS, Montelongo-Jauregui D, et al. Candida auris: a fungus with identity crisis[J]. Pathog Dis, 2020, 78(4): ftaa034. DOI:10.1093/femspd/ftaa034 |
| [2] |
Cortegiani A, Misseri G, Giarratano A, et al. The global challenge of Candida auris in the intensive care unit[J]. Crit Care, 2019, 23(1): 150. DOI:10.1186/s13054-019-2449-y |
| [3] |
高光俊, 马娟娟, 罗小明, 等. 耳念珠菌在医院感染控制中的研究进展[J]. 中国消毒学杂志, 2021, 38(2): 136-139. Gao GJ, Ma JJ, Luo XM, et al. Research progress of Candida auris in nosocomial infection control[J]. Chinese Journal of Disinfection, 2021, 38(2): 136-139. |
| [4] |
赵伟娜, 张冰, 王启明. 耳念珠菌致病及耐药机制的研究进展[J]. 中国科学(生命科学), 2021, 51(9): 1254-1263. Zhao WN, Zhang B, Wang QM. Mechanisms of pathogenesis and drug resistance in Candida auris[J]. Scientia Sinica(Vitae), 2021, 51(9): 1254-1263. |
| [5] |
Ahmad S, Alfouzan W. Candida auris: epidemiology, diagnosis, pathogenesis, antifungal susceptibility, and infection control measures to combat the spread of infections in healthcare facilities[J]. Microorganisms, 2021, 9(4): 807. DOI:10.3390/microorganisms9040807 |
| [6] |
Wang XJ, Bing J, Zheng QS, et al. The first isolate of Candida auris in China: clinical and biological aspects[J]. Emerg Microbes Infect, 2018, 7(1): 93. |
| [7] |
Chen Y, Zhao JY, Han L, et al. Emergency of fungemia cases caused by fluconazole-resistant Candida auris in Beijing, China[J]. J Infect, 2018, 77(6): 561-571. |
| [8] |
Tian SF, Rong C, Nian H, et al. First cases and risk factors of super yeast Candida auris infection or colonization from Shenyang, China[J]. Emerg Microbes Infect, 2018, 7(1): 128. |
| [9] |
Bing J, Wang SJ, Xu HP, et al. A case of Candida auris candidemia in Xiamen, China, and a comparative analysis of clinical isolates in China[J]. Mycology, 2022, 13(1): 68-75. DOI:10.1080/21501203.2021.1994479 |
| [10] |
杨明明, 段学光, 张省委, 等. 耳念珠菌致血流感染1例[J]. 临床检验杂志, 2022, 40(8): 639-640. Yang MM, Duan XG, Zhang SW, et al. A case of bloodstream infection caused by Candida auris[J]. Chinese Journal of Clinical Laboratory Science, 2022, 40(8): 639-640. |
| [11] |
汪俊, 马亚林, 张德龙, 等. 重症监护病房患者耳念珠菌感染的调查与防控[J]. 中国感染控制杂志, 2023, 22(3): 249-253. Wang J, Ma YL, Zhang DL, et al. Prevention and control of Candida auris infection in patients in intensive care unit[J]. Chinese Journal of Infection Control, 2023, 22(3): 249-253. |
| [12] |
胡必杰, 郭燕红, 高光明, 等. 医院感染预防与控制标准操作规程[M]. 上海: 上海科学技术出版社, 2010: 183. Hu BJ, Guo YH, Gao GM, et al. SOP for infection control and prevention[M]. Shang Hai: Shanghai Scientific and Technical Publishers, 2010: 183. |
| [13] |
CLSI. Performance Standards for Antifungal Susceptibility Testing of Yeasts. 2nd ed[S]. CLSI supplement M60. Wayne, PA: Clinical and Laboratory Standards Institute; 2020.
|
| [14] |
Saris K, Meis JF, Voss A. Candida auris [J]. Curr Opin Infect Dis, 2018, 31(4): 334-340. DOI:10.1097/QCO.0000000000000469 |
| [15] |
Zhu YC, O'Brien B, Leach L, et al. Laboratory analysis of an outbreak of Candida auris in New York from 2016 to 2018: impact and lessons learned[J]. J Clin Microbiol, 2020, 58(4). |
| [16] |
邹玉, 陈宗耀, 鄂建飞, 等. 耳念珠菌实验室鉴定方法的研究进展[J]. 中国真菌学杂志, 2022, 17(5): 414-420, 424. Zou Y, Chen ZY, E JF, et al. Research progress in laboratory identification of Candida auris[J]. Chinese Journal of Myco-logy, 2022, 17(5): 414-420, 424. |
| [17] |
Du H, Bing J, Nobile CJ, et al. Candida auris infections in China[J]. Virulence, 2022, 13(1): 589-591. |
| [18] |
Fisher MC, Alastruey-Izquier do, Berman J, et al. Tackling the emerging threat of antifungal resistance to human health[J]. Nat Rev Microbiol, 2022, 20(9): 557-571. |



