脓毒症是宿主对感染反应失调而导致的危及生命的器官功能障碍,是重症监护病房(ICU)患者的主要死亡原因之一[1]。脓毒症由细菌、病毒、真菌或其他病原体引起,其中细菌感染通常占70%以上[2]。新型冠状病毒感染(COVID -19)大流行期间,全球范围内感染者不断增加,部分患者发展为病毒性脓毒症或继发细菌性脓毒症,进而出现多器官功能衰竭,危及生命[3]。2016年我国一项国家级观察性研究[4]表明,ICU脓毒症的发生率为20.6%(95%CI:15.8%~25.4%),90天死亡率为35.5%。脓毒症的高发病率和高病死率给全球医疗系统带来巨大的疾病负担。因此,尽早发现危重脓毒症患者,把握最佳抢救时间,有利于改善患者预后。
血小板(platelet, PLT)作为重要的免疫细胞之一,在脓毒症患者抗感染过程中的抗感染免疫和凝血方面起着重要作用,与脓毒症病情进展关系密切[5]。近年来,研究关注PLT相关指标对脓毒症患者预后的评估效能,并显示其可以有效地对脓毒症进行预后评估[6-8]。由于数据易获得且检测成本低廉,PLT相关指标可广泛应用于临床。本文阐述了PLT计数、平均PLT体积(mean platelet volume, MPV)、PLT分布宽度(platelet distribution width, PDW)、PLT聚集率(platelet aggregation rate, PAR)等指标对脓毒症预后的评估价值,以期帮助临床医生了解动态监测脓毒症患者PLT相关指标的临床价值,识别高危脓毒症患者。
1 PLT计数对脓毒症预后的评估价值PLT在凝血及抗感染免疫中起关键作用,其数量的减少被认为是脓毒症致死的危险因素之一,临床上常根据PLT减少的程度评估疾病的严重程度[9]。根据SEPSIS-3指南[1],序贯器官衰竭(SOFA)评分可以评估脓毒症的死亡风险,而PLT是SOFA评分中重要的一项,这为PLT用于评估脓毒症预后提供了可能。
随着脓毒症病情进展, 血小板的数量通常呈双相性波动,表现为早期(1~4 d)减少,后期增加[10-12]。这可能是由于脓毒症早期炎症反应广泛,导致血小板快速消耗,而后期由于PLT生成素释放、骨髓活化等原因,PLT生成增多[10, 13]。但严重脓毒症状态下,骨髓中的产PLT巨核细胞功能受到抑制,髓质PLT产生不良,导致PLT持续减少,进而增加28天死亡的风险[12]。研究[6]显示,当PLT<100×109/L时,每减少10×109/L,脓毒症患者28天死亡的风险便增加13%。另一项针对ICU脓毒症休克患者的大型多中心研究[8]发现,PLT≤100×109/L与脓毒性休克发作后28天死亡风险增加独立相关,且死亡风险随着PLT减少严重程度的增加而增加(PLT≤50×109/L VS PLT≥150×109/L;HR, 1.65; 95%CI:1.31~2.08; P < 0.000 1)。
表 1总结了国内外多项利用PLT相关指标预测脓毒症患者死亡的研究结果。虽然不同研究结果存在差异,但足以说明可根据PLT相关指标预测脓毒症患者的预后情况。
| 表 1 PLT相关指标预测脓毒症患者死亡的效能 |
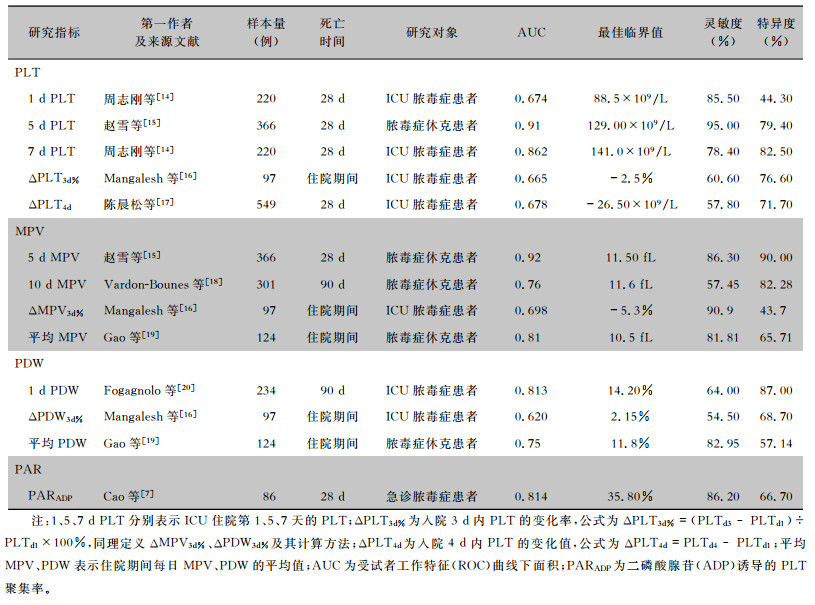
|
MPV代表单个PLT的平均容积,与PDW共同作为PLT容积指标,在临床上常被用于鉴别PLT减少的原因。脓毒症可诱导机体发生多种变化,如微血栓形成、PLT活化(包括过度聚集和破坏)等[21]。在脓毒症进展过程中,PLT消耗增加,骨髓代偿性产生更多的PLT[13]。而新产生的PLT大小不一,形态及功能发生变化,最终会反映在MPV等PLT指标上。因此,临床上常将MPV作为脓毒症患者病情监测的指标之一[22]。
脓毒症患者的MPV与脓毒症的预后相关[16, 18, 23-24]。Vardon-Bounes等[18]研究了脓毒症患者入院后15 d的MPV动力学变化,发现除第三天外,MPV在90天死亡组和存活组中差异显著。Kim等[24]的多因素Cox回归分析结果表明,住院3 d内MPV的增加(ΔMPV3d)是影响脓毒症休克患者预后的独立危险因素。相比于入院基线MPV,ΔMPV3d在ROC曲线分析中表现更佳,其预测脓毒症休克患者28天死亡的AUC更大(0.653 VS 0.698)。
并非任何时间的MPV都是预测脓毒症预后的有效指标。脓毒症患者入院时的MPV不能有效预测脓毒症患者住院死亡,入院第3天以后的MPV与脓毒症预后具有显著相关性[25]。赵雪等[15]比较了入院后不同时间点的MPV对28天死亡的预测效能,发现相比于前四天,入院第五天的MPV(5 d MPV)对脓毒症休克患者28天死亡的预测价值最高,AUC最大。在Vardon-Bounes等[18]的研究中,10 d MPV对脓毒症休克患者90天死亡的预测能力最强。由此可见,尽管MPV预测脓毒症不良预后的最佳时间点尚不能确定,但动态监测MPV对脓毒症预后意义重大。
研究[15-16]显示,脓毒症患者死亡组的MPV在PLT还未出现明显差异时就已维持在较高水平,提示MPV比PLT更加灵敏。然而,MPV对脓毒症患者预后的预测效能受病情严重程度影响,当严重脓毒症患者体内凝血因子和PLT耗尽时,MPV便不再是一个有用的预后预测指标[25]。
3 PDW对脓毒症预后的评估价值PDW是反映血液内PLT容积变异的参数,PLT容积均一性越差,其数值越大。随着脓毒症病程进展,新代偿产生的PLT体积差距增大,引起PDW变化,所以,和MPV一样,PDW也可以反映PLT生成与活化、骨髓代偿的情况。
PDW有助于脓毒症的诊断。Zhang等[26]对PDW进行ROC曲线分析发现,PDW用于诊断脓毒症的AUC为0.64,最佳临界值为13.35%,特异度为84.7%,灵敏度仅为38.3%,诊断准确率为61.5%。但是,当PDW与红细胞分布宽度、中性粒细胞/淋巴细胞计数比值联合应用于脓毒症诊断时,AUC升高为0.704,灵敏度升高为80.0%,诊断的准确率提升为71.4%,特异度为62.8%,故PDW与其他指标联合应用诊断价值可能更高。
PDW对脓毒症/脓毒性休克患者同样具有预后评估价值。多项研究[16, 19-20, 27]发现,脓毒症死亡组的PDW明显高于存活组,PDW增加与更高的病死率相关。其中,Mangalesh等[16]重点关注了患者入院后PDW的动态变化发现,当PDW在入院后前3天的增量(ΔPDW3d%)超过2.15%时,脓毒症患者住院死亡风险便会增加。此外,Fogagnolo等[20]的研究结果显示,1 d PDW是预测ICU脓毒症患者90天死亡的有效指标。
Gao等[19]同时评估了PDW、MPV等指标对脓毒性休克患者住院死亡的预测能力,发现PDW是预测脓毒症休克不良预后的有效指标,但预测能力低于MPV。在Mangalesh等[16]的研究中,ΔPDW3d%预测脓毒症休克患者住院死亡的能力同样低于ΔMPV3d%。
表 2总结了各研究中不同PLT相关指标预测脓毒症患者死亡能力的对比结果。
| 表 2 不同PLT相关指标的对比研究 |
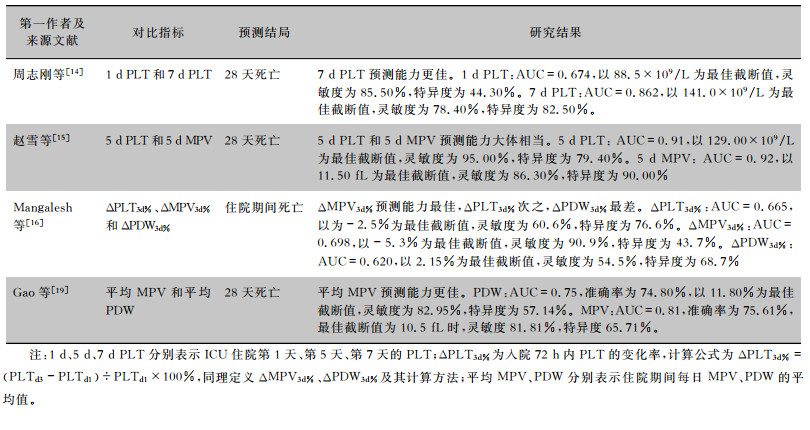
|
PAR能够从一定程度上反映机体的凝血功能。临床上,超过80%的脓毒症患者都存在不同程度的临床或亚临床凝血功能障碍[28]。病情稳定的患者,PAR水平较高,发展为严重脓毒症的患者,PAR水平较低[29],早期检测PAR并及早干预可能成为控制病情的关键。
PAR水平在脓毒症患者中下降,可能归因于产生的多种炎症介质诱导内皮细胞损伤,导致PLT活化,形成微血栓和凝血反应,凝血因子、PLT消耗和内皮功能障碍等多种因素最终造成了PLT低反应性[9, 30]。
PAR可以作为脓毒症的诊断指标。一项回顾性研究用花生四烯酸(AA)、ADP、肾上腺素(EPI)和胶原蛋白(COL)四种不同诱导剂分别诱导脓毒症患者和健康对照组血液中的PLT聚集后检测PAR,结果显示,脓毒症患者的PAR均低于健康对照组,其中,AA诱导的PAR(PARAA)诊断脓毒症的能力最低(AUC=0.653),PAREPI诊断脓毒症的能力最高(AUC=0.715)[31]。
PAR与脓毒症患者的疾病严重程度及病死率有关,故可以用于评估疾病预后[7, 31-32]。既往研究[31-32]表明,与脓毒症28天存活组相比,死亡组中由不同诱导剂(AA、ADP、EPI、COL)诱导的PLT聚集率均显著降低。此外,Cao等[7]通过多因素Cox回归分析和绘制ROC曲线发现,急诊入院24 h内的PARADP是脓毒症患者28天死亡的独立预测因子,具有较好的预测价值。
综上所述,在脓毒症病理、生理发展过程中,多个相互交叉作用的复杂机制共同推动了脓毒症病情的发展与变化,也反映在PLT相关指标中。国内外诸多研究对上述指标的预后预测能力进行了探讨与比较。这些指标中,PLT降低及持续减少可有效预测脓毒症患者预后。相较于PLT,MPV对于脓毒症早期/病情轻的患者具有较好的预测能力。此外,PDW对脓毒症具有较好的诊断性能和一定的预后评估价值,其对脓毒症预后评估方面的能力可能弱于MPV。PAR作为新近应用的评估脓毒症患者病情严重程度和预后的早期预测指标,在指导临床治疗方面有很大的潜力。目前,关于PAR与脓毒症预后关系的研究较少,PAR等代表PLT功能的指标或可成为今后脓毒症预后研究的方向。由病毒或真菌引起的败血症报道较少,目前缺乏有关病毒感染和常见细菌感染所致败血症预后的临床对比数据,故本文未涵盖相关内容。总之,充分了解PLT相关指标的临床价值,有助于准确识别高危脓毒症患者,进而指导临床治疗。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] |
Lin GL, McGinley JP, Drysdale SB, et al. Epidemiology and immune pathogenesis of viral sepsis[J]. Front Immunol, 2018, 9: 2147. DOI:10.3389/fimmu.2018.02147 |
| [3] |
Zhao XF, Wang K, Zuo PY, et al. Early decrease in blood platelet count is associated with poor prognosis in COVID-19 patients-indications for predictive, preventive, and persona-lized medical approach[J]. EPMA J, 2020, 11(2): 139-145. DOI:10.1007/s13167-020-00208-z |
| [4] |
Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
| [5] |
Shannon O. The role of platelets in sepsis[J]. Res Pract Thromb Haemost, 2021, 5(1): 27-37. DOI:10.1002/rth2.12465 |
| [6] |
Wang DN, Wang SN, Wu H, et al. Association between platelet levels and 28-day mortality in patients with sepsis: a retrospective analysis of a large clinical database MIMIC-Ⅳ[J]. Front Med (Lausanne), 2022, 9: 833996. |
| [7] |
Cao Y, Ma WF, Liu ZY, et al. Early predictive value of platelet function for clinical outcome in sepsis[J]. J Infect, 2022, 84(5): 628-636. DOI:10.1016/j.jinf.2022.02.004 |
| [8] |
Thiery-Antier N, Binquet C, Vinault S, et al. Is thrombocytopenia an early prognostic marker in septic shock?[J]. Crit Care Med, 2016, 44(4): 764-772. DOI:10.1097/CCM.0000000000001520 |
| [9] |
Assinger A, Schrottmaier WC, Salzmann M, et al. Platelets in sepsis: an update on experimental models and clinical data[J]. Front Immunol, 2019, 10: 1687. DOI:10.3389/fimmu.2019.01687 |
| [10] |
Rittirsch D, Schoenborn V, Lindig S, et al. Improvement of prognostic performance in severely injured patients by integra-ted clinico-transcriptomics: a translational approach[J]. Crit Care, 2015, 19: 414. DOI:10.1186/s13054-015-1127-y |
| [11] |
Thiolliere F, Serre-Sapin AF, Reignier J, et al. Epidemiology and outcome of thrombocytopenic patients in the intensive care unit: results of a prospective multicenter study[J]. Intensive Care Med, 2013, 39(8): 1460-1468. DOI:10.1007/s00134-013-2963-3 |
| [12] |
Venkata C, Kashyap R, Farmer JC, et al. Thrombocytopenia in adult patients with sepsis: incidence, risk factors, and its association with clinical outcome[J]. J Intensive Care, 2013, 1(1): 9. DOI:10.1186/2052-0492-1-9 |
| [13] |
Kerris EWJ, Hoptay C, Calderon T, et al. Platelets and platelet extracellular vesicles in hemostasis and sepsis[J]. J Investig Med, 2020, 68(4): 813-820. DOI:10.1136/jim-2019-001195 |
| [14] |
周志刚, 谢云, 冯铁男, 等. 血小板计数短期动态变化对ICU脓毒症患者预后的临床预测价值: 一项成人的回顾性队列研究[J]. 中华危重病急救医学, 2020, 32(3): 301-306. Zhou ZG, Xie Y, Feng TN, et al. Clinical predictive value of short-term dynamic changes in platelet counts for prognosis of sepsis patients in intensive care unit: a retrospective cohort study in adults[J]. Chinese Critical Care Medicine, 2020, 32(3): 301-306. DOI:10.3760/cma.j.cn121430-20190909-00069 |
| [15] |
赵雪, 周坤鹏, 李鹏飞, 等. 早期平均血小板体积变化对脓毒症休克患者预后的预测价值[J]. 中华老年多器官疾病杂志, 2021, 20(5): 326-331. Zhao X, Zhou KP, Li PF, et al. Predictive value of early dynamic changes of mean platelet volume in septic shock patients[J]. Chinese Journal of Multiple Organ Diseases in the Elderly, 2021, 20(5): 326-331. |
| [16] |
Mangalesh S, Dudani S, Malik A. Platelet indices and their kinetics predict mortality in patients of sepsis[J]. Indian J Hematol Blood Transfus, 2021, 37(4): 600-608. DOI:10.1007/s12288-021-01411-2 |
| [17] |
陈晨松, 方俊杰, 陈乾峰, 等. 早期血小板计数动态变化对脓毒症患者预后的预测价值[J]. 中华急诊医学杂志, 2022, 31(5): 665-671. Chen CS, Fang JJ, Chen QF, et al. Predictive value of early platelet count dynamic changes for prognosis of sepsis patients[J]. Chinese Journal of Emergency Medicine, 2022, 31(5): 665-671. |
| [18] |
Vardon-Bounes F, Gratacap MP, Groyer S, et al. Kinetics of mean platelet volume predicts mortality in patients with septic shock[J]. PLoS One, 2019, 14(10): e0223553. DOI:10.1371/journal.pone.0223553 |
| [19] |
Gao YX, Li Y, Yu XZ, et al. The impact of various platelet indices as prognostic markers of septic shock[J]. PLoS One, 2014, 9(8): e103761. DOI:10.1371/journal.pone.0103761 |
| [20] |
Fogagnolo A, Taccone FS, Benetto G, et al. Platelet morphological indices on intensive care unit admission predict mortality in septic but not in non-septic patients[J]. Minerva Anes-tesiol, 2021, 87(2): 184-192. |
| [21] |
Zampieri FG, Ranzani OT, Sabatoski V, et al. An increase in mean platelet volume after admission is associated with higher mortality in critically ill patients[J]. Ann Intensive Care, 2014, 4: 20. DOI:10.1186/s13613-014-0020-1 |
| [22] |
Orfanu AE, Popescu C, Leuştean A, et al. The importance of haemogram parameters in the diagnosis and prognosis of septic patients[J]. J Crit Care Med (Targu Mures), 2017, 3(3): 105-110. DOI:10.1515/jccm-2017-0019 |
| [23] |
Vélez-Páez JL, Legua P, Vélez-Páez P, et al. Mean platelet volume and mean platelet volume to platelet count ratio as predictors of severity and mortality in sepsis[J]. PLoS One, 2022, 17(1): e0262356. DOI:10.1371/journal.pone.0262356 |
| [24] |
Kim CH, Kim SJ, Lee MJ, et al. An increase in mean platelet volume from baseline is associated with mortality in patients with severe sepsis or septic shock[J]. PLoS One, 2015, 10(3): e0119437. DOI:10.1371/journal.pone.0119437 |
| [25] |
Tajarernmuang P, Phrommintikul A, Limsukon A, et al. The role of mean platelet volume as a predictor of mortality in critically ill patients: a systematic review and Meta-analysis[J]. Crit Care Res Pract, 2016, 2016: 4370834. |
| [26] |
Zhang HB, Chen J, Lan QF, et al. Diagnostic values of red cell distribution width, platelet distribution width and neutrophil-lymphocyte count ratio for sepsis[J]. Exp Ther Med, 2016, 12(4): 2215-2219. DOI:10.3892/etm.2016.3583 |
| [27] |
Orak M, Karakoç Y, Ustundag M, et al. An investigation of the effects of the mean platelet volume, platelet distribution width, platelet/lymphocyte ratio, and platelet counts on mortality in patents with sepsis who applied to the emergency department[J]. Niger J Clin Pract, 2018, 21(5): 667-671. DOI:10.4103/njcp.njcp_44_17 |
| [28] |
Iba T, Levy JH. Inflammation and thrombosis: roles of neutrophils, platelets and endothelial cells and their interactions in thrombus formation during sepsis[J]. J Thromb Haemost, 2018, 16(2): 231-241. DOI:10.1111/jth.13911 |
| [29] |
Akinosoglou K, Theodoraki S, Xanthopoulou I, et al. Platelet reactivity in sepsis syndrome: results from the PRESS study[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(12): 2503-2512. DOI:10.1007/s10096-017-3093-6 |
| [30] |
Wang YH, Ouyang YQ, Liu BY, et al. Platelet activation and antiplatelet therapy in sepsis: a narrative review[J]. Thromb Res, 2018, 166: 28-36. DOI:10.1016/j.thromres.2018.04.007 |
| [31] |
Wu W, Fan ZL, Yao CJ, et al. Platelet maximum aggregation rate serves as a marker in diagnosis and prognosis in patients with sepsis[J]. Ann Palliat Med, 2020, 9(3): 847-857. DOI:10.21037/apm.2020.04.12 |
| [32] |
Davies GR, Mills GM, Lawrence M, et al. The role of whole blood impedance aggregometry and its utilisation in the diagnosis and prognosis of patients with systemic inflammatory response syndrome and sepsis in acute critical illness[J]. PLoS One, 2014, 9(9): e108589. |



