腺病毒(adenovirus, AdV)科由哺乳动物AdV和禽类AdV两个属组成,其中人腺病毒(human adenovirus,HAdV)是哺乳动物AdV属中的一员。Rowe等[1]在1953年从健康人的萎缩性扁桃体组织中分离培养出一种新型病毒,这是人类历史上首次发现HAdV。Hilleman等[2]又在1954年从急性呼吸道感染患者的咽喉灌洗液中分离出相同病毒。1956年,BALDUCCI等[3]根据病毒经常存在于腺体,且第一次就是在腺体组织中分离获得的事实,命名其为HAdV。
最初,根据HAdV被特定动物抗血清中和的能力分成为69种HAdV血清型。又根据其凝集人类、大鼠和猴红细胞的能力以及它们在啮齿动物中的致癌性,HAdV可以进一步细分为7个亚组(A~G)。不同亚组与它们的组织嗜性和临床特性之间存在一些特异的相关性,B1、C和E亚组主要引起呼吸系统疾病,而B、D、E亚组可诱发眼部疾病,F亚组是肠胃炎的病因,B2亚组主要感染泌尿道、膀胱及肾脏。
HAdV是无包膜的双链链状DNA病毒,常感染人呼吸道、胃肠道、泌尿道和结膜等部位,引起相关部位致病[4],罕见的临床疾病还包括出血性膀胱炎、出血性肠炎、肝炎、肾炎、胰腺炎、脑炎等,并可造成全世界范围暴发流行,在大规模流行过程中,其所致的病死率较高[5-6]。而由于婴幼儿免疫功能尚未发育完全,缺乏相应的体液及细胞免疫,因此,HAdV感染的易感人群多为婴幼儿[7]。
HAdV感染暴发通常发生于健康的儿童、成年人或居住在拥堵或封闭场所的人群中。当免疫功能受损的患者[如先天性免疫缺陷综合征、人类免疫缺陷病毒(HIV)感染和器官移植]感染HAdV时,其临床表现往往更为严重,弥漫性感染更强[8-10]。
1 HAdV的基本结构表征根据X射线和透射电子显微镜(Cryo-EM)的测定结果,HAdV是一种无包膜的双链DNA病毒,直径约90~100 nm,基因组全长约36 kb,可编码40多种不同的蛋白质[11]。AdV基因组包含早期转录的E1A、E1B、E2A、E2B、E3、E4基因以及晚期表达的HAdV组装相关L1(pⅢa)、L2(pⅤ,pⅦ,pⅩ,Penton)、L3(pⅥ, Hexon, EP)、L4(pⅧ)、L5(Fiber)基因。
HAdV病毒颗粒呈球形结构,无包膜,衣壳中为病毒核心,由裸露双链线状DNA与核心蛋白共同组成。衣壳由252个壳粒子组成,呈二十面体立体对称结构,二十面体中的每个面由12个重复拷贝的伪六角形的三聚体六邻体构成,并且12个角顶点由五聚体齐聚物形成,每个齐聚物都具有一个或多个拷贝的非共价结合的三聚体纤维穗。每个齐聚物由4个环(loop1-4)组成,齐聚物基底部包含P1、P2部分。纤维状突起是从衣壳表面延伸到每个五邻体基部的线性突起,长度约为8.5~76.5 nm,包括头部区域和柄结构纤维,其长度取决于轴上的β螺旋重复数和ADV型别。纤维的长度和形状,以及三种主要衣壳蛋白高变区的序列变异,至少部分决定了不同血清型的进入途径和免疫学特征[12-13]。见图 1。
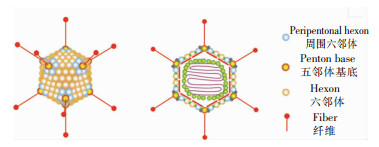 |
| 图 1 HAdV的基本结构表征 |
HAdV有13种结构蛋白,包含3种主要衣壳蛋白(三聚体六邻体、五邻体齐聚物、纤维状突起)、6种核心蛋白(Ⅴ、Ⅶ、Mu、TP、Ⅳ、Caspases)和4种次要衣壳蛋白(Ⅲa、Ⅷ、Ⅵ、Ⅸ)。主要衣壳蛋白的作用是介导病毒胞内化的过程,而次要衣壳蛋白则有助于稳定病毒颗粒,两者共同参与病毒脱壳及胞内体破坏的过程。核心蛋白的目的是将病毒DNA转移到细胞核中,使病毒DNA随宿主细胞的复制而增殖,并协助病毒DNA与衣壳的组装[11]。
2 HAdV感染流行病学特点HAdV可感染人呼吸道、胃肠道、泌尿道和结膜等部位并引起相关部位致病,当人体免疫功能正常时,感染HAdV后症状较轻,常能自愈,具有自限性[14]。HAdV血清型有多种,不同类型的HAdV所具有的组织嗜性不同,导致各亚群不同HAdV血清型引起的临床表现不同。见表 1。
| 表 1 不同血清型HAdV感染的临床表现 |
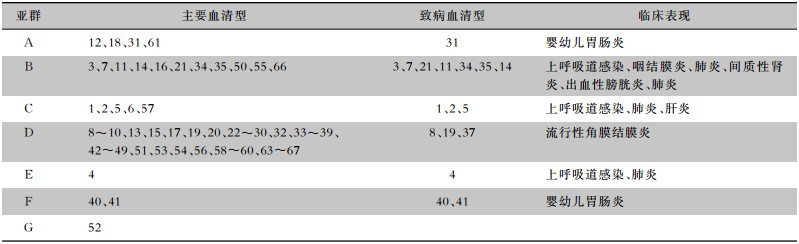
|
同一亚属的AdV在许多生化、生物学和免疫学特性上彼此相似。因此,亚属内的物种在致病和流行病学行为上相似,而与亚属外的物种不同。(1)A亚属病毒表现独特,主要感染婴儿。其与肠道和胃肠炎密切相关,在南半球较为罕见。(2)B亚属病毒中,尤其是HAdV3和HAdV7主要感染学龄儿童,其多见于上呼吸道感染及泌尿道感染。(3)C亚属主要暴发于冬末月份,儿童发病率较高,各年龄段均易合并胃肠道疾病,其他脏器系统疾病随年龄变化而不同,同时,C亚属的个体成员往往表现出一致的行为,但在呼吸道感染中,其在种间的分布有所差异。(4)D亚属病毒多见于成人。与呼吸道标本相比,它们更多地是从粪便和眼部标本中分离出来,主要与眼部感染有关。(5)E亚属的唯一成员HAdV4在儿童和成人的临床症状上具有明显的概率分布,这是其他HAdV所不具备的。HAdV4主要感染成人,而成人相对婴幼儿免疫系统更完善,这可能也是HAdV4感染病死率较低的原因。
自从HAdV被发现并命名后,在全球范围内的不同时间段都发生过不同亚型HAdV的暴发或流行[15]。19世纪50~60年代,关于HAdV感染的研究和报道从欧洲延伸到了美洲,再到亚洲的中国大陆、中国台湾、日本、新加坡等地[16-19]。欧洲和美国等地区的研究[20]表明,HAdV-7型通常在学校、医院及军队等人群密集的场所暴发感染。HAdV-7造成的呼吸道感染常会发展为致命性的下呼吸道疾病,与预后极差的重症肺炎密切相关[21-23]。
美国在2014年正式启动对HAdV感染的流行病学监测工作,而在我国由于HAdV不属于法定的传染病范畴,因此很少对HAdV感染进行系统性监测,只有部分地区的病毒实验室会对当地流行的HAdV进行监测[24]。在我国,HAdV的流行具有一定的季节性,北方地区多在冬春季节出现流行,而南方地区则多在春夏季节出现流行,且不同地区HAdV流行的亚型有所不同。我国西北部地区及北部地区以HAdV-7型为主要流行的亚型,南部地区以HAdV-3型为主要流行的亚型,东部地区则以HAdV-1、HAdV-2和HAdV-5型为主要流行的亚型[25]。在19世纪50~60年代,我国北方地区曾出现HAdV感染的暴发流行,80年代以后感染率逐渐下降,但近几年HAdV感染率又有所回升[26]。2009—2012年,重庆地区报道了HAdV感染流行情况,其中HAdV-7型为主要流行的亚型,其次是HAdV-3型和HAdV-55型[27];2011—2014年,广州地区报道了HAdV感染造成的HAdV肺炎出现暴发性流行的情况,累计感染542例儿童,其中92.1%的儿童年龄<6岁[28];2017—2018年,北京地区报道了HAdV流行情况,感染的儿童年龄均≤6岁,其中HAdV-3型为主要流行的亚型[29]。
3 HAdV的致病性HAdV可在呼吸道、胃肠道、膀胱和眼睛的上皮细胞中感染和复制,当HAdV进入人体后,可按进入方式在结膜、咽部或小肠的上皮细胞中繁殖,然后扩散至局部淋巴结,但HAdV通常不会扩散到局部淋巴结之外。
3.1 HAdV对呼吸系统的致病性5%~10%的儿童和1%~7%的成人呼吸道感染是HAdV感染所引起,其主要症状是发热、咳嗽、咽炎、咽痛、扁桃体炎,部分合并肺炎,大多数病例还伴有胃肠道症状[30]。高达20%的儿童HAdV病毒感染可引起肺炎(尤其是新生儿和婴儿),病死率高出普通人群50%,主要包含B亚群(HAdV3、HAdV7、HAdV14、HAdV16、HAdV21)、C亚群(HAdV1、HAdV2)和E亚群(HAdV4),而在免疫功能正常的儿童和成人中比较少见[31]。少部分免疫功能低下的患者合并发生HAdV肺炎时,会引起弥漫性肺部疾病、严重呼吸功能衰竭,其中重症HAdV肺炎的病死率可超过50%[32]。除此之外,HAdV感染呼吸道后可造成潜伏性或持续性感染,当儿童呼吸道持续性HAdV感染,其持续致病性可进一步导致闭塞性细支气管炎、支气管炎和肺气肿,继发细菌性支气管炎。13%~20%的慢性梗阻性肺疾病(COPD)成人可能会持续检测出HAdV[32]。
3.2 HAdV对消化系统的致病性HAdV感染可引起胃肠道症状,尤其是在婴幼儿中更为常见,病毒性胃肠炎中肠道腺病毒(EAdV)检出率达10%,主要血清型为HAdV-40、HAdV-4,少数为HAdV-31[33]。EAdV所引起的急性胃肠炎广泛分布于世界各地,在婴幼儿人群的发病率次于诺如病毒(NV)和轮状病毒(RV)所致的肠胃炎。发病年龄集中在0~2岁。HAdV的潜伏期约为一周,主要症状为呕吐、腹泻、稀便或水样便,合并有肠系膜淋巴结炎可引起更加严重的肠套叠,持续1~2 d,少数伴有发热,病程持续约4~8 d[34]。
3.3 HAdV对泌尿系统的致病性HAdV也可见于尿路感染,尤其是在接受实质性器官移植或造血干细胞移植的免疫力低下患者中更为常见[34]。典型症状包括排尿困难、血尿、蛋白尿和出血性膀胱炎。肾活检可显示患者有病毒性肾病[35]或移植排斥反应(在肾移植患者中)[36]。大多数尿路感染可自行消退,也可进一步恶化为尿路梗阻、坏死性肾小管间质性肾炎和肾衰竭。
3.4 HAdV对结膜的致病性HAdV所引起的病毒性结膜炎是最常见的传染性结膜炎,其主要是通过手眼接触,眼分泌物、呼吸道飞沫以及与眼科护理人员及其医疗器械的接触。眼AdV感染最常见的表现是流行性角结膜炎,其次是咽结膜热,其中流行性角结膜炎也是最严重的一种,表现为水样分泌物、充血、水肿和同侧淋巴结肿大,而咽结膜热的特点是突然出现高热、咽炎、双侧结膜炎和耳周淋巴结肿大。然而,大多数结膜HAdV感染的病例是自限性的,无并发症的病例无需治疗[34]。
3.5 HAdV感染中罕见的致病性HAdV感染中罕见的致病性包括肺功能发育不良[37]、婴幼儿肠套叠及猝死[38]、脑炎[39]、心肌炎和心肌病[40],以及单核细胞增多症样综合征[41]。
4 HAdV的致病机制 4.1 HAdV感染机制HAdV感染宿主细胞主要涉及以下几个阶段[42]:(1)HAdV以纤维状突起与细胞表面的Coxsackie-HAdV受体(CAR)或桥粒芯糖蛋白2(DSG2)相结合,使得HAdV黏附在细胞表面;(2)HAdV的五邻体齐聚物与细胞膜上的次级αv整合素受体相结合,通过动力蛋白依赖或非动力蛋白依赖的内吞作用介导病毒的胞内化;(3)HAdV开始利用内部蛋白VI的两亲性螺旋破坏胞内体膜,其纤维释放和VI暴露是通过运动的CAR和静止的整合素受体的机械信号发生,由此CAR拉动病毒颗粒对抗整合素的持力;(4)脱包膜的病毒沿着微管通过动力蛋白被转运到复杂的细胞核心孔;(5)HAdV的双链DNA经细胞核的复杂孔道转运到细胞核内,并最终在整合酶的作用下整合到宿主细胞的染色体基因上[43]。
4.2 HAdV复制增殖机制HAdV的复制增殖周期分为两个阶段:早期和晚期。在HAdV复制增殖的早期,4个基因组区域(E1-E4)在DNA复制前转录并翻译早期表达调节蛋白(E1A-E4A),HAdV的早期调控机制开始于感染后7 h,其功能是激活其他病毒基因,避免受感染细胞过早死亡,并改变宿主蛋白的表达以进行DNA合成。DNA复制成分准备好,即可开始复制。晚期启动子(MLP)介导晚期病毒基因的转录,主要是5个区域(L1-L5)在DNA复制开始后转录,这些基因编码病毒结构蛋白和用于病毒颗粒成熟的蛋白质。病毒组装成其病毒粒子并通过病毒诱导的细胞裂解释放以感染其他细胞。
HAdV的E3区基因能表达10.4K/14.5K异源二聚体,其可通过刺激内体介导的表皮生长因子受体(EGF-R)内化,下调HAdV感染细胞的表皮生长因子受体(EGF-R),其配体激活表皮生长因子受体可诱导细胞增殖。除此之外,10.4K/14.5K异源二聚体还可通过模仿EGF并激活静止细胞以获得最佳病毒复制而发挥作用[44]。
4.3 HAdV引起组织损伤机制在先天性免疫应答中,(1)HAdV的E1A基因激活E2F1和随后的E2F1诱导型miRNA-93、miRNA-106b的上调有效抑制p21表达,导致p53诱导的细胞凋亡和自噬增强,引起组织细胞损伤[45],见图 2。(2)HAdV感染宿主细胞后,宿主细胞会发生适应性自噬,导致宿主细胞自噬调节紊乱;同时,HAdV进入溶酶体后,在酸性环境下会改变AdV衣壳的构象,所释放的顶体蛋白可以破坏胞内体膜,共同引起细胞坏死[46]。(3)HAdV通过Toll样受体(TLR)和非TLR依赖性途径直接激活巨噬细胞和树突细胞(DC),促进促炎细胞因子的合成与释放,促进白细胞介素(IL)-1β成熟,促进IL-6和肿瘤坏死因子-α(TNF-α)以及α干扰素(IFN-α)的分泌,其中IFN-α的产生强烈依赖于细胞质DNA传感器环状GMP-AMP合成酶(CGAS)或识别未甲基化的CpG双链DNA的胞质DNA传感器TLR9。这些细胞因子进一步加速白细胞的浸润,从而导致组织细胞破坏、坏死[47]。(4)HAdV可激活巨噬细胞中的炎症介质NALP3,后者参与宿主细胞吞噬体和吞噬溶酶体的成熟,最终造成组织细胞损伤。HAdV可促进高迁移率蛋白B1(HMGB1)释放至胞外,后者与细胞表面的跨膜蛋白TLR、晚期糖基化终产物受体(RAGE)等结合,激活胞内MAPK、NF-κB等细胞通路,进一步促使IL-6、IL-8、TNF-α等致炎因子大量合成及释放,引起晚期炎症反应,加重组织细胞的损伤[48-49]。
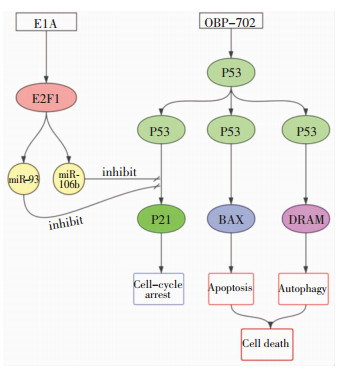 |
| 图 2 HAdV通过E1A基因诱导细胞凋亡和自噬机制 |
适应性免疫应答为:(1)HAdV所诱导激活的细胞毒性T淋巴细胞(CTL)通过释放穿孔素、丝氨酸酯醇及诱导死亡受体FAS/FASL表达等方式促进靶细胞凋亡,溶解感染HAdV的宿主细胞,使宿主细胞损伤[50]。(2)HAdV感染促进浆细胞的形成,浆细胞产生的IgE抗体Fc段与肥大细胞、嗜酸性粒细胞等相结合,待机体再次接触变应原时,变应原特异性结合到IgE抗体的Fab段,促进肥大细胞、嗜酸性粒细胞等释放炎性介质和细胞因子[51]。(3)HAdV感染促使CD4+/CD8+的比值降低,进一步引起Th1/Th2亚群比例失调,后者引发体内细胞因子失衡,促进嗜酸性粒细胞浸润,引发变异性炎症[52]。
α-醇溶蛋白是一种已知能激活乳糜泻的α-醇溶蛋白成分,HAdV-12的E1b蛋白与α-醇溶蛋白存在氨基酸同源性,当机体感染HAdV时,在适应性免疫中与E1b蛋白的抗体会与α-醇溶蛋白产生交叉反应,激活α-醇溶蛋白,最终引起乳糜泻的发生[53]。
HAdV感染可使β-肾上腺素能神经纤维兴奋性降低、使M胆碱能受体增敏,使副交感神经胆碱能纤维兴奋性增加并减弱抑制性非肾上腺素能非胆碱能(i-NANC)作用,从而刺激气道平滑肌收缩,抑制舒张,最终诱导哮喘的发生[54-55]。HAdV增殖周期中产生的RNA分子可以被TLR和细胞内病毒传感器如蛋白催化酶(PKR)等传感器所识别,从而激活不同的信号通路和下游效应子,后者诱导MUC5AC黏蛋白的产生,导致气道上皮黏液分泌过多,加重哮喘的症状[56]。
4.4 HAdV逃避宿主免疫应答机制HAdV无处不在的本质和它们在宿主中持续存在的能力反映了它们作为病原体的成功。HAdV已经进化出多种策略,使它们能够逃避宿主先天的和适应性的免疫反应。(1)HAdV的E1A基因通过抑制肿瘤坏死因子相关的凋亡诱导配体(TRAIL)所诱导的caspase-8、caspase-9和Apaf-1激活,同时E1A基因还可以通过阻断干扰素刺激基因因子3(ISGF3),从而抑制干扰素对HAdV的抑制作用[57],见图 3。(2)HAdV的E1B基因可编码19、55kD两种蛋白,共同保护细胞免受细胞因子所诱导的细胞凋亡,19kD蛋白的抗凋亡作用与细胞原癌基因HCl-2相似,其可与BAK蛋白相结合,抑制其促凋亡作用,而55kD蛋白通过与p53结合并阻断其转录功能而直接阻断p53所诱导的细胞凋亡作用[58-59]。(3)HAdV的E3基因可表达一种大小为19kD的糖蛋白,后者在HAdV感染早期大量表达,其可与MHC-I类分子相结合,同时,I9kD糖蛋白在其C末端附近含有一个特定的序列,后者可锚定在内质网的膜上,因此I9kD糖蛋白将结合的MHC-I类分子保留在内质网中,阻止其转运到细胞表面,从而抑制CD8+T细胞对受病毒感染的宿主细胞的杀伤作用。(4)HAdV的E3基因能通过表达10.4、14.5、14.7kD三个产物,来保护细胞免受TNF诱导的细胞裂解功能,其中10.4、14.5kD蛋白作为一个复合物共同作用,而14.7kD蛋白单独起作用保护细胞免受TNF的侵袭。(5)HAdV的E4开放阅读框3蛋白(ORF3)通过诱导早幼粒细胞白血病蛋白(PML)小体重排及损伤PML的致癌结构(POD)的完整性,抑制干扰素(IFN)对受病毒感染细胞的免疫作用,从而降低机体的先天免疫应答效应[60-62]。(6)HAdV通过聚乙二醇反应(PEG)和聚N-(2-羟丙基)甲基丙烯酰胺反应(PHPMA)修饰病毒表面蛋白,阻断AD抗体结合到病毒表面,从而使病毒逃避宿主的免疫应答[63]。(7)HAdV通过将聚乙烯亚胺(PEI)、聚L-赖氨酸(PLL)等阳离子聚合物共价包裹在病毒体表面,使病毒颗粒电荷从阴离子改变为阳离子,阻断天然受体介导的病毒颗粒内吞,随后增加柯萨奇病毒-腺病毒受体(CAR)缺陷细胞对病毒的摄取,从而使病毒逃避宿主的免疫应答[64]。
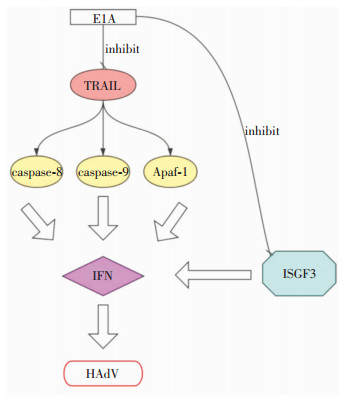 |
| 图 3 E1A基因参与免疫逃逸机制 |
由于HAdV感染缺乏被批准的用于治疗的抗病毒药物,且在1950—1960年,HAdV-4和HAdV-7型被认为是美国新兵人群中引起呼吸道疾病的最重要病毒株,高达70%的呼吸道疾病与该病原体有关。美国随即组织了对HAdV-4和HAdV-7型HAdV疫苗的开发[65-66]。最初研究的类型是灭活的肠外疫苗,但研究发现疫苗接种后,HAdV生长细胞系中的污染物有潜在的致癌性,阻碍其应用。随后尝试用有活性的野生型HAdV-4和HAdV-7型株进行肠道感染,发现其血清转化率很高,且几乎无不良反应,对未接种疫苗的个体传染率极低。然而,单独使用HAdV-4型口服疫苗会增加HAdV-7型相关疾病的发病率。进一步研究[67]表明,针对HAdV-4型和HAdV-7型口服HAdV疫苗不仅安全,而且在减少新兵急性呼吸道感染方面非常有效。1971年,美国新兵训练营开始常规口服HAdV-4和HAdV-7型疫苗,使得HAdV感染率降低了96%。由一家新制造商生产,经过新一轮临床试验,针对HAdV-4型和HAdV-7型的非减毒活疫苗制剂于2011年10月重新引入美国,用于军事用途。针对HAdV-4和HAdV-7型的抗体可能具有交叉保护免受其他血清型(例如HAdV-3)的侵袭[68]。综上所述,口服活疫苗在降低呼吸道HAdV感染风险方面非常有效,并且在美国军队中属于常规防疫手段,但目前还未应用于社区。
4.6 HAdV载体疫苗的进展HAdV最初被用作基因治疗的载体。近年来,随着对转基因产品的安全性和高免疫原性的下一代载体开发,其作为疫苗载体的实用性不断增加。目前正在开发的以HAdV作为载体的疫苗,不仅可以用于预防各种传染病,还可以用于癌症的预防。
为了在人体中安全有效地使用HAdV载体疫苗,作为载体的HAdV基因组已通过基因工程进行编辑。第一代HAdV载体是基于E1/E3缺失的HAdV开发的,用于转基因插入复制缺陷特性和提高免疫原性。然而,在这一代中,由于载体基因组和插入包装细胞系HEK293的E1部分具有同源性,很可能会出现具有复制能力的HAdV(RCA)。在生产中使用具有最小同源性的细胞系能在一定程度上解决这个缺点。在第二代HAdV载体疫苗中,通过额外删除HAdV基因组E2/E4位点,进一步增加转基因能力,并且可能降低RCA形成的可能性。然而,由于生产细胞系的复制能力降低,总产量低于第一代HAdV载体。第三代HAdV载体也称为辅助依赖性HAdV载体,因为它们是通过删除几乎所有HAdV基因组序列而创建,除了保留包装必需的序列,例如反向末端重复序列。此外,其具有高容量,可插入多个转基因表达盒,但制造难度更大,免疫原性低于前代产品。
目前,基于HAdV载体开发的疫苗种类有:(1)第一个批准用于人类预防的基于HAdV载体的疫苗是名为Ad26.ZEBOV的埃博拉病毒疫苗[69];(2)HAdV载体具有的高免疫原性使得HIV-1疫苗具有优秀的预防感染功效[70];(3)关于预防丙型肝炎和流感的HAdV载体疫苗也在开发中,HAdV载体能刺激诱导广泛的交叉反应性T细胞免疫,对此类持续感染和高突变性抗原感染有较好的保护作用[71-72];(4)目前通过大规模临床试验评估的新型冠状病毒疫苗,绝大部分的疫苗载体均为重组腺载体,疫苗对T细胞和中和抗体反应均是安全的且具有免疫原性。以HAdV为载体的新型冠状病毒疫苗有效预防了新型冠状病毒感染和重症的发生[73]。
5 展望到目前为止,研究者对HAdV的致病性及致病机制已经有了深入地了解,但还有其他许多分子层面机制值得进一步深入研究,例如:HAdV在胞内酸性环境下脱衣壳中触发的结构变化及其精确位置,脱衣壳的HAdV被动力蛋白转运启动过程中所触发的信号通路,HAdV的DNA通过胞核的复杂孔转运到细胞核心的机制,HAdV的DNA双链与细胞核心蛋白Ⅴ、Ⅶ、Mu结构的结合位点及其是否有特异性结合受体或其他结合受体,HAdV引起胃肠道致病及眼部致病的具体机制以及如何防范HAdV通过多种途径逃避宿主免疫应答,进一步探究有助于指导临床更好地进行抗HAdV治疗,临床开发新型抗HAdV药物以及合理设计更安全有效的HAdV载体和疫苗。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Rowe WP, Huebner RJ, GILMORE LK, et al. Isolation of a cytopathogenic agent from human adenoids undergoing spontaneous degeneration in tissue culture[J]. Proc Soc Exp Biol Med, 1953, 84(3): 570-573. DOI:10.3181/00379727-84-20714 |
| [2] |
Hilleman MR, Werner JH. Recovery of new agent from patients with acute respiratory illness[J]. Proc Soc Exp Biol Med, 1954, 85(1): 183-188. DOI:10.3181/00379727-85-20825 |
| [3] |
Balducci D, Tyrrell DA, Zaiman TE. Acute infections of the respiratory tract and the adenoviruses[J]. Lancet, 1956, 271(6957): 1326-1330. |
| [4] |
Arnold J, Jánoska M, Kajon AE, et al. Genomic characterization of human adenovirus 36, a putative obesity agent[J]. Virus Res, 2010, 149(2): 152-161. DOI:10.1016/j.virusres.2010.01.011 |
| [5] |
Ishiko H, Aoki K. Spread of epidemic keratoconjunctivitis due to a novel serotype of human adenovirus in Japan[J]. J Clin Microbiol, 2009, 47(8): 2678-2679. DOI:10.1128/JCM.r00313-09 |
| [6] |
Walsh MP, Seto J, Jones MS, et al. Computational analysis identifies human adenovirus type 55 as a re-emergent acute respiratory disease pathogen[J]. J Clin Microbiol, 2010, 48(3): 991-993. DOI:10.1128/JCM.01694-09 |
| [7] |
Ison MG, Hayden RT. Adenovirus[J]. Microbiol Spectr, 2016, 4(4). Doi: 10.1128/microbiolspec. Online ahead of print.
|
| [8] |
Engen RM, Huang ML, Park GE, et al. Prospective assessment of adenovirus infection in pediatric kidney transplant recipients[J]. Transplantation, 2018, 102(7): 1165-1171. DOI:10.1097/TP.0000000000002100 |
| [9] |
Symeonidis N, Jakubowski A, Pierre-Louis S, et al. Invasive adenoviral infections in T-cell-depleted allogeneic hematopoietic stem cell transplantation: high mortality in the era of cidofovir[J]. Transpl Infect Dis, 2007, 9(2): 108-113. DOI:10.1111/j.1399-3062.2006.00184.x |
| [10] |
Kim YJ, Boeckh M, Englund JA. Community respiratory virus infections in immunocompromised patients: hematopoietic stem cell and solid organ transplant recipients, and individuals with human immunodeficiency virus infection[J]. Semin Respir Crit Care Med, 2007, 28(2): 222-242. DOI:10.1055/s-2007-976494 |
| [11] |
黄国虹, 许文波. 腺病毒新型别的研究进展[J]. 病毒学报, 2013, 29(3): 342-348. Huang GH, Xu WB. Recent advance in new types of human adenovirus[J]. Chinese Journal of Virology, 2013, 29(3): 342-348. DOI:10.13242/j.cnki.bingduxuebao.002397 |
| [12] |
Adhikary AK, Banik U, Okabe N, et al. Molecular characteri-zation of human adenovirus type 8 (HAdV-8), including a novel genome type detected in Japan[J]. Jpn J Infect Dis, 2011, 64(6): 493-498. DOI:10.7883/yoken.64.493 |
| [13] |
Selvaraju SB, Kovac M, Dickson LM, et al. Molecular epidemiology and clinical presentation of human adenovirus infections in Kansas City children[J]. J Clin Virol, 2011, 51(2): 126-131. DOI:10.1016/j.jcv.2011.02.014 |
| [14] |
Greber UF, Flatt JW. Adenovirus entry: from infection to immunity[J]. Annu Rev Virol, 2019, 6(1): 177-197. DOI:10.1146/annurev-virology-092818-015550 |
| [15] |
Lynch JP 3rd, Kajon AE. Adenovirus: epidemiology, global spread of novel types, and approach to treatment[J]. Semin Respir Crit Care Med, 2021, 42(6): 800-821. DOI:10.1055/s-0041-1733802 |
| [16] |
Pscheidt VM, Gregianini TS, Martins LG, et al. Epidemiology of human adenovirus associated with respiratory infection in southern Brazil[J]. Rev Med Virol, 2021, 31(4): e2189. |
| [17] |
Mennechet FJD, Paris O, Ouoba AR, et al. A review of 65 years of human adenovirus seroprevalence[J]. Expert Rev Vaccines, 2019, 18(6): 597-613. DOI:10.1080/14760584.2019.1588113 |
| [18] |
Heindl LM, Augustin AJ, Messmer EM, et al. ADenoVirus initiative study in epidemiology (ADVISE)-results of a multicenter epidemiology study in Germany[J]. Graefes Arch Clin Exp Ophthalmol, 2019, 257(1): 249-251. DOI:10.1007/s00417-018-4150-2 |
| [19] |
Lin GL, Lu CY, Chen JM, et al. Molecular epidemiology and clinical features of adenovirus infection in Taiwanese children, 2014[J]. J Microbiol Immunol Infect, 2019, 52(2): 215-224. DOI:10.1016/j.jmii.2018.07.005 |
| [20] |
Killerby M E, Rozwadowski F, Lu X, et al. Respiratory illness associated with emergent human adenovirus genome type 7d, New Jersey, 2016-2017[J]. Open Forum Infect Dis, 2019, 6(2): z17. |
| [21] |
Yang XX, Wang QS, Liang BB, et al. An outbreak of acute respiratory disease caused by a virus associated RNA Ⅱ gene mutation strain of human adenovirus 7 in China, 2015[J]. PLoS One, 2017, 12(2): e0172519. DOI:10.1371/journal.pone.0172519 |
| [22] |
Ng OT, Thoon KC, Chua HY, et al. Severe pediatric adenovirus 7 disease in Singapore linked to recent outbreaks across Asia[J]. Emerg Infect Dis, 2015, 21(7): 1192-1196. |
| [23] |
Lamson DM, Kajon A, Popowich M, et al. Human adenovirus 7d strains associated with influenza-like illness, New York, USA, 2017-2019[J]. Emerg Infect Dis, 2020, 26(5): 1047-1049. DOI:10.3201/eid2605.200116 |
| [24] |
宫占威, 梁婷, 皇甫超济. 人腺病毒引起的呼吸道传染病防治研究进展[J]. 人民军医, 2020, 63(1): 84-87, 95. Gong ZW, Liang T, Huangfu CJ. Research progress on prevention and treatment of respiratory infectious diseases caused by human adenovirus[J]. People's Military Surgeon, 2020, 63(1): 84-87, 95. |
| [25] |
Li YM, Zhou WM, Zhao YJ, et al. Molecular typing and epidemiology profiles of human adenovirus infection among paedia-tric patients with severe acute respiratory infection in China[J]. PLoS One, 2015, 10(4): e0123234. DOI:10.1371/journal.pone.0123234 |
| [26] |
段亚丽, 谢正德. 我国呼吸道感染人腺病毒的基因型流行概况[J]. 中华实验和临床病毒学杂志, 2018, 32(4): 430-434. Duan YL, Xie ZD. Prevalence of different genotypes of human adenovirus in patients with respiratory infection in China[J]. Chinese Journal of Experimental and Clinical Virology, 2018, 32(4): 430-434. |
| [27] |
Lu QB, Tong YG, Wo Y, et al. Epidemiology of human adenovirus and molecular characterization of human adenovirus 55 in China, 2009-2012[J]. Influenza Other Respir Viruses, 2014, 8(3): 302-308. DOI:10.1111/irv.12232 |
| [28] |
Wu PQ, Zeng SQ, Yin GQ, et al. Clinical manifestations and risk factors of adenovirus respiratory infection in hospitalized children in Guangzhou, China during the 2011-2014 period[J]. Medicine (Baltimore), 2020, 99(4): e18584. DOI:10.1097/MD.0000000000018584 |
| [29] |
Yao LH, Wang C, Wei TL, et al. Human adenovirus among hospitalized children with respiratory tract infections in Beijing, China, 2017-2018[J]. Virol J, 2019, 16(1): 78. DOI:10.1186/s12985-019-1185-x |
| [30] |
Ryan MAK, Gray GC, Smith B, et al. Large epidemic of respiratory illness due to adenovirus types 7 and 3 in healthy young adults[J]. Clin Infect Dis, 2002, 34(5): 577-582. DOI:10.1086/338471 |
| [31] |
Klinger JR, Sanchez MP, Curtin LA, et al. Multiple cases of life-threatening adenovirus pneumonia in a mental health care center[J]. Am J Respir Crit Care Med, 1998, 157(2): 645-649. DOI:10.1164/ajrccm.157.2.9608057 |
| [32] |
Hakim FA, Tleyjeh IM. Severe adenovirus pneumonia in immunocompetent adults: a case report and review of the literature[J]. Eur J Clin Microbiol Infect Dis, 2008, 27(2): 153-158. DOI:10.1007/s10096-007-0416-z |
| [33] |
GonÇalves G, Gouveia E, Mesquita JR, et al. Outbreak of acute gastroenteritis caused by adenovirus type 41 in a kindergarten[J]. Epidemiol Infect, 2011, 139(11): 1672-1675. DOI:10.1017/S0950268810002803 |
| [34] |
杨思园, 于凤婷, 王凌航. 人腺病毒感染进展[J]. 国际病毒学杂志, 2017, 24(5): 351-355. Yang SY, Yu FT, Wang LH. Advances in human adenovirus infection[J]. International Journal of Virology, 2017, 24(5): 351-355. |
| [35] |
Bruno B, Zager RA, Boeckh MJ, et al. Adenovirus nephritis in hematopoietic stem-cell transplantation[J]. Transplantation, 2004, 77(7): 1049-1057. DOI:10.1097/01.TP.0000122421.71556.71 |
| [36] |
Shindo K, Kitayama T, Ura T, et al. Acute hemorrhagic cystitis caused by adenovirus type 11 after renal transplantation[J]. Urol Int, 1986, 41(2): 152-155. DOI:10.1159/000281186 |
| [37] |
Couroucli XI, Welty SE, Ramsay PL, et al. Detection of microorganisms in the tracheal aspirates of preterm infants by polymerase chain reaction: association of adenovirus infection with bronchopulmonary dysplasia[J]. Pediatr Res, 2000, 47(2): 225-232. DOI:10.1203/00006450-200002000-00013 |
| [38] |
Bajanowski T, Wiegand P, Cecchi R, et al. Detection and significance of adenoviruses in cases of sudden infant death[J]. Virchows Arch, 1996, 428(2): 113-118. |
| [39] |
Gray GC, McCarthy T, Lebeck MG, et al. Genotype prevalence and risk factors for severe clinical adenovirus infection, United States 2004-2006[J]. Clin Infect Dis, 2007, 45(9): 1120-1131. DOI:10.1086/522188 |
| [40] |
Bowles NE, Ni JY, Kearney DL, et al. Detection of viruses in myocardial tissues by polymerase chain reaction: evidence of adenovirus as a common cause of myocarditis in children and adults[J]. J Am Coll Cardiol, 2003, 42(3): 466-472. DOI:10.1016/S0735-1097(03)00648-X |
| [41] |
Melón S, Méndez S, Iglesias B, et al. Involvement of adenovirus in clinical mononucleosis-like syndromes in young children[J]. Eur J Clin Microbiol Infect Dis, 2005, 24(5): 314-318. DOI:10.1007/s10096-005-1333-7 |
| [42] |
Russell WC. Adenoviruses: update on structure and function[J]. J Gen Virol, 2009, 90(Pt 1): 1-20. |
| [43] |
Zhang J, Ma K, Wang XY, et al. Desmoglein 2 (DSG2) is a receptor of human adenovirus type 55 causing adult severe community-acquired pneumonia[J]. Virol Sin, 2021, 36(6): 1400-1410. DOI:10.1007/s12250-021-00414-7 |
| [44] |
Hayder H, Müllbacher A. Molecular basis of immune evasion strategies by adenoviruses[J]. Immunol Cell Biol, 1996, 74(6): 504-512. |
| [45] |
Hasei J, Sasaki T, Tazawa H, et al. Dual programmed cell death pathways induced by p53 transactivation overcome resistance to oncolytic adenovirus in human osteosarcoma cells[J]. Mol Cancer Ther, 2013, 12(3): 314-325. DOI:10.1158/1535-7163.MCT-12-0869 |
| [46] |
Onion D, Crompton LJ, Milligan DW, et al. The CD4+ T-cell response to adenovirus is focused against conserved residues within the hexon protein[J]. J Gen Virol, 2007, 88(Pt 9): 2417-2425. |
| [47] |
Zaiss AK, Vilaysane A, Cotter MJ, et al. Antiviral antibodies target adenovirus to phagolysosomes and amplify the innate immune response[J]. J Immunol, 2009, 182(11): 7058-7068. DOI:10.4049/jimmunol.0804269 |
| [48] |
Moisy D, Avilov SV, Jacob Y, et al. HMGB1 protein binds to influenza virus nucleoprotein and promotes viral replication[J]. J Virol, 2012, 86(17): 9122-9133. DOI:10.1128/JVI.00789-12 |
| [49] |
Yang H, Hreggvidsdottir HS, Palmblad K, et al. A critical cysteine is required for HMGB1 binding to toll-like receptor 4 and activation of macrophage cytokine release[J]. Proc Natl Acad Sci U S A, 2010, 107(26): 11942-11947. DOI:10.1073/pnas.1003893107 |
| [50] |
Shen CF, Wang SM, Ho TS, et al. Clinical features of community acquired adenovirus pneumonia during the 2011 community outbreak in Southern Taiwan: role of host immune response[J]. BMC Infect Dis, 2017, 17(1): 196. |
| [51] |
Pettersson U. Encounters with adenovirus[J]. Ups J Med Sci, 2019, 124(2): 83-93. DOI:10.1080/03009734.2019.1613698 |
| [52] |
Ogawa E, Elliott WM, Hughes F, et al. Latent adenoviral infection induces production of growth factors relevant to airway remodeling in COPD[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 286(1): L189-L197. DOI:10.1152/ajplung.00315.2002 |
| [53] |
Kagnoff MF, Austin RK, Hubert JJ, et al. Possible role for a human adenovirus in the pathogenesis of celiac disease[J]. J Exp Med, 1984, 160(5): 1544-1557. DOI:10.1084/jem.160.5.1544 |
| [54] |
Atasheva S, Emerson CC, Yao J, et al. Systemic cancer thera-py with engineered adenovirus that evades innate immunity[J]. Sci Transl Med, 2020, 12(571): eabc6659. |
| [55] |
Han MY, Rajput C, Ishikawa T, et al. Small animal models of respiratory viral infection related to asthma[J]. Viruses, 2018, 10(12): 682. DOI:10.3390/v10120682 |
| [56] |
张惠琴, 孙新. 病毒诱导气道黏液高分泌机制[J]. 中国实用儿科杂志, 2018, 33(3): 179-183. Zhang HQ, Sun X. Mechanism of virus-induced airway mucus hypersecretion[J]. Chinese Journal of Practical Pediatrics, 2018, 33(3): 179-183. DOI:10.19538/j.ek2018030604 |
| [57] |
Shao RP, Lee DF, Wen Y, et al. E1A sensitizes cancer cells to TRAIL-induced apoptosis through enhancement of caspase activation[J]. Mol Cancer Res, 2005, 3(4): 219-226. DOI:10.1158/1541-7786.MCR-04-0084 |
| [58] |
Levine AJ. p53, the cellular gatekeeper for growth and division[J]. Cell, 1997, 88(3): 323-331. DOI:10.1016/S0092-8674(00)81871-1 |
| [59] |
Rubenwolf S, Schütt H, Nevels M, et al. Structural analysis of the adenovirus type 5 E1B 55-kilodalton-E4orf6 protein complex[J]. J Virol, 1997, 71(2): 1115-1123. DOI:10.1128/jvi.71.2.1115-1123.1997 |
| [60] |
Ullman AJ, Hearing P. Cellular proteins PML and Daxx media-te an innate antiviral defense antagonized by the adenovirus E4 ORF3 protein[J]. J Virol, 2008, 82(15): 7325-7335. DOI:10.1128/JVI.00723-08 |
| [61] |
Ullman AJ, Reich NC, Hearing P. Adenovirus E4 ORF3 protein inhibits the interferon-mediated antiviral response[J]. J Virol, 2007, 81(9): 4744-4752. DOI:10.1128/JVI.02385-06 |
| [62] |
Kessler T, Hamprecht K, Feuchtinger T, et al. Dendritic cells are susceptible to infection with wild-type adenovirus, inducing a differentiation arrest in precursor cells and inducing a strong T-cell stimulation[J]. J Gen Virol, 2010, 91(Pt 5): 1150-1154. |
| [63] |
Choi JW, Lee JS, Kim SW, et al. Evolution of oncolytic adenovirus for cancer treatment[J]. Adv Drug Deliv Rev, 2012, 64(8): 720-729. DOI:10.1016/j.addr.2011.12.011 |
| [64] |
Dodds E, Piper TA, Murphy SJ, et al. Cationic lipids and poly-mers are able to enhance adenoviral infection of cultured mouse myotubes[J]. J Neurochem, 1999, 72(5): 2105-2112. |
| [65] |
Russell KL, Hawksworth AW, Ryan MAK, et al. Vaccine-preventable adenoviral respiratory illness in US military recruits, 1999-2004[J]. Vaccine, 2006, 24(15): 2835-2842. DOI:10.1016/j.vaccine.2005.12.062 |
| [66] |
Lynch JP 3rd, Kajon AE. Adenovirus: epidemiology, global spread of novel serotypes, and advances in treatment and prevention[J]. Semin Respir Crit Care Med, 2016, 37(4): 586-602. DOI:10.1055/s-0036-1584923 |
| [67] |
Kuschner RA, Russell KL, Abuja M, et al. A phase 3, randomized, double-blind, placebo-controlled study of the safety and efficacy of the live, oral adenovirus type 4 and type 7 vaccine, in U.S. military recruits[J]. Vaccine, 2013, 31(28): 2963-2971. DOI:10.1016/j.vaccine.2013.04.035 |
| [68] |
Kajon AE, Hang J, Hawksworth A, et al. Molecular epidemio-logy of adenovirus type 21 respiratory strains isolated from US military trainees (1996-2014)[J]. J Infect Dis, 2015, 212(6): 871-880. DOI:10.1093/infdis/jiv141 |
| [69] |
Kieh M, Richert L, Beavogui AH, et al. Randomized trial of vaccines for Zaire Ebola virus disease[J]. N Engl J Med, 2022, 387(26): 2411-2424. DOI:10.1056/NEJMoa2200072 |
| [70] |
Barouch DH, Tomaka FL, Wegmann F, et al. Evaluation of a mosaic HIV-1 vaccine in a multicentre, randomised, double-blind, placebo-controlled, phase 1/2a clinical trial (APPROACH) and in rhesus monkeys (NHP 13-19)[J]. Lancet, 2018, 392(10143): 232-243. |
| [71] |
Page K, Melia MT, Veenhuis RT, et al. Randomized trial of a vaccine regimen to prevent chronic HCV infection[J]. N Engl J Med, 2021, 384(6): 541-549. |
| [72] |
Matsuda K, Migueles SA, Huang J, et al. A replication-competent adenovirus-vectored influenza vaccine induces durable systemic and mucosal immunity[J]. J Clin Invest, 2021, 131(5): e140794. |
| [73] |
Sadoff J, Gray G, Vandebosch A, et al. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19[J]. N Engl J Med, 2021, 384(23): 2187-2201. |



