2. 甘肃中医药大学公共卫生学院,甘肃 兰州 730000
2. School of Public Health, Gansu University of Chinese Medicine, Lanzhou 730000, China
尿路感染(urinary tract infection, UTI)是临床最常见的细菌性感染疾病之一,给社会带来了巨大的经济负担[1]。据文献报道,大约50%的人一生中至少会经历一次UTI[2]。且绝大多数UTI是由于肠杆菌科感染引起,80%以上的病例是由大肠埃希菌感染引起[3]。由于女性和男性生理结构的差异,尿路感染在女性群体中的发病率常高于男性[4]。近年来,随着广谱抗菌药物的大量及不规范使用,肠杆菌属耐药率普遍升高。为了解过去一年内甘肃地区尿标本检出病原菌分布及耐药情况,对甘肃地区80所医院尿标本数据进行分析,为该地区临床医生规范合理使用抗菌药物提供理论依据。
1 资料与方法 1.1 细菌来源收集甘肃省细菌耐药监测网中数据合格的80所成员单位,2021年1—12月的尿标本临床分离株的耐药监测资料,保留同一患者相同细菌第一株,剔除重复菌株,对于常规认为是污染细菌或正常定植菌不予药敏试验。
1.2 菌种鉴定与药敏试验细菌鉴定按各医院采用的常规方法,包括传统手工方法、飞行质谱仪、Microscan系统、API系统或VITEK系统。质控菌株为大肠埃希菌ATCC 25922和ATCC 35218、铜绿假单胞菌ATCC 27853、金黄色葡萄球菌ATCC 25923、肺炎链球菌ATCC 49619和流感嗜血杆菌ATCC 49247。药敏试验采用抗菌药物最低抑菌浓度(MIC)法、E试验法及纸片扩散法等,其结果判定参照2021年临床实验室标准化协会(CLSI)标准。本次统计中无中介数据,故中介未列出。试验菌株<30株不计入统计分析。
1.3 统计学方法数据统计应用WHONET 5.6软件和SPSS 25.0进行整理分析。不同性别分离病原菌对抗菌药物的耐药率采用χ2检验,P≤0.05为差异具有统计学意义。
2 结果 2.1 细菌分布2021年纳入分析的细菌总数为13 980株,其中革兰阳性(G+)菌3 288株(23.5%),革兰阴性(G-)菌10 692株(76.5%)。检出菌株数排名前五位的分别是:大肠埃希菌(7 647株,54.7%)、屎肠球菌(936株,6.7%)、粪肠球菌(912株,6.5%)、肺炎克雷伯菌(838株,6.0%)和奇异变形杆菌(410株,2.9%)。见表 1。男性患者尿标本分离5 656株(40.5%),女性患者尿标本分离8 324株(59.5%),不同性别患者尿标本分离细菌居前10位情况见表 2。
| 表 1 尿标本主要分离病原菌构成情况 Table 1 Distribution of main isolated pathogenic bacteria from urine specimens |
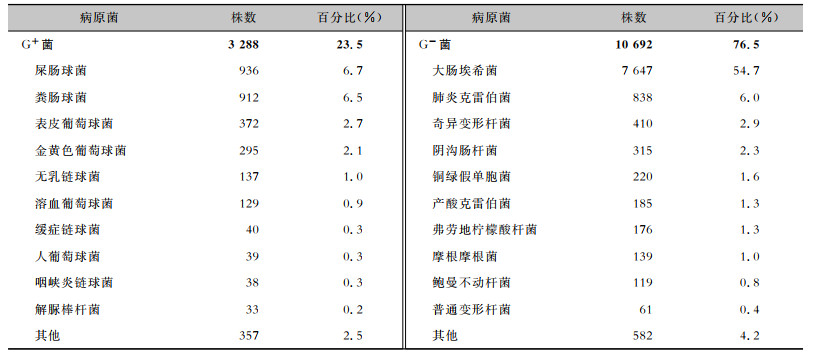
|
| 表 2 不同性别患者尿标本分离细菌居前10位及构成情况 Table 2 Distribution and constitution of the top 10 bacteria isolated from urine specimens of patients of different genders |
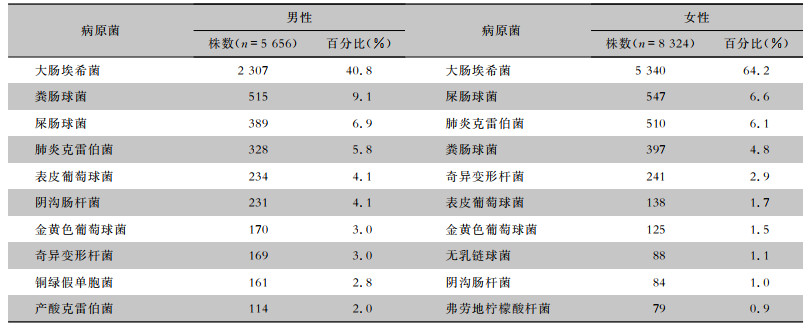
|
2021年共检出295株金黄色葡萄球菌,29.5%(87/295)为耐甲氧西林金黄色葡萄球菌(MRSA),54.9%(350/638)为耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)。男性患者MRSA及MRCNS的检出率分别为32.4%、56.3%,女性患者MRSA及MRCNS的检出率分别为25.6%、52.2%。金黄色葡萄球菌对青霉素G的耐药率男性高于女性(92.2% VS 80.3%);凝固酶阴性葡萄球菌对红霉素的耐药率女性高于男性(84.7% VS 75.5%);差异均有统计学意义(均P < 0.05)。本次监测中,未检出对万古霉素、替考拉宁及利奈唑胺耐药的葡萄球菌属菌株。葡萄球菌属对不同抗菌药物的药敏情况见表 3、4。
| 表 3 金黄色葡萄球菌和MRSA对常用抗菌药物的药敏结果 Table 3 Susceptibility of Staphylococcus aureus and MRSA to commonly used antimicrobial agents |
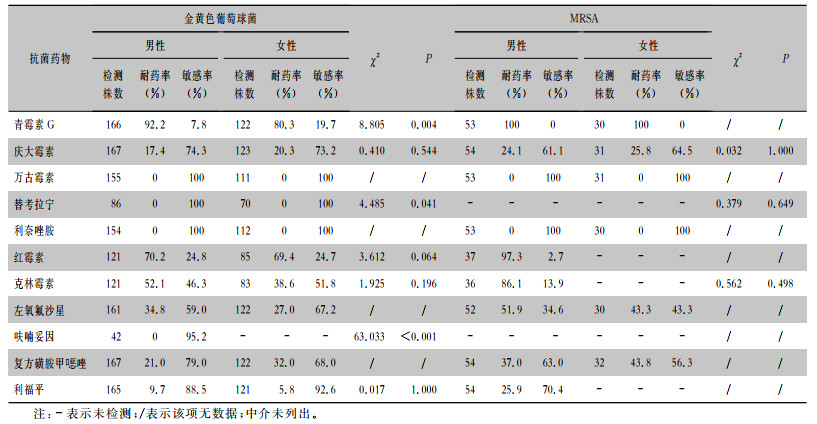
|
| 表 4 凝固酶阴性葡萄球菌和MRCNS对常用抗菌药物的药敏结果 Table 4 Susceptibility of coagulase negative Staphylococcus and MRCNS to commonly used antimicrobial agents |
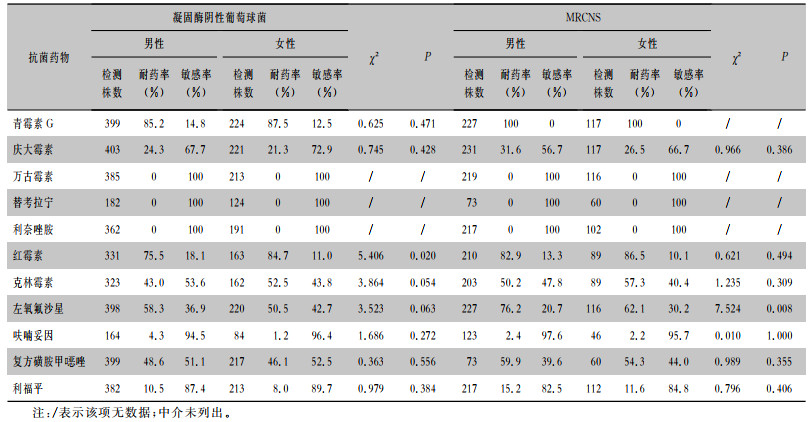
|
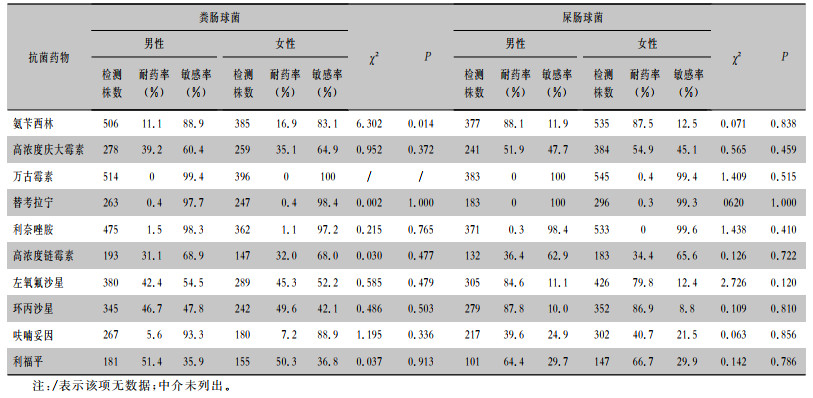
粪肠球菌对氨苄西林的耐药率在男性和女性中分别为11.1%和16.9%,对环丙沙星和左氧氟沙星的耐药率均>40%。粪肠球菌对万古霉素的耐药率为0,对利奈唑胺及替考拉宁的耐药率均<2%。女性患者中屎肠球菌对万古霉素和替考拉宁的耐药率分别为0.4%、0.3%,男性患者中屎肠球菌对利奈唑胺的耐药率为0.3%。肠球菌属对抗菌药物的药敏结果见表 5。
| 表 5 粪肠球菌和屎肠球菌对常用抗菌药物的药敏结果 Table 5 Susceptibility of Enterococcus faecalis and Enterococcus faecium to commonly used antimicrobial agents |
|
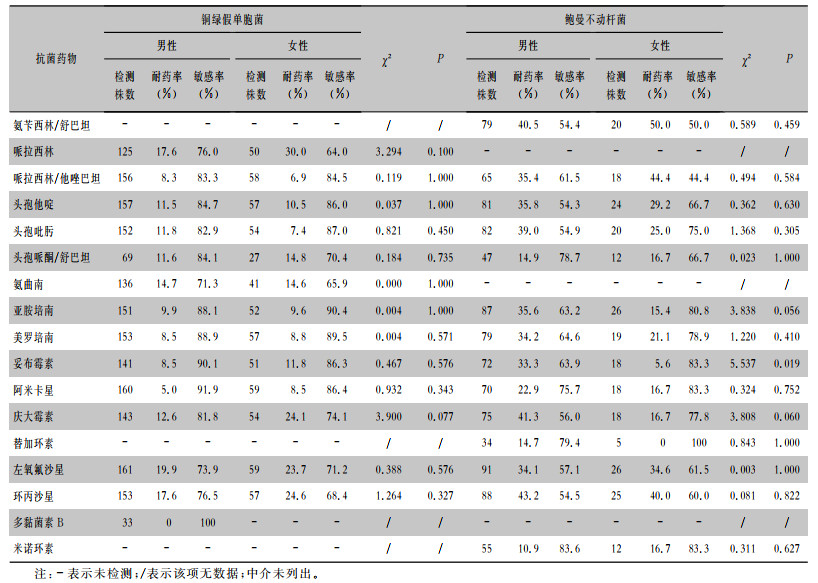
耐碳青霉烯类铜绿假单胞菌在男性和女性患者中的检出率分别是10.6%、13.6%。铜绿假单胞菌对阿米卡星、哌拉西林/他唑巴坦、亚胺培南和美罗培南的耐药率均<10%。在女性患者中,铜绿假单胞菌对庆大霉素、哌拉西林、环丙沙星和左氧氟沙星的耐药率均>20%。耐碳青霉烯类鲍曼不动杆菌在男性和女性患者中的检出率分别是34.4%、15.4%。鲍曼不动杆菌对氟喹诺酮类抗菌药物的耐药率在男性和女性患者中均>30%,对头孢哌酮/舒巴坦、米诺环素及替加环素的耐药率均<20%。非发酵糖G-菌对其他抗菌药物的药敏结果见表 6。
| 表 6 铜绿假单胞菌和鲍曼不动杆菌对常用抗菌药物的药敏结果 Table 6 Susceptibility of Pseudomonas aeruginosa and Acinetobacter baumannii to commonly used antimicrobial agents |
|
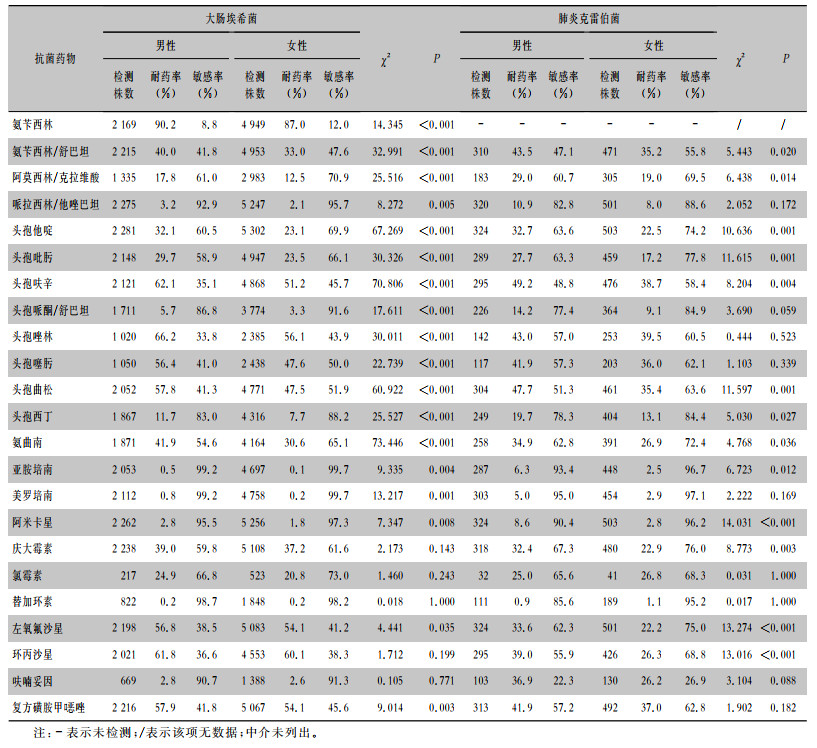
耐第三代头孢菌素、喹诺酮类及耐碳青霉烯类大肠埃希菌在男性中的检出率分别为58.6%、62.3%和0.7%,在女性中的检出率分别为48.5%、59.9%和0.3%。大肠埃希菌对氨苄西林的耐药率在男性和女性患者中分别为90.2%、87.0%,对头孢西丁的耐药率分别为11.7%和7.7%。大肠埃希菌对阿米卡星、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、呋喃妥因和替加环素的耐药率在男性和女性患者中均<6%。耐第三代头孢菌素及耐碳青霉烯类肺炎克雷伯菌在男性患者中的检出率分别为47.6%、5.9%,在女性患者中的检出率分别为35.6%、3.1%。肺炎克雷伯菌对阿米卡星、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦和替加环素在男性和女性患者中的耐药率均<15%。大肠埃希菌和肺炎克雷伯菌对常用抗菌药物的药敏结果见表 7。
| 表 7 大肠埃希菌和肺炎克雷伯菌对常用抗菌药物的药敏结果 Table 7 Susceptibility of Escherichia coli and Klebsiella pneumoniae to commonly used antimicrobial agents |
|
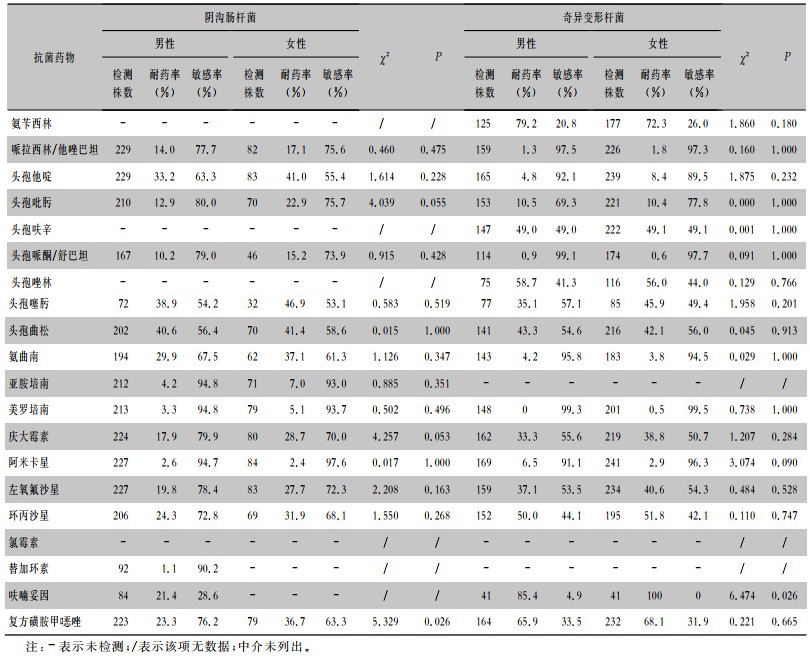
在男性和女性患者中,阴沟肠杆菌对第三代头孢菌素的耐药率均>30%,对阿米卡星、亚胺培南和美罗培南的耐药率均<8%。奇异变形杆菌对美罗培南的耐药率在男性和女性患者中分别为0、0.5%,对阿米卡星、氨曲南、哌拉西林/他唑巴坦和头孢哌酮/舒巴坦的耐药率均<7%。除头孢他啶及头孢吡肟外,奇异变形杆菌对其他头孢类抗生素的耐药率在男性和女性患者中均>35%。阴沟肠杆菌和奇异变形杆菌对常用抗菌药物的药敏结果见表 8。
| 表 8 阴沟肠杆菌和奇异变形杆菌对常用抗菌药物的药敏结果 Table 8 Susceptibility of Enterobacter cloacae and Proteus mirabilis to commonly used antimicrobial agents |
|
尿标本实验室检查在泌尿系统相关疾病中具有重要作用。本次收集2021年1—12月来自甘肃省80所医院临床尿标本分离菌株的耐药监测资料,共获得13 980株临床分离株,其中男性检出5 656株(40.5%),女性检出8 324株(59.5%)。其中G+菌3 288株(23.5%),G-菌10 692株(76.5%)。本次监测中大肠埃希菌占比最高,为54.7%,与国内相关报道[5-6]一致。女性和男性患者检出菌株均以大肠埃希菌为主,且在女性患者中的占比(64.2%)高于男性患者(40.8%)。大肠埃希菌为肠道常见定植菌,引起尿路感染最常见的途径是逆行感染,女性尿道较短的生理结构[7]及激素周期性变化引起免疫力变化可能导致在女性患者中检出较多。男性患者病原菌的分布情况与全国报道数据[5]相比,表皮葡萄球菌占比较高,为4.1%,铜绿假单胞菌检出菌株占比低于全国水平,为2.8%。女性患者检出病原菌的分布情况与国内报道[5]一致。
在G+菌中,屎肠球菌最多(占G+菌的28.5%),其次为粪肠球菌(占G+菌的27.7%),肠球菌属在尿标本中检出比率高可能与其拥有有利于肠球菌属定植和延长肠球菌属在膀胱内停留有关的表面蛋白有关[8]。男性患者尿标本中屎肠球菌和粪肠球菌的检出菌株占比(6.9%和9.1%)均高于女性(6.6%和4.8%)。本次监测中,屎肠球菌对抗菌药物的耐药率在男性和女性中均高于粪肠球菌,与文献报道[9-10]一致。粪肠球菌在男性和女性中对氨苄西林的耐药率<20%,对呋喃妥因的耐药率<8%,治疗由粪肠球菌引起的泌尿系统感染时,临床医生经验用药可首选青霉素类及呋喃妥因。屎肠球菌在男性和女性中对氨苄西林的耐药率达80%以上,对呋喃妥因的耐药率达40%左右,故临床用药时应根据药敏试验结果选择性使用抗菌药物。在男性和女性患者中,屎肠球菌对氟喹诺酮类抗菌药物的耐药率达80%左右,说明氟喹诺酮类不适宜作为屎肠球菌引起泌尿系统感染的经验用药。女性患者中检测出对万古霉素耐药的屎肠球菌,耐药率为0.4%。耐万古霉素肠球菌1988年被首次报道[11],在国内检出率较低,但近年来有上升趋势。其主要机制是万古霉素作为糖肽类抗生素与细菌细胞壁上的D -丙氨酸-D-丙氨酸(D-ALA-D-ALA)为末端的肽聚糖前体结合而抑制细菌细胞壁的合成[12]。耐糖肽类抗生素的肠球菌细胞壁D-ALA-D-ALA末端基因改变,使糖肽类抗生素分子与末端基因结合力下降,不能继续破坏细菌细胞壁的合成而产生耐药[13]。粪肠球菌和屎肠球菌中均检出对利奈唑胺的耐药菌,耐药率<2%。利奈唑胺通过与细菌50S核糖体亚基结合[14],作用于核糖体肽基转移酶活性中心[15],抑制蛋白质的合成,是一种细菌蛋白质合成抑制剂。其最主要的耐药机制为23rRNA突变[16],粪肠球菌较屎肠球菌更易突变[17],本次监测中粪肠球菌对利奈唑胺的耐药率高于屎肠球菌,考虑与该突变有关。肠球菌属对利奈唑胺、万古霉素及替考拉宁的敏感性均较高,可供重症患者及多重耐药菌感染患者选择。由于屎肠球菌和粪肠球菌对抗菌药物的耐药率差异明显,肠球菌属引起泌尿系统感染的临床标本应明确鉴定病原菌种类,针对性选择抗菌药物。
G-菌中大肠埃希菌检出最多,其次为肺炎克雷伯菌、奇异变形杆菌、阴沟肠杆菌、铜绿假单胞菌和鲍曼不动杆菌。大肠埃希菌对氨苄西林的耐药率在男性和女性患者中分别为90.2%、87.0%,对除头孢他啶及头孢吡肟以外的头孢菌素耐药率均较高,达45%以上,对氟喹诺酮类药物的耐药率达50%以上,这些抗菌药物在治疗大肠埃希菌引起的泌尿系统感染时不适宜经验用药,应根据实际药敏结果合理选择抗菌药物。大肠埃希菌对阿米卡星、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、呋喃妥因和替加环素的耐药率在男性和女性患者中均<6%。阿米卡星有较强的肝肾毒性[18],呋喃妥因易引起严重的肝肺损伤[19],不建议作为长期治疗的常规药物。哌拉西林/他唑巴坦、头孢哌酮/舒巴坦可作为治疗泌尿系统感染的经验用药。耐碳青霉烯类大肠埃希菌在男性和女性患者中的检出率分别为0.7%、0.3%,耐碳青霉烯类肺炎克雷伯菌和耐碳青霉烯类阴沟肠杆菌的检出率均<8%,耐碳青霉烯类鲍曼不动杆菌的检出率>20%。耐碳青霉烯类肠杆菌的耐药性与携带和产生不同的耐药基因并通过质粒传导有关[20]。随着抗菌药物的广泛使用,耐碳青霉烯类肠杆菌的检出率不断增加,积极监测耐碳青霉烯类肠杆菌的耐药情况,有助于医院感染防控及临床合理使用抗菌药物。
除头孢他啶及头孢吡肟,奇异变形杆菌对其他头孢类抗生素的耐药率在男性和女性患者中均>35%。奇异变形杆菌与阴沟肠杆菌对阿米卡星、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、碳青霉烯类抗生素的敏感性较高,可供临床经验用药。铜绿假单胞菌泌尿系统感染常与临床治疗中膀胱灌注及导管相关的侵入性操作有关,铜绿假单胞菌对受试抗菌药物的耐药率均较低。
泌尿系统感染病原菌种类复杂,临床送检合格尿标本对鉴定致病菌尤为重要。本文数据来源于全省各级医院,标本的合格度、菌株的分离操作及药敏结果均存在差异性,对统计结果有一定的影响。根据实验室药敏试验结果针对性选择抗菌药物,有利于提高诊疗效果,也有利于控制不合理使用抗菌药物引起的耐药菌株增加。及时开展细菌耐药监测工作,积极了解病原菌分布情况及耐药水平,帮助临床医生规范、合理使用抗菌药物,对泌尿系统感染患者的抗感染治疗具有重要意义。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Smelov V, Naber K, Bjerklund Johansen TE. Improved classification of urinary tract infection: future considerations[J]. Eur Urol Suppl, 2016, 15(4): 71-80. DOI:10.1016/j.eursup.2016.04.002 |
| [2] |
Davenport M, Mach KE, Shortliffe LMD, et al. New and developing diagnostic technologies for urinary tract infections[J]. Nat Rev Urol, 2017, 14(5): 296-310. DOI:10.1038/nrurol.2017.20 |
| [3] |
Adrover-Jaume C, Rojo-Molinero E, Clemente A, et al. Mobile origami immunosensors for the rapid detection of urinary tract infections[J]. Analyst, 2021, 145(24): 7916-7921. |
| [4] |
陈夏容, 张华平, 曾秀玉, 等. 社区产ESBLs大肠埃希菌泌尿系感染的危险因素分析[J]. 中国循证医学杂志, 2016, 16(2): 125-129. Chen XR, Zhang HP, Zeng XY, et al. Risk factors analysis of community-acquired urinary tract infections caused by exten-ded-spectrum β-lactamase-producing Escherichia coli[J]. Chinese Journal of Evidence-Based Medicine, 2016, 16(2): 125-129. |
| [5] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年尿标本细菌耐药监测报告[J]. 中国感染控制杂志, 2021, 20(1): 52-59. China Antimicrobial Resistance Surveillance System. Antimicrobial resistance of bacteria from urine specimens: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(1): 52-59. |
| [6] |
赵梅, 杨丹, 贾伟, 等. 2018—2020年多中心尿标本分离菌分布及耐药性分析[J]. 中国抗生素杂志, 2021, 46(11): 1008-1013. Zhao M, Yang D, Jia W, et al. Bacterial distribution and drug resistance of bacteria from urine specimens in a multicenter from 2018 to 2020[J]. Chinese Journal of Antibiotics, 2021, 46(11): 1008-1013. |
| [7] |
曹霞, 张渝, 龙冲. 1 676例尿路感染病原菌分布与耐药性分析[J]. 国际检验医学杂志, 2017, 38(5): 598-600, 603. Cao X, Zhang Y, Long C. Analysis of pathogen distribution and drug resistance of 1 676 cases of urinary tract infection[J]. International Journal of Laboratory Medicine, 2017, 38(5): 598-600, 603. |
| [8] |
廖国林, 李江萍. 成人尿标本临床分离菌的分布及耐药性监测[J]. 中国医院药学杂志, 2019, 39(11): 1153-1157. Liao GL, Li JP. Distribution and drug resistance monitoring of clinical isolates in adult urine specimens[J]. Chinese Journal of Hospital Pharmacy, 2019, 39(11): 1153-1157. |
| [9] |
陶肖燕, 汤荣, 易峻文, 等. 尿液标本临床分离菌的耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(4): 402-407. Tao XY, Tang R, Yi JW, et al. Surveillance of antibiotic resistance in the pathogens isolated from urine samples[J]. Chinese Journal of Infection and Chemotherapy, 2018, 18(4): 402-407. |
| [10] |
吕宁宁, 刘军, 权明吉. 786株尿液标本中细菌的分布和耐药性监测[J]. 中国实验诊断学, 2015, 19(9): 1555-1556. Lv NN, Liu J, Quan MJ. Distribution and drug resistance monitoring of 786 strains of bacteria in urine specimens[J]. Chinese Journal of Laboratory Diagnosis, 2015, 19(9): 1555-1556. |
| [11] |
Leclercq R, Derlot E, Duval J, et al. Plasmid-mediated resis-tance to vancomycin and teicoplanin in Enterococcus faecium[J]. N Engl J Med, 1988, 319(3): 157-161. |
| [12] |
刘丹, 王佳贺. 肠球菌属耐药机制研究进展[J]. 检验医学与临床, 2018, 15(4): 568-570. Liu D, Wang JH. Advances in antimicrobial resistance mechanisms of Enterococcus SPP[J]. Laboratory Medicine and Cli-nic, 2018, 15(4): 568-570. |
| [13] |
Iweriebor BC, Gaqavu S, Obi LC, et al. Antibiotic susceptibilities of Enterococcus species isolated from hospital and domestic wastewater effluents in Alice, Eastern Cape Province of South Africa[J]. Int J Environ Res Public Health, 2015, 12(4): 4231-4246. |
| [14] |
Long KS, Vester B. Resistance to linezolid caused by modifications at its binding site on the ribosome[J]. Antimicrob Agents Chemother, 2012, 56(2): 603-612. |
| [15] |
Kloss P, Xiong L, Shinabarger DL, et al. Resistance mutations in 23S rRNA identify the site of action of the protein synthesis inhibitor linezolid in the ribosomal peptidyl transfe-rase center[J]. J Mol Biol, 1999, 294(1): 93-101. |
| [16] |
李培, 林东昉. 肠球菌对利奈唑胺耐药机制研究进展[J]. 中国感染与化疗杂志, 2018, 18(3): 341-344. Li P, Lin DF. Research updates on the mechanisms of linezolid resistance in Enterococcus[J]. Chinese Journal of Infection and Chemotherapy, 2018, 18(3): 341-344. |
| [17] |
Prystowsky J, Siddiqui F, Chosay J, et al. Resistance to line-zolid: characterization of mutations in rRNA and comparison of their occurrences in vancomycin-resistant Enterococci[J]. Antimicrob Agents Chemother, 2001, 45(7): 2154-2156. |
| [18] |
冯小艳, 杨莉莉, 喻华. 2018年四川省细菌耐药监测网尿液标本的病原菌分布及耐药性分析[J]. 中国抗生素杂志, 2020, 45(9): 912-918. Feng XY, Yang LL, Yu H. Distribution and drug resistance of pathogens isolated from patients with urinary tract infections according to Sichuan Provincial Antimicrobial Resistant Investigation Net in 2018[J]. Chinese Journal of Antibiotics, 2020, 45(9): 912-918. |
| [19] |
Ingram A, Posid T, Pandit A, et al. Risk factors, demographic profiles, and management of uncomplicated recurrent urinary tract infections: a single institution study[J]. Menopause, 2021, 28(8): 943-948. |
| [20] |
杨启文. 中国碳青霉烯耐药肠杆菌科菌流行病学及耐药机制研究[D]. 北京: 北京协和医学院, 2015. Yang QW. The epidemiology and resistance mechanisms of carbapenem-resistant Enterobacteriaceae in China[D]. Beijing: Peking Union Medical College, 2015. |




 唑
唑