新生儿化脓性脑膜炎(简称化脑)是指新生儿期由细菌引起的脑膜炎症,是新生儿期严重的感染性疾病,具有较高的病死率,20%~50%的幸存新生儿可遗留不同程度的神经系统后遗症[1],尤其是重症化脑,起病急,发展快,预后更差,而早期诊断和及时治疗能改善新生儿化脑的预后[2]。本研究回顾性分析南京医科大学附属儿童医院新生儿医疗中心收治的新生儿化脑病例,比较新生儿重症化脑和普通化脑的高危因素、病原菌分布、临床特点及转归的不同,为临床早期鉴别重症化脑,及时治疗和判断预后提供依据。
1 对象与方法 1.1 研究对象选取南京医科大学附属儿童医院新生儿医疗中心2019年10月—2022年10月收治的135例新生儿化脑,回顾性收集临床资料,包括基本资料(胎龄、性别、出生体重、分娩方式、孕母感染史、发病日龄、窒息史)、实验室检查、头颅磁共振(magnetic resonance imaging, MRI)和视频脑电图检查等。根据《儿童重症化脓性脑膜炎的诊断与治疗》以及《新生儿重症化脓性脑膜炎临床特征分析》重症化脑的诊断标准[2-4],将化脑新生儿分为重症组及普通组,出现以下情形之一的归入重症组: (1)严重意识障碍,表现为昏睡或昏迷;(2)病情恶化导致死亡;(3)反复或持续惊厥发作,振幅整合脑电图或视频脑电图重度异常;(4)伴有脑疝或严重脑出血、脑梗死、脑软化、中重度脑积水、脑室管膜炎等并发症;(5)后期存在严重后遗症,如严重的听力损伤、继发性癫痫等。不符合以上表现者为普通组。本研究通过南京医科大学附属儿童医院医学伦理委员会批准(批准文号:202004015-1),新生儿监护人对所做研究知情同意,并签署知情同意书。
1.2 纳入与排除标准纳入标准:(1)发病年龄<4周的新生儿。(2)符合《实用新生儿学》第五版化脑诊断标准[3],临床出现感染、化脑的表现;脑脊液常规白细胞数(WBC)≥20×106/L,生化指标符合化脑诊断标准;或新生儿脑脊液培养出致病菌(采用哥伦比亚血琼脂和巧克力琼脂培养基),或宏基因组二代测序(metagenomic next-generation sequencing, mNGS) 检测出病原菌。排除标准:(1)伴有3~4级颅内出血;(2)合并缺氧缺血性脑病、遗传代谢性脑病、先天性脑发育畸形等颅内病变;(3)病历资料不完整。
1.3 观察指标观察指标包括新生儿化脑围产期高危因素[5-6](是否早产、是否为低出生体重儿、是否有胎膜早破、孕母是否有围生期感染、出生时是否有窒息)、入院24 h内临床表现及体征(发病日龄、体温、反应、喂养情况,是否有惊厥、呼吸暂停、皮疹、消化道症状等,以及神志、呼吸、心率、血压、皮肤黄染、肌张力等情况)、入院48 h内实验室检查[血常规WBC、血小板计数(PLT)、C反应蛋白(CRP)、降钙素原(PCT)、血气分析、肝肾功能、脑脊液细胞数、脑脊液蛋白质和糖浓度、脑脊液培养、脑脊液mNGS]、并发症(发病3周行头颅MRI检查,并发症分为:脑室管膜炎、硬膜下积液、脑脓肿、脑出血、脑积水、脑软化等)、视频脑电图结果(入院后尽早行视频脑电图检查,结果分为正常、轻度异常、中度异常、重度异常)、转归、出院前听力检测、神经行为发育的评估等。其中新生儿化脑分为早发感染和晚发感染。
1.4 治疗与转归所有新生儿一旦确诊化脑,应积极应用抗菌药物,并根据脑脊液病原菌结果及时调整为敏感的抗菌药物。对于化脑2周内治疗效果不佳的新生儿, 行脑脊液mNGS检测。抗菌药物疗程2~4周,部分重症化脑依据病情将疗程延长至6~8周,直至治愈或者好转。转归分为治愈、好转、未愈和死亡。
1.5 相关定义及判断标准 1.5.1 早发及晚发感染早发感染是指出生后≤7 d发病,晚发感染是指出生后>7 d发病[3]。
1.5.2 血WBC异常判断标准6小时龄~3日龄≥30×109/L,≥3日龄≥20×109/L,或任何日龄<5×109/L,均提示异常[7]。
1.5.3 视频脑电图异常判断标准[8-10](1) 轻度异常:①背景活动成熟轻度延迟;②与胎龄相适应的波形或节律轻度缺乏,或与胎龄不相适应的不成熟波形轻度延迟、消失;③局部性电衰减;④在正常或轻度异常背景上的少量局灶或多灶性放电。(2)中度异常:①与实际胎龄相比,背景活动中度不连续;②与胎龄相适应的波形或节律缺乏,或与胎龄不相适应的不成熟波形明显延迟、消失;③半球间持续不对称和(或)不同步不超过整个记录的50%;④持续普遍性电压降低,在所有状态下背景活动低于25 μV;⑤单一节律发放或其他形式的电发作,不伴重度背景异常。(3)重度异常:①与实际胎龄相比,背景活动明显不连续(暴发间隔时间超过60 s);②局灶性或一侧周期性放电;③半球间过度不同步和(或)不对称占整个记录的50%以上;④频繁出现中央、顶区和(或)中、后颞区或中线区正相尖波;⑤严重低电压,所有状态低于5 μV;⑥暴发-抑制;⑦等电位。
1.5.4 神经行为发育的评估≤1月龄新生儿进行新生儿神经行为评分(NBNA评分),>1月龄的新生儿采用格塞尔婴幼儿发育量表(Gesell发育量表)进行评估。
1.5.5 转归判断标准治愈指临床症状及体征消失,脑脊液正常,无并发症;好转为临床症状、体征消失,脑脊液细胞数正常,培养阴性,仅脑脊液蛋白质和(或)糖含量未恢复正常或存在并发症;未愈指临床表现及体征未改善,脑脊液未恢复正常;死亡是指治疗过程中或放弃治疗后难免死亡者[11]。
1.6 统计方法应用SPSS 18.0软件进行统计学分析,计数资料用频数和百分率(%)表示,采用χ2进行比较,非正态分布计量资料用中位数M(P25,P75)表示,采用Mann-Whitney进行组间比较,新生儿重症化脑的危险因素采用logistic回归分析,以P≤0.05为差异有统计学意义。
2 结果 2.1 围产期高危因素及病原体阳性情况135例新生儿化脑中,重症组60例(44.4%),普通组75例(55.6%),两组新生儿性别、剖宫产率、孕母围生期感染率比较,差异均无统计学意义(均P>0.05)。与普通组相比,重症组早产儿、低出生体重儿、出生窒息史所占比例高,胎膜早破发生率增高,差异均有统计学意义(均P<0.05)。见表 1。
| 表 1 重症组和普通组新生儿化脑高危因素及病原体阳性情况[例(%)] Table 1 High risk factors and pathogen positivity of purulent meningitis in neonates in the severe and mode-rate purulent meningitis groups (No. of cases [%]) |
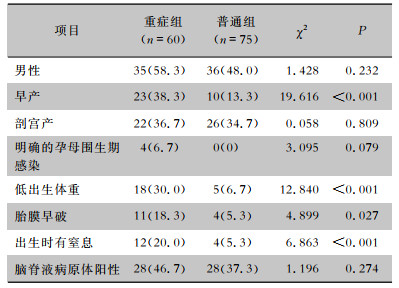
|
两组新生儿脑脊液病原体阳性率比较差异无统计学意义,重症组脑脊液病原菌阳性28例(46.7%),以大肠埃希菌脑膜炎(12例)和无乳链球菌脑膜炎为主(9例),脑膜脓毒性伊丽莎白金菌脑膜炎2例,肺炎克雷伯菌、阴沟肠杆菌、屎肠球菌、解没食子酸盐链球菌、头状葡萄球菌脑膜炎各1例;普通组病原菌阳性28例(37.3%),以无乳链球菌脑膜炎(10例)、大肠埃希菌脑膜炎(9例)为主,其次为肺炎克雷伯菌(3例)、阴沟肠杆菌(2例)、屎肠球菌(2例)、李斯特杆菌(2例)脑膜炎。
2.2 临床表现和体征重症组和普通组新生儿早发感染、晚发感染所占比例相似,临床均以低体温或发热、反应差、喂养困难为主要表现,消化道症状(呕吐、腹泻或腹胀)、呼吸暂停、皮疹、低血压、高胆红素血症、肌张力改变等症状两组发生率比较,差异均无统计学意义(均P>0.05)。相对于普通组,重症组出现反应差、惊厥、神志异常、呼吸增快(呼吸频率>60次/分)、心率增快(心率>180次/分)、低氧血症(吸入空气时动脉血PaO2<50 mmHg)的比例均增高(均P<0.05),见表 2。重症组新生儿平均住院日数为34.5(22.5,45.0)d,长于普通组的24.0(21.0,30.5)d(Z=-2.961,P=0.003)。
| 表 2 重症组和普通组新生儿临床表现及体征比较[例(%)] Table 2 Comparison in clinical manifestations and signs between neonates in the severe and moderate purulent meningitis groups (No. of cases [%]) |

|
重症组和普通组新生儿外周血WBC异常、CRP增高、PCT增高的发生率比较,差异均无统计学意义(均P>0.05),重症组新生儿PLT降低、肝功能损伤、肾功能损伤发生率均较普通组升高(均P<0.05)。重症组新生儿脑脊液WBC、蛋白质浓度高于普通组,脑脊液糖浓度、脑脊液糖/血清糖的比值低于普通组,差异均有统计学意义(均P<0.01)。见表 3。
| 表 3 重症组和普通组新生儿实验室检查结果的比较 Table 3 Comparison of laboratory examination results between neonates in the severe and moderate purulent meningitis groups |
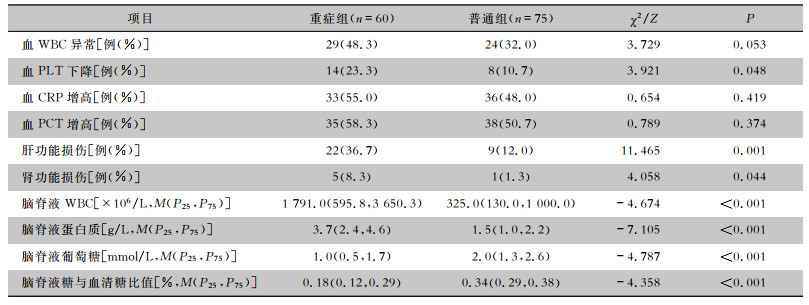
|
将重症组和普通组新生儿在临床表现、体征、实验室检查结果单因素分析中差异具有统计学意义的指标,纳入多因素logistic回归分析,结果显示反应差、肝功能损伤、低氧血症、脑脊液蛋白质浓度升高(>2.5 g/L)、脑脊液糖浓度降低(<1.5 mmol/L)是新生儿重症化脑的独立危险因素(均P<0.05)。见表 4、5。
| 表 4 重症化脑可能的危险因素与赋值表 Table 4 Possible risk factors and assignment table for severe purulent meningitis |

|
| 表 5 新生儿重症化脑危险因素的二分类logistic回归分析 Table 5 Binary logistic regression analysis results for the risk factors of severe neonatal meningitis |
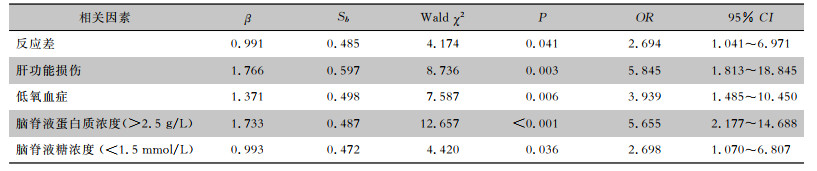
|
两组新生儿均在恢复期完善了头颅MRI平扫+弥散成像检查,结果显示,重症组MRI异常者50例(83.3%),其中轻度异常4例,重度异常46例;普通组MRI异常者5例(6.7%),均为轻度异常,两组新生儿MRI异常发生率比较,差异有统计学意义(χ2=78.01,P<0.001)。头颅MRI轻度异常中,普通组2例存在侧脑室饱满,2例存在脑实质点状出血灶,1例表现为轻度脑缺氧;重症组2例存在侧脑室饱满,1例存在脑实质点状出血灶,1例表现为轻度脑缺氧;两组新生儿MRI轻度异常发生率比较,差异无统计学意义(P>0.05)。重症组新生儿MRI重度异常中,脑积水占首位(20例),其次为脑软化(14例)、严重脑出血(6例)、硬膜下积液(5例)、脑脓肿(2例)、脑室管膜炎(1例);重症组新生儿不同病原菌化脑的MRI重度异常的发生率及表现有差异,大肠埃希菌脑膜炎病例中MRI重度异常的发生率高达91.7%(脑积水3例、脑积水同时伴硬膜下积液2例、脑脓肿2例、脑出血2例、脑室管膜炎1例、脑软化1例),无乳链球菌脑膜炎MRI重度异常的发生率为88.9%(脑软化5例、脑积水2例、硬膜下积液1例),2例脑膜脓毒性伊丽莎白金菌脑膜炎均并发脑积水,1例阴沟肠杆菌脑膜炎并发脑软化。33例早产儿中,头颅MRI结果异常者22例(66.7%),其中轻度异常4例,重度异常18例;102例足月儿中,头颅MRI结果异常者33例(32.4%),其中轻度异常5例,重度异常28例。早产儿头颅MRI异常发生率、重度异常发生率均高于足月组(χ2值分别为10.78、6.99,P值分别为0.004、0.001),头颅MRI轻度异常检出率比较,早产儿与足月儿差异无统计学意义(χ2=1.09,P=0.297)。
2.6 视频脑电图结果的比较由于视频脑电图预约时间较长,加上部分新生儿家长依从性不高,75例普通组新生儿中仅23例完成了视频脑电图的检查,结果正常12例,轻度异常8例,中度异常3例;60例重症组新生儿中仅25例完成了视频脑电图的检查,10例脑电图正常,2例轻度异常,6例中度异常,7例重度异常。
2.7 治疗结局与预后指标的比较 2.7.1 治疗结局的比较普通组新生儿经过规范抗感染治疗后,好转13例,其余62例治愈出院。重症组新生儿治愈12例,好转42例(其中6例脑积水新生儿进行了侧脑室分流术),在院死亡1例,未愈5例均放弃治疗(4例出院后24 h内死亡,1例出院1周内死亡)。两组新生儿治愈率、好转率、病死率比较,差异均有统计学意义(均P<0.05)。
2.7.2 预后指标的比较出院前完善听力筛查或脑干听觉诱发电位检查,普通组新生儿5例(6.7%)存在听力损伤,重症组存活新生儿中,13例(24.1%)伴有听力损伤,重症组听力损伤发生率高于普通组(P<0.05)。64例新生儿出院前完成了神经行为发育的评估,其中普通组36例,重症组28例;普通组9例(25.0%)发育落后,重症组15例(53.6%)发育落后,两组比较差异具有统计学意义(P<0.05)。
3 讨论新生儿化脑是新生儿期一种严重的神经系统感染疾病,约25%的新生儿败血症会并发该疾病[3]。新生儿免疫功能低下,发生重症化脑时,血脑屏障通透性增加,脑水肿、颅内高压和血栓形成,病死率高,可导致严重的神经系统后遗症,如听力损失、发育障碍和神经心理障碍等[12]。
本中心回顾性分析中,在围产期高危因素方面,与普通化脑相比,重症化脑剖宫产率、孕母围生期感染率无明显差异,胎膜早破发生率升高;早产儿、低出生体重儿所占比例增加,早产儿、低出生体重儿免疫系统脆弱,也是新生儿化脑预后不良的高危因素[6, 13];重症组新生儿出生窒息的发生率也增加,可能与围生期重症感染有关。
重症组和普通组新生儿化脑脑脊液病原体阳性率分别为46.7%、37.3%,两者阳性率比较差异无统计学意义。新生儿化脑在不同国家不同地区病原菌的分布都有所不同,发达国家以无乳链球菌感染为主[14],而发展中国家以革兰阴性菌为主[15-16]。我国新生儿化脑的病原菌以大肠埃希菌和无乳链球菌为主[17-18]。本次回顾性分析重症组和普通组新生儿化脑,大肠埃希菌和无乳链球菌仍为引起化脑最主要的病原菌,另外脑膜脓毒性伊丽莎白金菌也是引起重症化脑的致病菌之一,该菌是一种主要感染新生儿和所有年龄段免疫缺陷宿主的机会致病菌,可引起脑膜炎、脓毒症、菌血症、肺炎、心内膜炎,导致严重的神经系统后遗症[19]。本研究发现,大肠埃希菌脑膜炎及脑膜脓毒性伊丽莎白金菌脑膜炎并发症以脑积水为主,无乳链球菌脑膜炎易并发脑软化。
新生儿化脑临床表现不典型,重症组和普通组新生儿均以发热或低体温、反应差、喂养困难、高胆红素血症、肌张力改变为主要表现,早发感染、晚发感染在重症组和普通组新生儿中所占比例差异无统计学意义。反应差、惊厥、神志异常、心率增快、呼吸增快、低氧血症、肝肾功能损伤的发生率在重症组明显增高。研究[12]发现,入院时精神反应差、惊厥、神志异常是化脑预后不良的危险因素。外周血WBC异常、CRP增高、PCT增高,两组之间无明显差异;重症化脑PLT下降明显,血小板已被证实是炎症和自身免疫反应的关键因素[13],血小板的减少表明存在严重的感染,提示临床上应警惕伴有血小板减少的化脑新生儿,尽早采取积极治疗措施,以防发展为重症化脑。
化脑的急性期,间质血管通透性增加,病原体容易通过血脑屏障,并在脑脊液中释放磷壁酸、内毒素之类的炎症介质,随之多形核白细胞、白细胞介素和细胞因子增加,因而脑脊液表现为WBC和蛋白浓度的增加。重症化脑时,这种炎症反应持续不断,产生活性氧自由基,引起级联反应从而生成有害的蛋白质、脂质和核酸,引起脑细胞损伤[20]。与普通组新生儿相比,重症组新生儿脑脊液蛋白质浓度、WBC均明显增高,脑脊液糖浓度、脑脊液糖/血清糖比值明显下降。刘梦迪等[21]研究提示,脑脊液糖<1 mmol/L、脑脊液蛋白质>2 g/L是新生儿细菌性脑膜炎预后不良的危险因素。而Tan等[22]预测预后不良的脑脊液蛋白质浓度最佳截止值1.88 g/L。截至目前,用来判断预后不良的脑脊液蛋白质和葡萄糖水平、脑脊液/血清的糖比值标准截断值仍然不确定[13],需要多中心更大样本的临床研究。
本研究logistic回归分析显示,反应差、肝功能损伤、低氧血症、脑脊液蛋白质浓度升高、脑脊液糖浓度降低是新生儿重症化脑的独立危险因素,提示临床应对以上因素加以重视,及早采取有效措施防止发展为重症化脑。
本研究中,重症化脑住院时间较长,治愈率低,并发症高达76.7%,脑积水最多见,然后依次为脑软化、严重脑出血、硬膜下积液等,其中大肠埃希菌性化脑的并发症以脑积水为主,无乳链球菌化脑以脑软化为主。2例脑膜脓毒性伊丽莎白金菌化脑,并发症发生率高,虽经过抗菌药物规范治疗,但均不可避免地出现了严重脑积水,与相关报道[23]一致。另一方面,与足月儿相比,早产儿头颅MRI严重并发症明显增高,早产儿、低出生体重儿免疫功能低,血脑屏障、神经细胞发育不成熟,脑血流自动调节功能较差,脑白质易受病原体和炎症因子的损伤,导致软化灶的形成和脑室扩大,此也是早产儿化脑预后不良的重要原因。虽然完善视频脑电图的病例较少,但从现有的结果可以看出,普通组新生儿脑电图基本正常或轻度异常,而重症组新生儿部分病例脑电图表现为中、重度异常,重度异常脑电图中背景活动重度异常、惊厥频繁发作、睡眠周期消失等表现均提示新生儿化脑预后不良[9, 24]。同时,重症组新生儿听力损伤、神经行为发育落后发生率也高,由于部分数据不全,重症化脑新生儿的长期预后需进一步的长期随访。
综上所述,本中心近3年的数据显示,新生儿重症化脑中,早产儿、低出生体重儿所占比例高,胎膜早破的发生率增加;临床表现较普通化脑重,可伴有低氧血症、肝肾功能损伤、血小板减少;脑脊液WBC、蛋白质浓度高于普通化脑,而脑脊液糖水平低于普通化脑, 且并发症发生率高。其中反应差、肝功能损伤、低氧血症、脑脊液蛋白质浓度的升高和糖浓度的降低均为新生儿重症化脑的独立危险因素。早期可以通过临床症状体征、实验室检查来判断新生儿重症化脑,做到早期识别、积极治疗,从而改善新生儿重症化脑的预后。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Gordon SM, Srinivasan L, Harris MC. Neonatal meningitis: overcoming challenges in diagnosis, prognosis, and treatment with omics[J]. Front Pediatr, 2017, 5: 139. DOI:10.3389/fped.2017.00139 |
| [2] |
许邦礼, 康文清. 新生儿重症化脓性脑膜炎临床特征分析[J]. 中国小儿急救医学, 2021, 28(4): 312-315. Xu BL, Kang WQ. Clinical characteristics of neonatal severe purulent meningitis[J]. Chinese Pediatric Emergency Medicine, 2021, 28(4): 312-315. |
| [3] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 5版. 北京: 人民卫生出版社, 2019: 520. Shao XM, Ye HM, Qiu XS. Practice of neonatology[M]. 5th ed. Beijing: People's Medical Publishing House, 2019: 520. |
| [4] |
宋晓洁, 蒋莉. 儿童重症化脓性脑膜炎的诊断与治疗[J]. 中国小儿急救医学, 2018, 25(12): 888-892. Song XJ, Jiang L. Diagnosis and treatment of childhood severe purulent meningitis[J]. Chinese Pediatric Emergency Medicine, 2018, 25(12): 888-892. |
| [5] |
Song B, Hua QL, Sun HW, et al. Relevant analyses of pathogenic bacteria and inflammatory factors in neonatal purulent meningitis[J]. Exp Ther Med, 2018, 16(2): 1153-1158. |
| [6] |
Videholm S, Kostenniemi U, Lind T, et al. Perinatal factors and hospitalisations for severe childhood infections: a population-based cohort study in Sweden[J]. BMJ Open, 2021, 11(10): e054083. DOI:10.1136/bmjopen-2021-054083 |
| [7] |
中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. The Subspecialty Group of Neonatology, the Society of Pedia-tric, Chinese Medical Association, Professional Committee of Infectious Diseases, Neonatology Society, Chinese Medical Doctor Association. Expert consensus on the diagnosis and management of neonatal sepsis (version 2019)[J]. Chinese Journal of Pediatrics, 2019, 57(4): 252-257. |
| [8] |
刘晓燕. 临床脑电图学[M]. 北京: 人民卫生出版社, 2006: 562-575. Liu XY. Clinical electroencephalography[M]. Beijing: People's Medical Publishing House, 2006: 562-575. |
| [9] |
中华医学会儿科学分会围产专业委员会. 新生儿振幅整合脑电图临床应用专家共识[J]. 中华新生儿科杂志, 2019, 34(1): 3-7. The Subspecialty Group of Perinatology, the Society of Pedia-tric, Chinese Medical Association. Expert consensus on clinical application of amplitude integrated EEG in newborns[J]. Chinese Journal of Neonatology, 2019, 34(1): 3-7. |
| [10] |
孙伟伟, 李丽君, 李磊. 多导视频脑电图在新生儿脑损伤中的应用价值评估[J]. 中华新生儿科杂志, 2018, 33(2): 113-117. Sun WW, Li LJ, Li L. Application of multi-channel video electroencephalogram in neonatal brain injury[J]. Chinese Journal of Neonatology, 2018, 33(2): 113-117. |
| [11] |
赵智, 华雪莹, 张海波, 等. 新生儿化脓性脑膜炎诊疗现状和预后的多中心调查研究[J]. 中华新生儿科杂志, 2018, 33(1): 2-6. Zhao Z, Hua XY, Zhang HB, et al. Multi-center retrospective clinical survey of neonatal purulent meningitis in China[J]. Chinese Journal of Neonatology, 2018, 33(1): 2-6. |
| [12] |
Sewell E, Roberts J, Mukhopadhyay S. Association of infection in neonates and long-term neurodevelopmental outcome[J]. Clin Perinatol, 2021, 48(2): 251-261. |
| [13] |
Mao DH, Miao JK, Zou X, et al. Risk factors in predicting prognosis of neonatal bacterial meningitis-a systematic review[J]. Front Neurol, 2018, 9: 929. |
| [14] |
Alamarat Z, Hasbun R. Management of acute bacterial meningitis in children[J]. Infect Drug Resist, 2020, 13: 4077-4089. |
| [15] |
Ouchenir L, Renaud C, Khan S, et al. The epidemiology, management, and outcomes of bacterial meningitis in infants[J]. Pediatrics, 2017, 140(1): e20170476. |
| [16] |
Travier L, Alonso M, Andronico A, et al. Neonatal susceptibility to meningitis results from the immaturity of epithelial barriers and gut microbiota[J]. Cell Rep, 2021, 35(13): 109319. |
| [17] |
新生儿细菌性脑膜炎多中心研究协作组. 华南部分地区新生儿细菌性脑膜炎多中心流行病学研究[J]. 中华儿科杂志, 2018, 56(6): 421-428. Collaborative Study Group for Neonatal Bacterial Meningitis. A multicenter epidemiological study of neonatal bacterial me-ningitis in parts of South China[J]. Chinese Journal of Pedia-trics, 2018, 56(6): 421-428. |
| [18] |
Xu M, Hu L, Huang HY, et al. Etiology and clinical features of full-term neonatal bacterial meningitis: a multicenter re-trospective cohort study[J]. Front Pediatr, 2019, 7: 31. |
| [19] |
Wang BB, Cheng R, Feng Y, et al. Elizabethkingia anophelis: an important emerging cause of neonatal sepsis and meningitis in China[J]. Pediatr Infect Dis J, 2022, 41(5): e228-e232. |
| [20] |
Wang HW, Zhu XP. Cerebrospinal fluid culture-positive bacterial meningitis increases the risk for neurologic damage among neonates[J]. Ann Med, 2021, 53(1): 2199-2204. |
| [21] |
刘梦迪, 徐发林, 段稳丽, 等. 新生儿细菌性脑膜炎预后不良的危险因素分析[J]. 中国当代儿科杂志, 2019, 21(11): 1064-1068. Liu MD, Xu FL, Duan WL, et al. Risk factors for poor prognosis of neonatal bacterial meningitis[J]. Chin J Contemp Pe-diatr, 2019, 21(11): 1064-1068. |
| [22] |
Tan JT, Kan J, Qiu G, et al. Clinical prognosis in neonatal bacterial meningitis: the role of cerebrospinal fluid protein[J]. PLoS One, 2015, 10(10): e0141620. |
| [23] |
Abhishek KS, Kombade SP, Gupta N, et al. Case series and mini-review on Elizabethkingia meningoseptica, a high alert organism causing meningitis in premature neonates from a tertiary care hospital of western Rajasthan[J]. Infect Disord Drug Targets, 2021, 21(8): e160921189884. |
| [24] |
Frenkel N, Friger M, Meledin I, et al. Neonatal seizure reco-gnition-comparative study of continuous-amplitude integrated EEG versus short conventional EEG recordings[J]. Clin Neurophysiol, 2011, 122(6): 1091-1097. |



