2. 甘肃中医药大学护理学院, 甘肃 兰州 730000
2. School of Nursing, Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China
金黄色葡萄球菌(Staphylococcus aureus, SA)是导致皮肤和软组织感染的最常见病原体,迅速出现的耐药菌株正在造成严重的公共卫生问题。研究[1]表明中性粒细胞的招募对SA的免疫是必需的,T细胞的作用也被更多研究者阐述。小鼠感染试验证实,朗格汉斯细胞与壁磷壁酸(wall teichoic acid, WTA)N-乙酰葡糖胺(conserved β-N-acetylglucosamine, β-GlcNAc)的相互作用有助于增强皮肤炎症,最显著的是白细胞介素-17(interleukin-17, IL-17)的产生[2]。IL-17是SA皮肤感染过程中中性粒细胞招募和细菌清除的关键细胞因子[3]。因此,探索IL-17信号通路在SA感染中的作用机制,进一步了解其对皮肤中SA感染的保护性免疫反应,探索基于免疫的疗法将有成为抗菌药物替代治疗的可能性。本文旨在综述IL-17相关因子及其信号通路在SA感染进程、预防和治疗中的分子机制,为临床和试验研究提供参考。
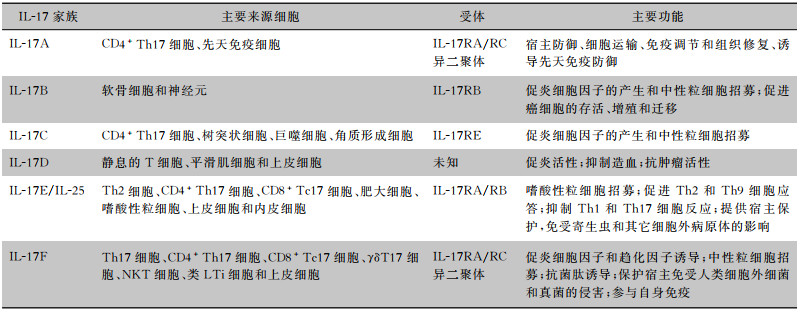
1 IL-17的相关概述 1.1 IL-17家族及产IL-17细胞IL-17家族包括IL-17(A~F)6名成员。不同因子的生产细胞及其功能如表 1所述。其中对IL-17A和IL-17F的研究最多,这两种细胞因子具有最高程度的同源性,并与相同的受体结合。在野生型大小鼠细胞中,IL-17A可在蛋白水平上抑制IL-17F,而IL-17F可以用来弥补IL-17A的缺失[4]。在IL-17细胞因子家族中,IL-17C是唯一一个通过细菌刺激和特定配体在人类呼吸道上皮细胞中被诱导的成员[5]。IL-17D与IL-17B的同源性程度最高,被认为是最古老的IL-17家族成员,但其功能却远未为人所知[6]。这些受体如何发挥作用以及其各自的配体-受体关系仍然是当前的研究热点。
| 表 1 IL-17家族来源及其受体和主要功能 |
|
产IL-17的细胞包括适应性和先天性免疫细胞,如辅助性T细胞17(T helper cell 17, Th17)、CD4+Th17细胞、CD8+Tc17细胞、γδT17细胞、NK1.1~NKT细胞(NK1.1-NKT cells, NKT17)、黏膜相关不变T细胞(mucosal-associated invariant T cells, MAIT cells)、CD4-CD8-T细胞、淋巴组织诱导剂(lymphoid tissue inducer, LTi)细胞和3型先天淋巴样细胞(type 3 innate lymphoid cells, ILC3s),以及软骨细胞、神经元、角质形成细胞、上皮细胞和内皮细胞等非免疫细胞[7]。其中γδT17细胞和ILC3s是IL-17应对皮肤感染的主要产生者[8]。
1.2 IL-17信号通路的传导过程IL-17信号通路包括依赖TRAF-6(即Act1-TRAF-6-NF-κB通路)和非依赖TRAF-6(即Act1/TRAF-2/TRAF-5通路),如图 1。IL-17信号通路的起始事件是通过细胞质尾部的一个保守区域(SEF/IL-17R, SEFIR)的相互作用将Act1(另一个具有SEFIR蛋白的多功能适配器)招募到IL-17R,Act1还包含一个肿瘤坏死因子受体相关因子(tumor-necrosis factor receptor-associated factor, TRAF)结合序列,该基因序列招募不同的TRAFs来启动单独的下游通路。依赖TRAF-6的IL-17信号通路在Act1被招募到IL-17受体复合物后,TRAF6与Act1中的TRAF结合序列结合,导致k63连接的多聚泛素链与TRAF6结合,多泛素化的TRAF6激活转化生长因子-β-活化激酶1(transforming growth factor-β-activated kinase 1, TAK1),导致NF-κB的激活和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路的激活以激活AP-1,诱导基因表达[9],继而促进和增加角质形成细胞(keratinocytes, KCs)中防御素(human beta-defensin, HBD)2和3的表达,并通过诱导不同的趋化因子(CXCL1、CXCL2及IL-8)和集落刺激因子(G-CSF及GM-CSF)来引导中性粒细胞的募集,还可以促进T细胞、Th17细胞和NKT细胞病变区的募集[10],以及各种抗微生物因子的释放来抵御外来病原体的入侵,并产生组织重构因子来促进坏死组织的再生。而非依赖TRAF-6的IL-17信号通路在此过程中可增加mRNA的半衰期,并促进效应蛋白的有效产生,在Act1被招募到IL-17受体复合物后,由TRAF2和TRAF5被招募到Act1而启动,进而激活决定“客户端”mRNA命运的RNA结合蛋白(RNA-binding proteins, RBPs),如HuR、Act1、Arid5a和DDX3X,以积极的方式增加IL-17靶mRNA的表达[11]。
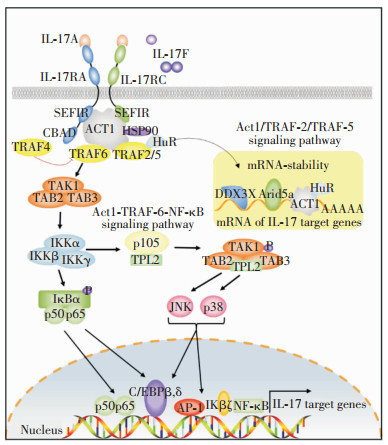 |
| 图 1 IL-17信号通路传导过程 |
SA的致病机制主要表现在其具有种类繁多且致病力较强的毒力因子、黏附素、生物膜等方面。但SA如何产生毒力因子,从皮肤共生体转化为病原体,目前尚不清楚,这些致病物质的致病机制与IL-17的活动密切相关。酚溶性调控蛋白(phenol-soluble modulins, PSMs)是SA非常重要的一个毒素因子,分为α和β两型,PSMs虽然具有裂解细胞的能力,但无特异性,也不依赖受体。体外研究[12]证实,SA被中性粒细胞吞噬后会分泌PSMs裂解中性粒细胞,使细菌从中释放出来而存活。Nakagawa等[8]利用表皮定植诱导毒性基因,发现SA依赖于毒性Agr调节的PSMα诱导KCs损伤释放IL-1a和IL-36a,通过IL-1R和IL-36R信号激活适配器MyD88,诱导γδT17细胞和ILC3产生IL-17,ILC3主要介导皮肤SA的炎症。
另外,SA肠毒素(staphylococcal enterotoxin, SE)作为超抗原,可诱导淋巴细胞活化,释放Th2细胞因子(如IL-4、IL-5和IL-13),促进嗜酸性炎症的发生。在香烟烟雾背景下反复暴露于SA肠毒素B(SEB)的小鼠中[13],观察到IL-17A的增加。先前的研究[14]表明,SA可以在鼻窦外植体培养中诱导多种促炎症细胞因子产生,包括IL-17和IFN-γ。Yu等[15]进一步研究发现,SEB可以促进息肉来源的单核细胞产生IL-17并激活IL-17+T细胞亚群,但在健康黏膜来源的细胞中不能发挥同样的作用。上述结果表明,SA感染可触发和增强炎症性黏膜中的IL-17反应,过度的IL-17免疫可能促进中性粒细胞炎症,导致鼻黏膜慢性炎症的持续[16],SA生物膜也可增强鼻黏膜外植体中IL-17的表达[16]。
虽然SA释放的致病物质给治疗带来了困难,但另一方面也要看到其诱导免疫细胞的活化,并发挥抗感染、减轻感染炎症反应的作用。不断深入探索其机制,为疫苗和新型药物的开发提供新思路。
2.2 IL-17对SA感染的保护作用至关重要 2.2.1 IL-17参与SA感染的宿主防御IL-17A、IL-17F及其受体IL-17RA/IL-17RC已被证明在由白念珠菌和SA引起的口腔和皮肤的试验性感染中起着重要的宿主防御作用[4, 17-18]。IL-17RA、γδT17细胞、IL-17F和IL-17RA缺陷小鼠在皮肤SA感染时有更重的皮肤病变、更高的细菌计数和中性粒细胞招募受损,这些表型可以通过使用重组IL-17A来挽救[3],ACT1基因突变患者中也已报道SA皮炎的易感性[19]。
γδT17细胞来源的IL-17A和IL-17F在宿主防御SA皮肤感染中有冗余和代偿作用。Marchitto等[20]进一步研究发现Vγ6+、Vγ4+作为主要的γδT17亚型细胞在淋巴结中克隆扩增以应对SA皮肤感染。最近的研究[21]表明,IL-17C在调节上皮细胞的先天免疫功能中也发挥着关键作用,并在感染过程中作为炎症和黏膜屏障功能的维持纽带。在细菌刺激下,表皮角质形成细胞通过识别细菌和病原体相关分子模式(pathogen-associated molecular patterns, PAMPs),诱导黏膜和皮肤上皮细胞中的IL-17C[22],并以一种独特的自分泌或旁分泌的方式增强宿主黏膜防御反应[21]。
2.2.2 IL-17参与SA感染的屏障保护除了对宿主的防御至关重要外,IL-17对屏障的保护也至关重要。一方面,IL-17通过维持肠上皮细胞的紧密连接,上调β-防御素和钙保护素等抗菌蛋白来保护黏膜屏障,以控制皮肤感染[9];另一方面,IL-17也能刺激组织再生,恢复屏障功能,在对入侵病原体的免疫反应过程中,上皮细胞广泛增殖,以修复被破坏的屏障和恢复组织的完整性,IL-17诱导的抗微生物肽RegIIIγ的表达对于皮肤的伤口闭合至关重要[9];IL-17保护肠道屏障组织的能力超过了炎症的任何潜在负面影响,在这种情况下,IL-17正在成为组织再生的一个驱动因素[9];SA携带的清除也被证明是IL-17依赖的[23],但IL-17和人类SA携带之间的联系尚未被广泛研究。
2.2.3 IL-17参与SA感染的免疫反应研究[1]表明,未接种疫苗的野生型小鼠和IL-17A缺陷小鼠的脾脏和肝脏中的细菌计数相似,这表明IL-17A在对系统性SA感染的先天免疫中并不重要,而对适应性免疫的作用更重要。另有研究[7]表明,与需要启动和极化才能产生IL-17的适应性Th17细胞不同,先天IL-17产生细胞会对细胞因子作出快速和强劲的反应,而快速产生IL-17的能力被证明在SA等病原体感染的早期阶段是至关重要的。看似不同结果的两个研究实则证明了IL-17在SA感染的整个过程中对免疫系统无论是先天免疫还是适应性免疫的保护作用都至关重要。
IL-17对于SA感染的保护作用不断启发、推动着研究人员对T细胞介导的免疫系统的研究,试图从中发现新型抗SA疫苗。例如Ferraro等[24]通过研究表示Th1/Th17驱动抗原的鉴定、佐剂和给药途径,以及描述记忆反应的作用,可能会促进疫苗的开发。
2.3 IL-17信号通路与不同因子在SA感染中的相互作用 2.3.1 MyD88信号通路可诱导IL-17的产生不同信号通路中的分子串扰和级联放大反应是炎症消退和扩散的基础。在SA感染中MyD88可通过IL-1R和IL-36R刺激对免疫细胞发挥重要作用,以诱导IL-17的产生,应对SA表皮感染。病原体入侵与否,免疫系统所表现的功能有所不同。在表皮屏障没有被物理破坏的表皮模型中,通过MyD88功能诱导表皮增厚和中性粒细胞的募集,以防止病原体的侵袭。而在真皮/皮下模型中,MyD88信号在促进真皮和皮下组织内的免疫细胞对SA的杀灭方面似乎更为重要[6]。
2.3.2 多种信号因子可调控IL-17的产生适应性产IL-17的CD4+T细胞(Th17)参与宿主防御和自身免疫。对Th17细胞中控制IL-17产生机制的研究表明,IL-6、IL-21、IL-23、TGF-β和/或IL-1β通过激活STAT-3和主转录因子RORγT来驱动IL-17的分化和产生[7]。然而,Yu等[15]发现只有IL-23可以促进息肉来源的淋巴细胞中IL-17的分泌以及Th17或Tc17细胞的分化,而与IL-23共享相同p40亚基的IL-12,却只能刺激息肉淋巴细胞中IFN-γ的产生和Th1或Tc1细胞的分化。St等[7]发现IL-1刺激可以通过使用不同于传统Th17细胞的信号通路,以T细胞受体(T cell receptor, TCR)依赖的方式诱导IL-17的快速产生,这可能包括使用转录因子、NF-κB和干扰素调控因子(interferon regulatory factors, IRFs),即通过不需要IL-23或激活STAT-3的非典型途径先天产生IL-17的方式,在黏膜宿主防御中起生理作用。除了以上因子,也有报道在IL-12和IL-18的存在下,IFN-γ的产量增加,而IL-17的产量减少,在IL-27的培养物中也观察到IL-17的产量减少[24]。Reiss-Mandel等[25]在25名志愿者中发现,外源性刺激的外周血单核细胞(peripheral blood monouclear cells, PBMCs)中添加重组IL-19会导致IL-17表达降低,而在内源性刺激的细胞中添加IL-19抗体会导致IL-17反应增加。表明不同的免疫反应可能在决定SA的携带模式中发挥作用。
2.3.3 IL-17参与Th17/调节性T细胞(Treg)平衡Treg和Th17细胞分化的机制已经被阐明,人工控制Th17/Treg细胞平衡可以调节各种感染性疾病[26]。了解Th17细胞和Treg细胞之间的相互关系可能为多种炎症条件的治疗提供重要线索。通过用抗体阻断内源性IL-17来促进Treg细胞的抗炎功能,可以有效降低脓毒性关节炎的严重程度,其可能的机制是中和IL-17A可强烈下调TLR2和TNFR1,进而阻断细胞因子介导的炎症信号通路,减弱NF-κB激活,还可对TNFR2的表达产生正反馈,并与肿瘤坏死因子(TNF-α)结合,最终有助于Treg细胞的抗炎作用[27]。
3 治疗和预防SA感染的IL-17相关制剂及其分子机制 3.1 靶向自噬SA可以驱动CD4+T细胞的抗原特异性反应,并诱导显著水平的Th1和Th17细胞活化。自噬可中断并降低耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)诱导的脓毒症中Th1和Th17相关细胞因子的产生,进而发挥对MRSA诱导的脓毒症的保护作用,减轻炎症诱导的器官损伤,但未增强细菌的清除[28]。目前的研究证实靶向自噬可作为抗菌药物联合治疗或辅助治疗,为未来MRSA诱导的脓毒症提供一种新的非抗菌药物治疗策略,但其确切机制有待进一步研究。
3.2 减毒疫苗Th17应答介导的保护性免疫在疫苗对抗SA感染的有效性中发挥着关键作用。研究[29]表明在低毒性突变体TSST-1(less toxic mutant TSST-1, mTSST-1)疫苗的记忆阶段,IL-17A反应的减少不是由于IL-17A产生细胞的消失或无反应,而是IL-17A反应被mTSST-1刺激后产生的IL-10所抑制。IL-10中和恢复了mTSST-1接种SA感染后小鼠脾脏中IL-17AmRNA的表达,以及对疫苗接种记忆期SA感染的保护作用。
黏附素是SA表达的一类特异性蛋白,能够识别机体的细胞外基质并与之发生特异性结合,介导SA黏附于宿主细胞表面,促进细菌对宿主组织的入侵、免疫逃避和生物膜的形成。黏附素分子中的凝集因子(clumping factor, Clf)A、ClfB及纤黏蛋白(fnbA、fnbB)被认为是SA表面最主要的黏附因子。Lin等[30]用结构与SA的ClfA相似的念珠菌黏附素Als3p重组N端(rAls3p-N)进行疫苗接种,发现这类疫苗可通过诱导Th1和Th17应答,导致吞噬细胞的招募和激活,从而提高SA感染小鼠的存活率。Narita等[31]发现用ClfA的纤维蛋白原结合域的免疫诱导,可诱导IL-17A产生细胞,通过增强中性粒细胞和巨噬细胞作用,进而发挥抗SA感染作用。进一步研究[1]发现纤连蛋白结合蛋白(fibronectin-binding protein, FnBP)A541-870也可诱导IL-17A产生。SA可被肾细胞摄取,且被摄入胞内的细菌在其致病性中起着重要作用,而IL-17A是增强胞外细菌的清除能力,所以FnBPA541-870免疫小鼠肾脏中产生的IL-17A可能对清除免疫小鼠肾细胞内的SA效果较差[32]。
3.3 IL-17相关抑制剂Dey等[33]发现靶向IL-17是一种治疗自身免疫性和炎症性疾病的有效方法,在关节炎中中和SA诱导分泌的IL-17,可以在早期和晚期降低破坏性关节炎的持续时间和严重程度。通过使用sTNF抑制剂,或TNFR1拮抗剂,在IL-17中和过程中保持mTNF/TNFR2信号通路完整的同时,选择性地阻断sTNF/TNFR1信号是脓毒性关节炎的理想治疗策略[27]。近年来,几种IL-17A通路抑制剂已进入临床试验阶段,包括抗IL-17A单克隆抗体和抗IL-17RA单克隆抗体,且在II期临床试验中显示出了巨大的成功,可以治疗一些自身免疫性疾病,如类风湿性关节炎、牛皮癣和非感染性葡萄膜炎[34]。然而,刘影等[35]表示IL-17抗体与SA混合注入小鼠背部皮内后能直接与机体产生的IL-17发生抗原抗体反应,阻碍IL-17发挥抵御SA皮肤感染的作用,这不仅证明了SA感染不能用IL-17抗体治疗,也进一步证实IL-17在抗SA皮肤感染中的重要性。
3.4 其他口服乳酸乳球菌菌株血浆(LC-血浆)可通过TLR9产生皮肤IL-17A激活皮肤免疫,加强皮肤的物理和化学屏障,并通过在皮肤引流淋巴结(skin-draining lymph nodes, SLN)中激活浆细胞样树突状细胞(plasmacytoid dendritic cell, pDC)来增强皮肤稳态,从而抑制SA表皮感染和皮肤炎症[36]。
4 总结与展望IL-17相关活动在SA感染的早期和晚期都发挥着重要的作用。健康屏障组织中存在的细胞因子可以促进小群体代谢惰性Th17细胞的优先诱导,这些细胞反过来调节屏障表面免疫进而抑制或限制细菌的生长,而不诱导明显的炎症。然而,产IL-17细胞在组织损伤或病原体入侵时,可以通过感知细胞因子组成的变化而迅速扩增并增加其促炎功能,以损伤宿主组织。因此,精细控制致病性和保护性IL-17免疫之间的平衡,对于未来制定治疗炎症和感染性疾病的治疗策略至关重要。鉴于近年来出现的MRSA,在疫苗接种策略中利用IL-17信号通路可能具有预防前景。不同信号分子与IL-17信号通路的相互串扰,也提示可从串扰因子方面来控制IL-17的平衡,以达到治疗的效果。总之,IL-17信号通路在SA感染方面的研究仍然需要进一步探索,深入探究其分子机制将为疫苗的开发和药物作用机制提供新的证据。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Narita K, Asano K, Nakane A. IL-17A plays an important role in protection induced by vaccination with fibronectin-bin-ding domain of fibronectin-binding protein A against Staphylo-coccus aureus infection[J]. Med Microbiol Immunol, 2017, 206(3): 225-234. DOI:10.1007/s00430-017-0499-9 |
| [2] |
van Dalen R, De La Cruz Diaz JS, Rumpret M, et al. Langerhans cells sense Staphylococcus aureus wall teichoic acid through langerin to induce inflammatory responses[J]. mBio, 2019, 10(3): e00330-19. |
| [3] |
Cho JS, Pietras EM, Garcia NC, et al. IL-17 is essential for host defense against cutaneous Staphylococcus aureus infection in mice[J]. J Clin Invest, 2010, 120(5): 1762-1773. DOI:10.1172/JCI40891 |
| [4] |
Shibue Y, Kimura S, Kajiwara C, et al. Role of interleukin-17 in a murine community-associated methicillin-resistant Staphylococcus aureus pneumonia model[J]. Microbes Infect, 2019, 21(1): 33-39. DOI:10.1016/j.micinf.2018.06.006 |
| [5] |
Min HJ, Kim KS. IL-17C expression and its correlation with pediatric adenoids: a preliminary study[J]. Int J Med Sci, 2020, 17(17): 2603-2610. DOI:10.7150/ijms.49244 |
| [6] |
Zhu H, Song RX, Wang XW, et al. Peritoneal bacterial infection repressed the expression of IL17D in Siberia sturgeon a chondrostean fish in the early immune response[J]. Fish Shellfish Immunol, 2017, 64: 39-48. DOI:10.1016/j.fsi.2017.03.011 |
| [7] |
St Leger AJ, Hansen AM, Karauzum H, et al. STAT-3-independent production of IL-17 by mouse innate-like αβ T cells controls ocular infection[J]. J Exp Med, 2018, 215(4): 1079-1090. DOI:10.1084/jem.20170369 |
| [8] |
Nakagawa S, Matsumoto M, Katayama Y, et al. Staphylococcus aureus virulent PSMα peptides induce keratinocyte alarmin release to orchestrate IL-17-dependent skin inflammation[J]. Cell Host Microbe, 2017, 22(5): 667-677. DOI:10.1016/j.chom.2017.10.008 |
| [9] |
Li XX, Bechara R, Zhao JJ, et al. IL-17 receptor-based signaling and implications for disease[J]. Nat Immunol, 2019, 20(12): 1594-1602. DOI:10.1038/s41590-019-0514-y |
| [10] |
Fiala GJ, Gomes AQ, Silva-Santos B. From thymus to periphe-ry: molecular basis of effector γδ-T cell differentiation[J]. Immunol Rev, 2020, 298(1): 47-60. DOI:10.1111/imr.12918 |
| [11] |
Kafasla P, Skliris A, Kontoyiannis DL. Post-transcriptional coordination of immunological responses by RNA-binding proteins[J]. Nat Immunol, 2014, 15(6): 492-502. DOI:10.1038/ni.2884 |
| [12] |
李曈曈, 唐佩福. 金黄色葡萄球菌在软组织创伤感染致病机制中的研究进展[J]. 重庆医学, 2020, 49(4): 650-653. Li TT, Tang PF. Research progress in the pathogenic mechanism of traumatic soft-tissue infection caused by Staphylococcus aureus[J]. Chongqing Medicine, 2020, 49(4): 650-653. DOI:10.3969/j.issn.1671-8348.2020.04.031 |
| [13] |
Roos AB, Stampfli MR. Targeting interleukin-17 signalling in cigarette smoke-induced lung disease: mechanistic concepts and therapeutic opportunities[J]. Pharmacol Ther, 2017, 178: 123-131. DOI:10.1016/j.pharmthera.2017.04.001 |
| [14] |
Cantero D, Cooksley C, Bassiouni A, et al. Staphylococcus aureus biofilms induce apoptosis and expression of interferon-γ, interleukin-10, and interleukin-17A on human sinonasal explants[J]. Am J Rhinol Allergy, 2015, 29(1): 23-28. DOI:10.2500/ajra.2015.29.4130 |
| [15] |
Yu SF, Cao C, Li QY, et al. Local IL-17 positive T cells are functionally associated with neutrophil infiltration and their development is regulated by mucosal microenvironment in nasal polyps[J]. Inflamm Res, 2021, 70(1): 139-149. DOI:10.1007/s00011-020-01424-z |
| [16] |
Saitoh T, Kusunoki T, Yao T, et al. Role of interleukin-17A in the eosinophil accumulation and mucosal remodeling in chronic rhinosinusitis with nasal polyps associated with asthma[J]. Int Arch Allergy Immunol, 2010, 151(1): 8-16. DOI:10.1159/000232566 |
| [17] |
Conti HR, Shen F, Nayyar N, et al. Th17 cells and IL-17 receptor signaling are essential for mucosal host defense against oral candidiasis[J]. J Exp Med, 2009, 206(2): 299-311. DOI:10.1084/jem.20081463 |
| [18] |
De Luca A, Pariano M, Cellini B, et al. The IL-17F/IL-17RC axis promotes respiratory allergy in the proximal airways[J]. Cell Rep, 2017, 20(7): 1667-1680. DOI:10.1016/j.celrep.2017.07.063 |
| [19] |
Monin L, Gaffen SL. Interleukin 17 family cytokines: signaling mechanisms, biological activities, and therapeutic implications[J]. Cold Spring Harb Perspect Biol, 2018, 10(4): a028522. DOI:10.1101/cshperspect.a028522 |
| [20] |
Marchitto MC, Dillen CA, Liu HY, et al. Clonal Vγ6+Vδ4+ T cells promote IL-17-mediated immunity against Staphylococcus aureus skin infection[J]. Proc Natl Acad Sci U S A, 2019, 116(22): 10917-10926. DOI:10.1073/pnas.1818256116 |
| [21] |
Kusagaya H, Fujisawa T, Yamanaka K, et al. Toll-like receptor-mediated airway IL-17C enhances epithelial host defense in an autocrine/paracrine manner[J]. Am J Respir Cell Mol Biol, 2014, 50(1): 30-39. DOI:10.1165/rcmb.2013-0130OC |
| [22] |
Ramirez-Carrozzi V, Sambandam A, Luis E, et al. IL-17C regulates the innate immune function of epithelial cells in an autocrine manner[J]. Nat Immunol, 2011, 12(12): 1159-1166. DOI:10.1038/ni.2156 |
| [23] |
Archer NK, Harro JM, Shirtliff ME. Clearance of Staphylococcus aureus nasal carriage is T cell dependent and mediated through interleukin-17A expression and neutrophil influx[J]. Infect Immun, 2013, 81(6): 2070-2075. DOI:10.1128/IAI.00084-13 |
| [24] |
Ferraro A, Buonocore SM, Auquier P, et al. Role and plastici-ty of Th1 and Th17 responses in immunity to Staphylococcus aureus[J]. Hum Vaccin Immunother, 2019, 15(12): 2980-2992. DOI:10.1080/21645515.2019.1613126 |
| [25] |
Reiss-Mandel A, Rubin C, Zayoud M, et al. Staphylococcus aureus colonization induces strain-specific suppression of interleukin-17[J]. Infect Immun, 2018, 86(3): e00834-17. |
| [26] |
Awasthi A, Kuchroo VK. Th17 cells: from precursors to players in inflammation and infection[J]. Int Immunol, 2009, 21(5): 489-498. DOI:10.1093/intimm/dxp021 |
| [27] |
Ghosh R, Dey R, Sawoo R, et al. Neutralization of IL-17 and treatment with IL-2 protects septic arthritis by regulating free radical production and antioxidant enzymes in Th17 and Tregs: an immunomodulatory TLR2 versus TNFR response[J]. Cell Immunol, 2021, 370: 104441. DOI:10.1016/j.cellimm.2021.104441 |
| [28] |
Zhang SF, Huang XF, Xiu HQ, et al. The attenuation of Th1 and Th17 responses via autophagy protects against methicillin-resistant Staphylococcus aureus-induced sepsis[J]. Microbes Infect, 2021, 23(8): 104833. DOI:10.1016/j.micinf.2021.104833 |
| [29] |
Narita K, Hu DL, Asano K, et al. Interleukin-10 (IL-10) produced by mutant toxic shock syndrome toxin 1 vaccine-induced memory T cells downregulates IL-17 production and abrogates the protective effect against Staphylococcus aureus infection[J]. Infect Immun, 2019, 87(10): e00494-19. |
| [30] |
Lin L, Ibrahim AS, Xu X, et al. Th1-Th17 cells mediate protective adaptive immunity against Staphylococcus aureus and Candida albicans infection in mice[J]. PLoS Pathog, 2009, 5(12): e1000703. DOI:10.1371/journal.ppat.1000703 |
| [31] |
Narita K, Hu DL, Mori F, et al. Role of interleukin-17A in cell-mediated protection against Staphylococcus aureus infection in mice immunized with the fibrinogen-binding domain of clumping factor A[J]. Infect Immun, 2010, 78(10): 4234-4242. DOI:10.1128/IAI.00447-10 |
| [32] |
Murai M, Usui A, Seki K, et al. Intracellular localization of Staphylococcus aureus within primary cultured mouse kidney cells[J]. Microbiol Immunol, 1992, 36(5): 431-443. DOI:10.1111/j.1348-0421.1992.tb02042.x |
| [33] |
Dey I, Bishayi B. Impact of simultaneous neutralization of IL-17A and treatment with recombinant IL-2 on Th17-Treg cell population in S. aureus induced septic arthritis[J]. Microb Pathog, 2020, 139: 103903. DOI:10.1016/j.micpath.2019.103903 |
| [34] |
Handono K, Pratama MZ, Sari DK, et al. Effect of active immunization with IL-17A on B cell function and infection risk in pristane-induced lupus model[J]. Int J Rheum Dis, 2018, 21(6): 1277-1286. DOI:10.1111/1756-185X.13325 |
| [35] |
刘影, 胡志秀, 计银铎, 等. 外源IL-17抗体对金黄色葡萄球菌感染小鼠的影响[J]. 黑龙江畜牧兽医, 2021(7): 74-76, 80, 155. Liu Y, Hu ZX, Ji YD, et al. The effect of exogenous IL-17 antibody on Staphylococcus aureus infected mice[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(7): 74-76, 80, 155. DOI:10.13881/j.cnki.hljxmsy.2020.04.0308 |
| [36] |
Tsuji R, Fujii T, Nakamura Y, et al. Staphylococcus aureus epicutaneous infection is suppressed by Lactococcus lactis strain plasma via interleukin 17A elicitation[J]. J Infect Dis, 2019, 220(5): 892-901. DOI:10.1093/infdis/jiz204 |



