2. 国家老年疾病临床医学研究中心(湘雅医院),湖南 长沙 410008;
3. 中南大学湘雅医院心脏大血管外科,湖南 长沙 410008
2. National Clinical Research Center for Geriatric Disorders [Xiangya Hospital], Changsha 410008, China;
3. Department of Cardiovascular Surgery, Xiangya Hospital, Central South University, Changsha 410008, China
主动脉夹层是心血管疾病中极其凶险的一类急重症,其形成的机制为主动脉腔内血液通过损伤的内膜进入主动脉壁中层而形成“假腔”,即血肿。根据是否累及升主动脉分为A型和B型,其中,急性A型主动脉夹层(acute type A aortic dissection, AAAD)最为常见,约占58%~62%,病死率高达73%,住院前病死率为49%[1]。急诊外科手术是AAAD首选的治疗方法,但由于心脏手术耗时长、创伤大等缺点,术后极易出现感染[2]。术后肺炎是心脏手术后常见的感染性并发症,与患者住院病死率和医疗费用明显增加密切相关[3-4]。明确AAAD患者术后肺炎的危险因素,可有效评估与预测病情和病程进展,尽早识别术后肺炎高风险患者并实施干预[5]。本研究旨在分析AAAD患者发生手术后肺炎的危险因素,并构建风险预测模型。
1 对象与方法 1.1 研究对象回顾性选取中南大学湘雅医院2014年1月—2020年6月AAAD行急诊手术的患者为研究对象。纳入标准:①2周内出现疼痛或其他相关症状,经CT扫描或磁共振等影像学检查确诊为AAAD的首诊患者;②入院后48 h行急诊手术的患者;③年龄≥18岁。排除标准:①术中或术后24 h内死亡患者;②术前存在肺部感染或严重多器官功能衰竭患者;③基线资料中同时缺失3个及以上变量信息的患者。本研究为回顾性研究,经中南大学湘雅医院伦理委员会审核批准(伦理编号: 2019010038),患者知情同意被豁免。
1.2 诊断标准术后肺炎的诊断标准应同时满足[6]。①2张或2张以上连续胸部X片,至少有以下影像学改变之一(对于没有潜在肺部或心脏疾病的患者,1张X片即可):(a)新的/进行性和持续性浸润;(b)实变;(c)空化。②至少有以下症状之一:(a)发热(>38℃);(b)白细胞减少或增多;(c)成人>70岁,无其他原因的精神状态改变。③至少有以下两种情况:(a)新发脓痰或痰液性质改变,或呼吸道分泌物增多;(b)新发咳嗽或加重,或呼吸困难/急促;(c)啰音或支气管呼吸音;(d)气体交换恶化(低氧血症)。
1.3 资料收集回顾性收集所有患者的病例资料,包括:①人口学特征,年龄和性别;②既往史,输血史、吸烟史、饮酒史、马凡综合征、高血压、糖尿病、心包积血、慢性肾衰竭、脑血管疾病、冠状动脉疾病、慢性肺部疾病(指各种影响肺功能的长期疾病,如慢性阻塞性肺疾病、哮喘、自发性气胸、肺大泡等)和免疫缺陷病;③术前实验室指标,血型、凝血酶原时间、国际标准化比值、活化部分凝血活酶时间、红细胞分布宽度、中性粒细胞计数、淋巴细胞计数、血小板计数(PLT)和血小板分布宽度;④手术资料,主动脉根部替换术、全主动脉弓置换术、自体血回输(≥500 mL)、体外循环时长和手术时长;⑤住院管理措施,机械通气时长、肺炎发病前重症监护时间、围手术期抗菌药物使用和血制品输注情况;⑥其他临床结局,患者住院日数、住重症监护病房(ICU)日数,以及术后出现多器官功能衰竭、神经系统障碍、休克和住院死亡情况。
1.4 统计学方法通过均数/中位数插补部分患者缺失的资料。缺失情况如下:1例输血史不详(0.48%),缺失活化部分凝血活酶时间1例(0.48%),机械通气时长11例(5.23%),体外循环时长1例(0.48%),自体血回输1例(0.48%),住ICU日数1例(0.48%)。所有统计分析均使用R(版本4.2.1)和易侕统计(版本4.1)软件完成。正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验;偏态分布的计量资料采用中位数(四分位数间距)表示,组间比较采并Mann-Whitney U检验。计数资料采用绝对值和构成比表示,组间比较采用卡方检验,若频数<5则采用Fisher确切概率法。采用全子集回归并基于最小Mallows Cp值筛选预测因子,受试者工作特征(ROC)曲线和约登指数最大值确定连续型预测因子的最佳阈值。采用二分类logistic回归算法构建AAAD患者术后肺炎的预测模型并绘制列线图。采用ROC曲线下面积(AUC)评估模型的区分能力,校准曲线和Hosmer-Lemeshow检验评估模型的校准度,决策曲线评估该模型的临床应用价值。检验水准α=0.05。
2 结果 2.1 AAAD患者术后肺炎基线资料共有318例接受紧急手术的AAAD成人患者,排除术前合并肺部感染或严重多器官功能衰竭7例,术中或术后24 h内死亡11例,以及多项基线资料不全90例。最终共纳入210例AAAD患者,其中53例(25.24%)发生术后肺炎;平均年龄(49.93±11.35)岁,男性占比72.86%。与非术后肺炎组相比,术后肺炎组中患者慢性肺部疾病史占比(30.19% VS 15.92%)、中性粒细胞计数[(10.60±3.97)×109/L VS (9.35±3.83)×109/L]、血小板分布宽度(17.30% VS 17.00%)、手术时长(11.00 h VS 10.00 h)、机械通气时长(50.00 h VS 42.00 h)、红细胞(9.00单位VS 6.50单位)和血浆输注量(10.50治疗单位VS 9.30治疗单位)相对更高(均P<0.05)。此外,术后肺炎组患者住院日数和住ICU日数比非术后肺炎组更长(P<0.01)。术后肺炎组患者比非术后肺炎组发生多器官功能衰竭(16.98% VS 6.37%)、神经系统障碍(39.62% VS 20.38%)、休克(13.21% VS 7.01%)的比例更高(均P<0.05)。210例AAAD患者术后住院病死率为8.57%(18例),其中术后肺炎组高于非术后肺炎组(13.21% VS 7.01%)。AAAD患者术后肺炎的临床信息单因素分析结果见表 1。
| 表 1 210例AAAD患者术后肺炎单因素分析结果 Table 1 Univariate analysis result of postoperative pneumonia in 210 AAAD patients |

|
通过全子集回归筛选最小Mallows Cp值(-10.9)的预测因子组合(见图 1A),纳入模型的变量为性别、慢性肺部疾病、血小板分布宽度、手术时长、机械通气时长和红细胞输注量(见图 1B)。
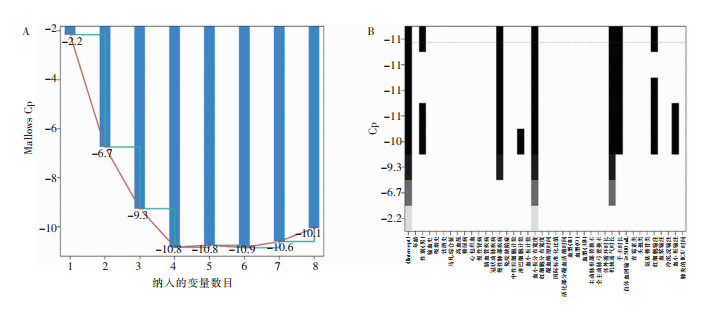 |
| 图 1 基于全子集回归的预测因子筛选图 Figure 1 Screening of predictive factors based on all-subsets regression |
以AAAD患者是否发生手术后肺炎为因变量,将全子集回归筛选出的4个连续型预测因子分别绘制ROC曲线,根据约登指数的最大值确定连续型预测因子的最佳截断值,并将其转化为二分类变量,见表 2。以AAAD患者是否发生手术后肺炎为因变量(是=1,否=0),将上述全子集回归筛选出的6个预测因子纳入模型中进行logistic回归分析,结果显示,男性OR为2.21(95%CI:0.88~5.54)、慢性肺部疾病史的OR为2.53(95%CI:1.12~5.74)、血小板分布宽度17.5%的OR为3.27(95%CI:1.57~6.78、手术时长9 h的OR为2.76(95%CI:1.25~6.06)、机械通气时长99 h的OR为3.87(95%CI:1.63~9.18)和红细胞输注9单位的OR为1.69(95%CI:0.80~3.60)。见表 3。
| 表 2 AAAD患者术后肺炎预测因子效能分析 Table 2 Efficacy of predictive factors for postoperative pneumonia in AAAD patients |
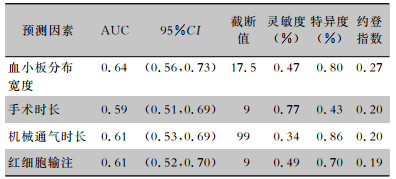
|
| 表 3 AAAD患者术后肺炎的预测因子logistic回归分析结果 Table 3 Logistic regression analysis result of postoperative pneumonia in AAAD patients |
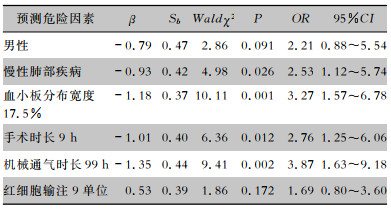
|
根据上述步骤构建AAAD患者术后肺炎预测模型绘制列线图(见图 2)。根据模型ROC曲线取约登指数最大值对应的截断值为最佳风险阈值,划分高、低风险人群。确定术后肺炎的预测概率为0.21,其灵敏度为0.85,特异度为0.68,对应总分约为157分,即模型预测概率>0.21的患者视为高风险人群。为了简便快速计算风险概率,进一步开发了网页版AAAD患者术后肺炎预测风险计算器,操作界面如图 3所示,扫描图中二维码可跳转至该网页进行操作。
 |
| 图 2 AAAD患者术后肺炎预测列线图 Figure 2 Nomogram for predicting postoperative pneumonia in AAAD patients |
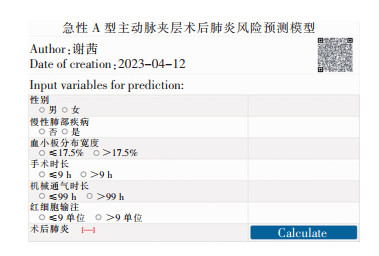 |
| 图 3 AAAD术后肺炎风险预测模型网络计算器示意图 Figure 3 Schematic diagram of the network calculator for AAAD postoperative pneumonia risk predictive model |
从AUC、校准度和决策曲线三方面对模型的性能进行评价,并采用Bootstrap内部验证。该模型的ROC曲线下面积AUC为0.789 (95%CI: 0.718~0.860),见图 4A,表明本研究所建立的预测模型具有良好的区分能力。通过校准曲线比较术后肺炎预测概率与实际概率,见图 4B,采用Hosmer-Lemeshow检验预测模型的拟合优度,结果显示两者之间差异无统计学意义(χ2=7.533,P=0.48),表明该模型具有良好的校准度。决策曲线显示本模型预测价值良好,见图 4C。
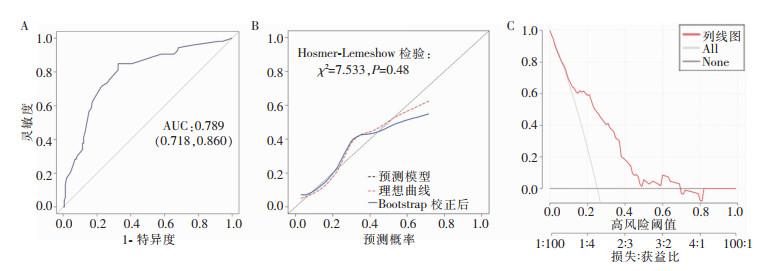 |
| 注: A为ROC曲线; B为校准曲线; C为决策曲线。 图 4 预测模型的评价结果 Figure 4 Assessment of the predictive model |
术后肺炎是心脏手术后最常见的并发症,特别是术后第一周[7]。AAAD开胸手术创伤大,需要体外循环,加上术中长时间的胸部暴露、麻醉和低温等因素,患者术后肺通气不足,膈肌活动差,咳嗽反射受损或受抑制,支气管痉挛和脱水,均可引起支气管分泌物滞留,导致肺不张,进而发生肺部感染。术后肺炎不仅会延长患者住ICU时间和住院时间,还会增加其他并发症风险和病死率[8]。本研究结果也证实上述结论,即术后肺炎组患者住院日数和住ICU日数延长,多器官功能衰竭、神经系统障碍、休克及死亡的比例均高于非术后肺炎组。因此,早期预防并采取有效措施降低AAAD术后肺炎发生率对改善患者预后具有积极的作用。本研究通过全子集回归对AAAD患者所有预测变量的可能组合进行模型拟合,进而构建预测列线图,并发布了网页版AAAD患者术后肺炎预测风险计算器,可供使用者简便、快速计算出患者术后肺炎的风险概率,有助于临床医生作出及时、合理的干预策略。
本研究确定的6个预测因子分别是性别、慢性肺部疾病、血小板分布宽度、手术时长、机械通气时长和围手术期红细胞输注。男性作为预测因子之一被纳入本预测模型中,一项来自北卡罗莱纳大学医院对88 487例住院患者的医院感染危险因素研究发现,男性与非器械相关肺炎发病率的增加相关[9]。尽管不同研究[10-12]的结果显示,心脏手术后肺炎的独立危险因素相差异较大,但慢性肺部疾病作为术后肺炎的预测因素已在文献中得到广泛报道。在我们的前期研究[13]中已发现,高血小板分布宽度是AAAD术后肺炎的独立危险因素(OR: 1.07, 95%CI: 1.02~1.13)。血小板分布宽度是反映血小板活化最常用的指标之一,活化的血小板能释放多种生物活性物质,促进白细胞的滚动、黏附和募集,触发或加重急性炎症性肺损伤[14]。另外,血小板可调节肺微血管内皮屏障功能和完整性,并影响肺泡毛细血管膜、气管支气管树和肺血管的病理炎症过程[15]。手术时长通常与体外循环时间和主动脉阻隔时间呈正相关[16]。体外循环常引起全身炎症反应,长时间的主动脉阻断可能导致心肌受损,且手术的侵入性操作时间越长,对患者的气道黏膜和免疫功能损伤越大,这些均会增加术后感染的风险。因此,临床医生术前应充分了解患者的病情,熟悉手术操作技术,尽量缩短手术时间,改善患者预后。AAAD开胸手术创伤大,患者术后通常需要进行机械通气改善呼吸,尤其是部分合并慢性肺部疾病患者。然而,机械通气作为一种侵入性操作,长时间插管会破坏呼吸道的正常屏障,增加细菌感染的风险,诱发呼吸机相关肺炎[17]。机械通气时长与呼吸机相关肺炎的发生密切相关[4, 18]。因此,对于肺功能不全需要长期应用呼吸机通气的患者,应注意清理呼吸道分泌物,预防用药保持呼吸道通畅,加强术后肺功能康复。异体红细胞大量输注可引起输血相关免疫调节[19],易发生输血相关炎症反应;加上红细胞随着保存时间的延长会发生储存损伤,可能与患者术后肺炎风险增加有关[20]。Kim等[21]在小鼠输血模型中发现,从老化的红细胞中分离的微粒可通过P-选择素刺激肺微血栓的形成。一项对1 076所医院的362 954例冠状动脉旁路移植术患者进行的观察性队列研究表明,术中红细胞输注与患者术后医院感染风险增加相关[22]。因此,限制围手术期输血,有助于降低术后肺炎发生的风险。
本文构建的AAAD患者术后肺炎预测模型表现出良好的区分度和校准度,对降低AAAD患者术后肺炎的发生具有一定的指导意义。本模型确定的术后肺炎高风险患者的阈值概率为0.21,提示在临床中应对AAAD患者术后肺炎风险大于0.21的患者给予更多的关注,尽早干预。然而,本研究依然存在一定的缺陷,如本研究为单中心回顾性研究,模型缺乏外部验证;样本数量有限,可能存在一定的偏倚。另外,本研究队列由于样本量较小,根据P<0.05筛选变量会忽略到某些重要的因素,本模型筛选变量采用的是全子集回归的统计方法,目前已有研究表明,男性和红细胞输注量是急性A型主动脉夹层患者术后不良预后的危险因素,综合文献报道和临床意义将这两个变量纳入模型中。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Gudbjartsson T, Ahlsson A, Geirsson A, et al. Acute type A aortic dissection-a review[J]. Scand Cardiovasc J, 2020, 54(1): 1-13. DOI:10.1080/14017431.2019.1660401 |
| [2] |
Jaffar-Karballai M, Tran TT, Oremakinde O, et al. Malperfusion in acute type A aortic dissection: management strategies[J]. Vasc Endovascular Surg, 2021, 55(7): 721-729. DOI:10.1177/15385744211017116 |
| [3] |
Torres A, Niederman MS, Chastre J, et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia: guidelines for the management of hospital-acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the European Respiratory Society (ERS), European Society of Intensive Care Medicine (ESICM), European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and Asociación Latinoamericana del Tórax (ALAT)[J]. Eur Respir J, 2017, 50(3): 1700582. DOI:10.1183/13993003.00582-2017 |
| [4] |
Ailawadi G, Chang HL, O'Gara PT, et al. Pneumonia after cardiac surgery: experience of the National Institutes of Health/Canadian Institutes of Health Research Cardiothoracic Surgical Trials Network[J]. J Thorac Cardiovasc Surg, 2017, 153(6): 1384-1391. e3. DOI:10.1016/j.jtcvs.2016.12.055 |
| [5] |
Bardia A, Blitz D, Dai F, et al. Preoperative chlorhexidine mouthwash to reduce pneumonia after cardiac surgery: a systematic review and Meta-analysis[J]. J Thorac Cardiovasc Surg, 2019, 158(4): 1094-1100. DOI:10.1016/j.jtcvs.2019.01.014 |
| [6] |
Abbott TEF, Fowler AJ, Pelosi P, et al. A systematic review and consensus definitions for standardised end-points in perioperative medicine: pulmonary complications[J]. Br J Anaesth, 2018, 120(5): 1066-1079. DOI:10.1016/j.bja.2018.02.007 |
| [7] |
Bateman BT, Bykov K, Choudhry NK, et al. Type of stress ulcer prophylaxis and risk of nosocomial pneumonia in cardiac surgical patients: cohort study[J]. BMJ, 2013, 347: f5416. DOI:10.1136/bmj.f5416 |
| [8] |
Montrief T, Koyfman A, Long B. Coronary artery bypass graft surgery complications: a review for emergency clinicians[J]. Am J Emerg Med, 2018, 36(12): 2289-2297. DOI:10.1016/j.ajem.2018.09.014 |
| [9] |
Strassle PD, Sickbert-Bennett EE, Klompas M, et al. Incidence and risk factors of non-device-associated pneumonia in an acute-care hospital[J]. Infect Control Hosp Epidemiol, 2020, 41(1): 73-79. DOI:10.1017/ice.2019.300 |
| [10] |
Wang DS, Lu Y, Sun MD, et al. Pneumonia after cardiovascular surgery: incidence, risk factors and interventions[J]. Front Cardiovasc Med, 2022, 9: 911878. DOI:10.3389/fcvm.2022.911878 |
| [11] |
Strobel RJ, Liang QX, Zhang M, et al. A preoperative risk model for postoperative pneumonia after coronary artery bypass grafting[J]. Ann Thorac Surg, 2016, 102(4): 1213-1219. DOI:10.1016/j.athoracsur.2016.03.074 |
| [12] |
Kilic A, Ohkuma R, Grimm JC, et al. A novel score to estimate the risk of pneumonia after cardiac surgery[J]. J Thorac Cardiovasc Surg, 2016, 151(5): 1415-1420. DOI:10.1016/j.jtcvs.2015.12.049 |
| [13] |
Xie X, Yan DY, Liu X, et al. High platelet distribution width is an independent risk factor of postoperative pneumonia in patients with type A acute aortic dissection[J]. Front Cardiovasc Med, 2022, 9: 984693. DOI:10.3389/fcvm.2022.984693 |
| [14] |
Guo L, Rondina MT. The era of thromboinflammation: platelets are dynamic sensors and effector cells during infectious di-seases[J]. Front Immunol, 2019, 10: 2204. DOI:10.3389/fimmu.2019.02204 |
| [15] |
Middleton EA, Weyrich AS, Zimmerman GA. Platelets in pulmonary immune responses and inflammatory lung diseases[J]. Physiol Rev, 2016, 96(4): 1211-1259. DOI:10.1152/physrev.00038.2015 |
| [16] |
王美珠, 孙惠英, 常琰, 等. 成人心脏手术后呼吸机相关肺炎的危险因素[J]. 中国感染控制杂志, 2022, 21(8): 798-804. Wang MZ, Sun HY, Chang Y, et al. Risk factors for ventilator-associated pneumonia following cardiac surgery in adults[J]. Chinese Journal of Infection Control, 2022, 21(8): 798-804. |
| [17] |
Perren A, Brochard L. Managing the apparent and hidden difficulties of weaning from mechanical ventilation[J]. Intensive Care Med, 2013, 39(11): 1885-1895. DOI:10.1007/s00134-013-3014-9 |
| [18] |
Papazian L, Klompas M, Luyt CE. Ventilator-associated pneumonia in adults: a narrative review[J]. Intensive Care Med, 2020, 46(5): 888-906. DOI:10.1007/s00134-020-05980-0 |
| [19] |
Remy KE, Hall MW, Cholette J, et al. Mechanisms of red blood cell transfusion-related immunomodulation[J]. Transfusion, 2018, 58(3): 804-815. DOI:10.1111/trf.14488 |
| [20] |
Jones AR, Patel RP, Marques MB, et al. Older blood is associated with increased mortality and adverse events in massively transfused trauma patients: secondary analysis of the PROPPR trial[J]. Ann Emerg Med, 2019, 73(6): 650-661. DOI:10.1016/j.annemergmed.2018.09.033 |
| [21] |
Kim Y, Goodman MD, Jung AD, et al. Microparticles from aged packed red blood cell units stimulate pulmonary microthrombus formation via P-selectin[J]. Thromb Res, 2020, 185: 160-166. DOI:10.1016/j.thromres.2019.11.028 |
| [22] |
Mazzeffi MA, Holmes SD, Taylor B, et al. Red blood cell transfusion and postoperative infection in patients having coronary artery bypass grafting surgery: an analysis of the society of thoracic surgeons adult cardiac surgery database[J]. Anesth Analg, 2022, 135(3): 558-566. DOI:10.1213/ANE.0000000000005920 |



