脲原体是介于细菌与病毒之间的最小原核生物,具有一定的黏附力,主要定植于泌尿生殖道和呼吸道, 与不孕症、死产、早产、绒毛膜羊膜炎有关[1-3]。微小脲原体(ureaplasma parvu, UP)是从脲原体属中分离出来的一个新物种,易定植于新生儿气管及鼻咽部,可导致新生儿肺炎、脑膜炎、支气管肺发育不良和围产期死亡。UP脑膜炎临床比较少见,早期表现不典型,病原诊断存在一定难度,易伴发脑积水、颅内出血等并发症,从而影响脑发育[4],早期诊治能改善新生儿的预后。本文回顾性分析2019年11月—2020年12月收入某院新生儿重症监护病房的两例因UP感染引起的脑膜炎早产儿临床资料,总结其临床、实验室检查特点,为临床早期诊断、及时治疗、判断预后提供依据。
1 病历资料 1.1 病例1早产儿男性,入院时9 d 6 h,因“气促9 d,发热1 d”入院。早产儿系孕35+6周顺产娩出,无胎膜早破,Apgar评分1、5 min均为10分,出生体重2.98 kg,母亲孕期有阴道炎病史。体格检查包括体温(T)38.6℃,脉搏(P)155次/分,呼吸(R)60次/分,血压(BP)87/46 mmHg;神志清楚,反应可,呼吸浅促,双下肢及躯干部皮肤少许花纹,前囟平软,双肺呼吸音粗糙,未闻及干湿啰音;心脏及腹部检查无异常;四肢肌张力偏高。入院后查血,C反应蛋白(CRP)<8 mg/L,血常规白细胞计数(WBC)22.61×109/L,中性粒细胞(N)占66.8%;胸片提示两肺片絮影;聚合酶链反应(polymerase chain reaction, PCR)检测痰脲原体脱氧核糖核酸(DNA)阳性(5.79×103 copies);血培养阴性;头颅B超提示双侧脑室增大(左侧体宽7.2 mm,右侧体宽8.3 mm);脑脊液WBC 3 617×106/L,葡萄糖浓度0.05 mmol/L,蛋白质浓度2.53 g/L,脑脊液培养阴性。诊断为新生儿肺炎、新生儿化脓性脑膜炎。给予万古霉素及美罗培南抗感染9 d,脑脊液WBC较前明显下降,但脑脊液葡萄糖及蛋白质浓度无明显改善,头围进行性增大,头颅超声提示脑室较前扩大(左20.0 mm,右16.8 mm)。入院第12天头颅磁共振(MRI)提示幕上脑积水,见图 1A,同时送检脑脊液宏基因组二代测序(metagenomic next-generation sequencing, mNGS),结果显示UP阳性,检出序列数18 054,可信度99%,停用万古霉素及美罗培南,改用红霉素静脉滴注4 d,复查脑脊液葡萄糖、蛋白质浓度, 以及头颅超声,无任何改善。入院第17天抗菌药物调整为静脉制剂阿奇霉素,同时行侧脑室穿刺适当放脑脊液以减轻颅内压,治疗4周,复查脑脊液WBC、葡萄糖及蛋白质浓度恢复正常,脑脊液mNGS复查未检出病原体。复查头颅超声显示左侧脑室体宽13.5 mm,右侧脑室体宽13.2 mm;复查头颅MRI平扫可见幕上脑积水较前次明显好转,见图 1B。出院后门诊随诊,4月龄时复查头颅超声有进一步改善;9月龄、14月龄行儿童神经心理发育检查(developmental screen test, DST),运动、社会适应能力、智力、语言评分均在正常范围。
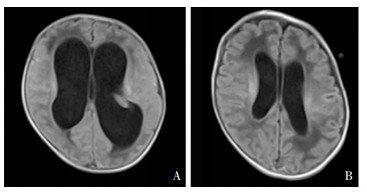 |
| 注:A为阿奇霉素治疗前,B为阿奇霉素治疗4周后。 图 1 病例1头颅MRI检查结果 Figure 1 Brain MRI examination results of case 1 |
早产儿女性,入院时17 d 9 h,因“间断发热、反应差17 d余”入院。早产儿系孕31+6周因“胎膜早破18 h、母妊娠期糖尿病”剖宫产出生,Apgar评分1、5 min分别为7、8分,出生体重1.6 kg。早产儿出生后血培养结果为大肠埃希菌,以“新生儿败血症、肺炎”在外院予持续气道正压通气(continuous positive airway pressure, CPAP)、抗感染治疗,效果欠佳。入院体格检查结果T 37.3℃,P 146次/分,R 55次/分,BP 63/41 mmHg;神志清,反应差,前囟平软,呼吸促,双肺少许痰鸣音,心脏、腹部检查无异常,四肢肌张力低。入院后血常规和CRP在正常范围;胸片显示两肺可见絮状模糊影;痰PCR脲原体DNA阳性(6.13×105 copies);血培养复查阴性;脑脊液WBC 2 245×106/L,葡萄糖浓度0.18 mmol/L,蛋白质浓度1.98 g/L,脑脊液培养阴性;头颅B超显示左侧脑室体宽6.3 mm,右侧脑室体宽5.8 mm,诊断为新生儿肺炎、新生儿败血症、新生儿化脓性脑膜炎,予哌拉西林/舒巴坦钠、美罗培南抗感染,早产儿反应好转,体温正常,呼吸平稳,逐渐撤离CPAP,脑脊液WBC明显下降,但脑脊液蛋白质浓度持续升高(2.44~3.01 g/L),脑脊液葡萄糖浓度持续降低(0.1~0.69 mmol/L)。入院4周后复查头颅超声显示左、右侧脑室体宽均为11.8 mm;头颅MRI提示双侧脑室饱满,轻度缺氧缺血性改变,见图 2A。完善脑脊液mNGS检测结果显示UP阳性,检出序列数37,可信度99%;抗菌药物改用静脉使用阿奇霉素。3周后复查脑脊液,WBC、蛋白质、葡萄糖浓度均在正常范围;头颅超声显示左侧脑室体宽12.0 mm,右侧脑室宽11.6 mm;复查脑脊液mNGS病原学检测阴性;复查头颅MRI显示双侧脑室饱满,缺氧脑损伤改变较前好转,见图 2B,早产儿一般情况可,予出院。出院后当地医院随访,3月半月龄时复查头颅MRI提示两侧侧脑室增宽,左侧脑室较宽处11.2 mm,右侧脑室较宽处10.1 mm,随访至18个月,其运动、社会适应能力、智力发育在纠正胎龄正常范围。
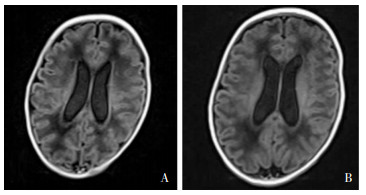 |
| 注:A为阿奇霉素治疗前,B为阿奇霉素治疗3周后。 图 2 病例2头颅MRI检查结果 Figure 2 Brain MRI examination results of case 2 |
新生儿脑膜炎是新生儿期一种严重的神经系统感染性疾病,可由不同病原引起,较常见病原体为大肠埃希菌、无乳链球菌等[5-6],而UP引起的早产儿脑膜炎临床罕见,缺乏特异的临床症状,病原学检出率低,易漏诊。
脲原体属人支原体科,包括解脲脲原体和UP,缺乏细胞壁,主要寄生于成人泌尿生殖道和新生儿呼吸道。新生儿感染脲原体后肺组织和中枢神经系统最易受累,是早产儿脑白质损伤、支气管肺发育不良的主要致病因素之一。由于UP无细胞壁,营养要求比一般细菌高,普通培养基很难培养出菌落,而mNGS可以快速、精准地检测到包括UP在内的难培养或不可培养的微生物[7-9]。本文两例早产儿在多次脑脊液培养阴性的情况下,利用mNGS技术明确了UP为脑膜炎病原体,为临床治疗指明了方向。
新生儿脲原体感染主要来源于母婴传播。研究[10]表明,脲原体的垂直传播率为18%~88%。新生儿UP脑膜炎顺产多见,经产道分娩后,新生儿的皮肤、黏膜及呼吸道容易被病原体定植引起感染,母亲宫颈环扎术、阴道炎、胎膜早破可能为新生儿UP感染的高危因素[11-13]。
新生儿UP脑膜炎有早发型和晚发型,临床主要表现为发热、抽搐、肌张力低、呼吸暂停、结膜炎、循环不稳定等[4, 6, 10-16],脑脊液检查均表现为葡萄糖浓度明显降低、蛋白质浓度显著升高。虽然早产儿和足月儿UP感染比例相近,但早产儿免疫力低,为UP感染的高危人群[11]。由于UP缺乏细胞壁,作用于细胞壁的抗菌药物对其无效,其治疗依赖于大环内酯、四环素、克林霉素、氯霉素和喹诺酮类等影响蛋白质或DNA合成的抗菌药物[17],也有部分新生儿病例使用环丙沙星,个别选择氯霉素进行抗感染治疗[12-15]。但对于新生儿而言,四环素可引起永久性牙齿变色或骨骼异常,氯霉素可引起“灰色婴儿综合征”或血液不良,喹诺酮类药物有关节致病作用,故大环内酯类(如红霉素)在治疗非典型病原体中应用较多。已有用红霉素成功治愈UP脑膜炎的病例[11], 但也有研究[18-19]表明红霉素的脑脊液渗透率较差,治疗脑膜炎效果欠佳。与红霉素相比,阿奇霉素化学稳定性和耐受性更好,抗菌谱更广,治疗时间短且半衰期长[16]。针对新生儿UP脑膜炎,抗菌药物疗程一般为3~4周,治疗后脑脊液蛋白质和葡萄糖水平基本恢复正常,个别重症病例疗程可延长至5~6周。UP脑膜炎并发症发生率高,出现早,进展快,脑积水占首位,颅内出血、硬膜下积液等并发症也会出现,部分脑积水病例接受了脑室-腹腔分流术[12-14],随访时间5~30月龄不等,经过针对性治疗后,大多数患儿生长发育在同龄婴幼儿中基本正常[10-13, 16-20]。
该院两例UP脑膜炎均为早产儿。病例1为早发型;病例2因早期明确大肠埃希菌感染,而脑脊液UP于生后7周才通过mNGS技术检出,故该早产儿UP脑膜炎发病时间难以确定。与既往报道[21]UP脑膜炎可引起严重临床表现不同,本研究两例早产儿无抽搐、呼吸暂停、循环衰竭等重症感染表现,但两者脑脊液葡萄糖浓度极低(均<0.1 mmol/L),蛋白质浓度异常升高,侧脑室进行性增大,实验室及影像学检查均提示为重症化脓性脑膜炎,与早产儿较轻的临床表现不一致。病例1曾经接受4 d红霉素治疗,脑脊液指标未见好转,侧脑室仍然进行性增大,阿奇霉素治疗5 d后,脑脊液和头颅超声明显改善;病例2使用阿奇霉素3 d后复查脑脊液指标明显好转,提示阿奇霉素对这两例病例的治疗效果优于红霉素。病例1虽然伴发脑积水,但阿奇霉素治疗后脑积水逐渐改善,故未行脑室-腹腔分流术;病例2侧脑室增大,针对性治疗后短期内侧脑室宽度未见明显改善,但也未见加重。两病例出院后随访,监测其生长发育与同龄儿童相仿,预后良好,与以往报道[6, 10, 12-13]一致,表明只要给予积极、正确的治疗,UP脑膜炎一般不影响患儿的最终预后。
两例早产儿早期呼吸道分泌物PCR检测均提示脲原体属阳性,在明确化脓性脑膜炎诊断时,应尽早结合呼吸道病原学检查结果判断脑脊液是否也存在脲原体属感染,并及时给予针对性治疗,以减少脑积水等并发症的发生,此为诊断两个病例的不足之处,为今后类似临床病例的诊断积累了经验。
UP脑膜炎的临床表现缺乏特异性。临床症状可能与严重的脑脊液及影像学检查结果不符:脑脊液表现为典型的葡萄糖浓度极低,蛋白质含量异常升高;影像学检查显示侧脑室进行性增大。当常规抗菌药物治疗效果欠佳,或呼吸道等其他部位有脲原体等特殊病原体感染或定植时,应警惕脲原体等特殊病原体引起的脑膜炎,尽早行脑脊液mNGS检测以明确病原。目前大环内酯类是用于新生儿UP感染的主要抗生素,阿奇霉素效果是否优于红霉素,仍需进行多中心、大样本的临床研究。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Fleming D, Karau M, Patel R. A novel bioreactor for the stable growth of Ureaplasma parvum and Ureaplasma urealyti-cum[J]. J Microbiol Methods, 2021, 181: 106131. DOI:10.1016/j.mimet.2020.106131 |
| [2] |
Glaser K, Gradzka-Luczewska A, Szymankiewicz-Breborowicz M, et al. Perinatal Ureaplasma exposure is associated with increased risk of late onset sepsis and imbalanced inflammation in preterm infants and may add to lung injury[J]. Front Cell Infect Microbiol, 2019, 9: 68. DOI:10.3389/fcimb.2019.00068 |
| [3] |
Silwedel C, Speer CP, Härtel C, et al. Ureaplasma-driven neuroinflammation in neonates: assembling the puzzle pieces[J]. Neonatology, 2020, 117(6): 665-672. DOI:10.1159/000512019 |
| [4] |
Zhan CY, Chen LH, Hu LL. Neonatal Ureaplasma parvum meningitis complicated with subdural hematoma: a case report and literature review[J]. BMC Infect Dis, 2021, 21(1): 268. DOI:10.1186/s12879-021-05968-1 |
| [5] |
Xu M, Hu L, Huang HY, et al. Etiology and clinical features of full-term neonatal bacterial meningitis: a multicenter retrospective cohort study[J]. Front Pediatr, 2019, 7: 31. DOI:10.3389/fped.2019.00031 |
| [6] |
Travier L, Alonso M, Andronico A, et al. Neonatal susceptibility to meningitis results from the immaturity of epithelial barriers and gut microbiota[J]. Cell Rep, 2021, 35(13): 109319. DOI:10.1016/j.celrep.2021.109319 |
| [7] |
中华医学会检验医学分会. 宏基因组测序病原微生物检测生物信息学分析规范化管理专家共识[J]. 中华检验医学杂志, 2021, 44(9): 799-807. Chinese Society of Laboratory Medicine. Expert consensus on the standardized management of bioinformatics analysis for the detection of pathogenic microorganisms in mNGS[J]. Chinese Journal of Laboratory Medicine, 2021, 44(9): 799-807. |
| [8] |
徐齐齐, 雷冰, 徐佳瑶, 等. 宏基因组二代测序诊断新生儿微小脲原体脑膜炎一例并文献复习[J]. 中国小儿急救医学, 2022, 29(2): 155-158. Xu QQ, Lei B, Xu JY, et al. Metagenomics next-generation sequencing of a case of neonatal Ureaplasma parvum meningitis and literature review[J]. Chinese Pediatric Emergency Medicine, 2022, 29(2): 155-158. DOI:10.3760/cma.j.issn.1673-4912.2022.02.017 |
| [9] |
Wilson MR, Sample HA, Zorn KC, et al. Clinical meta-genomic sequencing for diagnosis of meningitis and encephalitis[J]. N Engl J Med, 2019, 380(24): 2327-2340. DOI:10.1056/NEJMoa1803396 |
| [10] |
Peretz A, Tameri O, Azrad M, et al. Mycoplasma and Urea-plasma carriage in pregnant women: the prevalence of transmission from mother to newborn[J]. BMC Pregnancy Childbirth, 2020, 20(1): 456. DOI:10.1186/s12884-020-03147-9 |
| [11] |
Sprong KE, Mabenge M, Wright CA, et al. Ureaplasma species and preterm birth: current perspectives[J]. Crit Rev Microbiol, 2020, 46(2): 169-181. DOI:10.1080/1040841X.2020.1736986 |
| [12] |
Clifford V, Tebruegge M, Everest N, et al. Ureaplasma: pathogen or passenger in neonatal meningitis?[J]. Pediatr Infect Dis J, 2010, 29(1): 60-64. DOI:10.1097/INF.0b013e3181b21016 |
| [13] |
Glaser K, Wohlleben M, Speer CP. An 8-month history of meningitis in an extremely low birth weight infant? - Long-lasting infection with Ureaplasma parvum[J]. Z Geburtshilfe Neonatol, 2015, 219(1): 52-56. |
| [14] |
Biran V, Dumitrescu AM, Doit C, et al. Ureaplasma parvum meningitis in a full-term newborn[J]. Pediatr Infect Dis J, 2010, 29(12): 1154. |
| [15] |
Keus AMJMH, Peeters DD, Bekker VV, et al. Neonatal meningitis and subdural empyema caused by an unusual pathogen[J]. Pediatr Infect Dis J, 2019, 38(12): e329-e331. DOI:10.1097/INF.0000000000002482 |
| [16] |
张丽花, 韩军, 于泽堃, 等. 阿奇霉素成功治疗脲原体脑膜炎1例[J]. 中华新生儿科杂志, 2022, 37(2): 177-178. Zhang LH, Han J, Yu ZK, et al. Azithromycin cured a case of Ureaplasma meningitis successfully[J]. Chinese Journal of Neonatology, 2022, 37(2): 177-178. |
| [17] |
Stol K, Jans J, Ott de Bruin L, et al. Perinatal infections with Ureaplasma[J]. Pediatr Infect Dis J, 2021, 40(5S): S26-S30. DOI:10.1097/INF.0000000000002859 |
| [18] |
Qin L, Li YH, Cao XJ, et al. Clinical metagenomic sequencing for rapid diagnosis of neonatal meningitis caused by Urea-plasma parvum: a case report[J]. Medicine (Baltimore), 2022, 101(4): e28662. DOI:10.1097/MD.0000000000028662 |
| [19] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 5版. 北京: 人民卫生出版社, 2019: 543-546. Shao XM, Ye HM, Qiu XS. Practice of neonatology[M]. 5th ed. Beijing: People's Medical Publishing House, 2019: 543-546. |
| [20] |
Wang Q, Wang K, Zhang YB, et al. Neonatal Ureaplasma parvum meningitis: a case report and literature review[J]. Transl Pediatr, 2020, 9(2): 174-179. DOI:10.21037/tp.2020.02.04 |
| [21] |
许邦礼, 康文清. 新生儿重症化脓性脑膜炎临床特征分析[J]. 中国小儿急救医学, 2021, 28(4): 312-315. Xu BL, Kang WQ. Clinical characteristics of neonatal severe purulent meningitis[J]. Chinese Pediatric Emergency Medicine, 2021, 28(4): 312-315. |



