医院获得性感染(healthcare-associated infection, HAI)是指住院患者在医院获得的感染,包括住院期间发生的感染和在医院内获得、出院后发生的感染,但不包括入院前已开始或入院时已存在的感染;医院工作人员在医院内获得的感染也属医院感染[1]。随着HAI细菌谱构成、耐药率不断变化,给临床抗感染治疗带来了很大挑战,因此,我国在全国范围内定期进行现患率及抗菌药物使用情况调查[2],以期了解HAI细菌分布及耐药率,给临床确定感染治疗方案提供依据。心脏外科瓣膜成形和(或)置换术后发生HAI不容忽视,HAI不仅影响瓣膜手术的治疗成败,而且将严重影响患者的预后[3]。心脏瓣膜手术操作精细、手术时间长,围手术期外科医生习惯性使用抗菌药物预防术后感染。随着细菌耐药率的逐年上升,多重耐药(multidrug resistance, MDR)、泛耐药(extensive drug resistance, XDR)、甚至全耐药(pandrug resistance, PDR)细菌的出现和流行,使得瓣膜术后抗感染治疗非常困难[4-5]。2022年CHINET中国细菌耐药监测[6]结果显示,医院获得性感染细菌仍以革兰阴性菌为主(71%),且耐药率有逐年上升的趋势,尤其是耐碳青霉烯类革兰阴性菌(carbapenem-resistant Gram-negative bacillus,CR-GNB)的出现,对于临床常用抗菌药物耐药率始终维持在高位,而革兰阳性菌的检出及对多种抗菌药物耐药率均偏低[6]。革兰阴性菌尤其是肠杆菌目细菌和非发酵菌(鲍曼不动杆菌和铜绿假单胞菌等)是HAI的常见病原体,常引起呼吸系统、血液系统、泌尿生殖系统和皮肤软组织等感染,并对临床常用的多种抗菌药物耐药率逐年升高[7]。碳青霉烯类药物曾经一度作为临床上治疗多重耐药革兰阴性杆菌感染的一线药物甚至是王牌药物,但随着其广泛使用,导致耐药率迅速攀升[8]。心脏瓣膜术后一旦发生CR-GNB感染,抗菌药物选择受限,目前常用的几种备选药物不仅价格昂贵,而且因药代动力学特性并不优越,以及不良反应等问题,使得CR-GNB感染治疗非常困难。因此,本研究通过回顾性分析首都医科大学附属北京安贞医院心脏外科瓣膜术后发生HAI的数据,特别是革兰阴性杆菌感染患者的临床资料,分析CR-GNB感染的临床特征,常用抗菌药物的耐药性及感染发生的影响因素,为预防和治疗瓣膜术后CR-GNB感染提供参考依据。
1 对象与方法 1.1 研究对象收集首都医科大学附属北京安贞医院2018年1月—2021年10月心脏外科瓣膜术后HAI患者完整的病历资料,HAI参照2001年卫生部发行的《医院感染诊断标准(试行)》[1, 9]进行诊断。纳入标准:(1)接受开胸心脏瓣膜置换和(或)成形术;(2)术后合格的临床标本分离出革兰阴性菌、革兰阳性菌,且患者有临床感染的表现。排除标准:(1)排除术前发生感染、定植(临床分离出革兰阴性菌,但患者无感染相关的临床症状或体征);(2)从同一患者同一部位分离的重复菌株只统计首次分离菌株结果。本研究通过该院伦理委员会伦理审查(批号:2023041X),所有患者均签署知情同意书。
根据患者临床标本是否检出CR-GNB分为CR-GNB组和非耐碳青霉烯类革兰阴性菌(non-CR-GNB)组,将发生CR-GNB感染的患者归入CR-GNB组,如同时发生non-CR-GNB,仅归入CR-GNB组。选取同时期瓣膜术后非感染患者,按照年龄、性别与CR-GNB组和non-CR-GNB组分别以2 ∶1匹配非感染(non-infected)组。
1.2 研究方法 1.2.1 细菌鉴定与药敏试验采用布鲁克MALDI Biotyper系统全自动微生物质谱仪进行细菌鉴定,质控菌株为大肠埃希菌ATCC 25922、粪肠球菌ATCC 29212、金黄色葡萄球菌ATCC 29213和铜绿假单胞菌ATCC 27853。药敏试验采用法国梅里埃生物有限公司生产的梅里埃革兰阴性细菌药敏卡AST-N334和AST-N335进行检测,药敏卡包括以下抗菌药物:哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、头孢曲松、头孢吡肟、头孢他啶、左氧氟沙星、环丙沙星、阿米卡星、庆大霉素、复方磺胺甲口恶唑、阿莫西林/克拉维酸、氨苄西林/舒巴坦、妥布霉素、头孢呋辛、多西环素、替加环素、多黏菌素,采用K-B法进行药敏结果的复核,药敏结果参照美国临床实验室标准化协会(CLSI)判断标准判读。CR-GNB是指该分离菌株对碳青霉烯类药物如亚胺培南、美罗培南、多利培南或厄他培南中任何一种药物不敏感;对亚胺培南天然不敏感的细菌(如摩根菌属、变形杆菌属、普罗维登斯菌属)需要对除亚胺培南以外的任何一种碳青霉烯类药物不敏感[10-11]。
1.2.2 数据收集通过该院电子病历系统(HIS系统)收集符合纳入标准的心脏外科瓣膜术后住院患者完整的病历资料,包括:(1)一般情况,患者性别、年龄、重症监护病房(intensive care unit, ICU)停留时间、感染前住院时间、感染后住院时间、总住院时间;(2)手术情况,开胸手术时间、体外循环时间;(3)实验室检查结果,血常规、血气分析、肝肾功能、电解质;(4)感染前使用抗菌药物情况,使用碳青霉烯类、头孢菌素、β-内酰胺酶抑制剂、万古霉素、多黏菌素、喹诺酮类,以及联合使用2种及以上抗菌药物等情况;(5)住院结局,死亡或存活。
1.3 数据处理应用SPSS 26.0软件进行数据处理分析,符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验,非正态分布采用非参数检验;计数资料以例数和百分比(%)表示,组间比较采用χ2检验。采用单因素分析方法分析瓣膜术后CR-GNB组与non-CR-GNB组患者,CR-GNB组、non-CR-GNB组与non-infected组患者的临床特征,以及感染的影响因素。将单因素分析具有统计学意义的变量通过二元logistic回归进行多因素分析,确定CR-GNB感染的独立危险因素,计算比值比(odds ratio, OR)和95%的置信区间(confidence interval, CI)。P≤0.05为差异有统计学意义。
2 结果 2.1 心脏瓣膜术后HAI的临床特征2018年1月—2021年10月该院心脏外科11 120例住院患者接受心脏瓣膜外科手术,共296例患者发生HAI,HAI发病率为2.7%。其中170例(1.5%)发生革兰阴性菌感染,126例(1.1%)发生革兰阳性菌感染。革兰阴性菌感染包括下呼吸道感染145例(85.3%),血流感染24例(14.1%),其中导管相关性血流感染4例(2.4%),开胸术后纵隔感染1例(0.6%)。革兰阳性菌感染中血流感染95例(75.4%),下呼吸道感染26例(20.6%),手术后切口感染及感染性心内膜炎各2例(各占1.6%),腹腔感染1例(0.8%)。
2.2 心脏瓣膜术后感染革兰阴性菌的分布170例革兰阴性菌感染患者中包括62例(36.5%)CR-GNB感染(CR-GNB组),108例(63.5%)non-CR-GNB感染(non-CR-GNB组)。CR-GNB组患者共检出细菌112株,以鲍曼不动杆菌为主(42.9%),其次为肺炎克雷伯菌(21.4%)、铜绿假单胞菌(20.5%);38例分离出2种及以上CR-GNB。non-CR-GNB组患者共检出细菌136株,以肺炎克雷伯菌检出最多(36.8%),其次为铜绿假单胞菌(24.3%)、阴沟肠杆菌(16.2%);34例分离出2种及以上non-CR-GNB。见表 1。
| 表 1 两组患者心脏瓣膜术后感染革兰阴性菌分布情况 Table 1 Distribution of Gram-negative bacteria in two groups of patients after cardiac valve surgery |
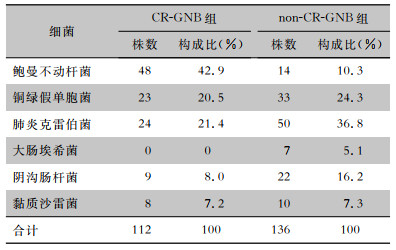
|
心脏外科瓣膜术后患者感染的CR-GNB对临床常用抗菌药物包括左氧氟沙星(59.8%)、头孢吡肟(58.9%)、环丙沙星(57.1%)和头孢他啶(55.4%)耐药率最高,对替加环素(17.9)、阿米卡星(12.5%)和多黏菌素(5.4%)耐药率较低。non-CR-GNB菌株对左氧氟沙星、环丙沙星、头孢吡肟和头孢他啶的耐药率为10%左右,均低于CR-GNB组相应抗菌药物的耐药率(均P<0.05)。见表 2。
| 表 2 两组患者心脏瓣膜术后感染革兰阴性菌对临床常用抗菌药物的耐药情况 Table 2 Resistance of Gram-negative bacteria to clinically frequently used antimicrobial agents in two groups of patients with infection after cardiac valve surgery |
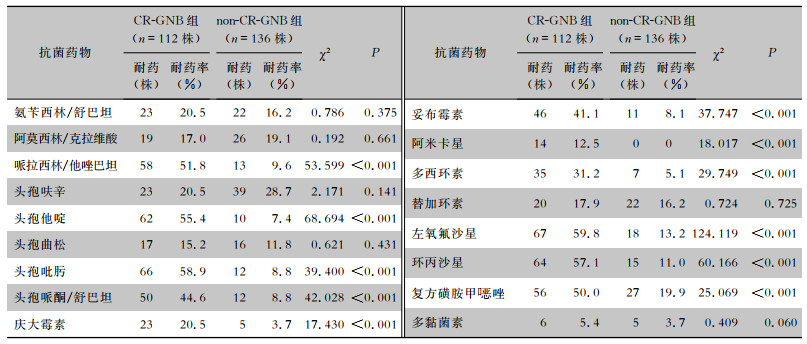
|
CR-GNB组患者中男性38例(61.3%),女性24例(38.7%),65岁及以上老年人32例(51.6%);non-CR-GNB组患者中男性73例(67.6%),女性35例(32.4%),65岁及以上老年人58例(53.7%)。CR-GNB组患者感染前住院时间、手术时间、ICU停留时间、体外循环时间、感染后住院时间、总住院时间均较non-CR-GNB组更长(均P<0.05),合并有糖尿病和(或)恶性肿瘤、发生低蛋白血症,以及使用头孢菌素类、β-内酰胺酶抑制剂、多黏菌素、联合应用抗菌药物的比例较non-CR-GNB组更高(均P<0.05)。见表 3。
| 表 3 CR-GNB组与non-CR-GNB组患者的临床特征比较 Table 3 Comparison of clinical characteristics between patients in the CR-GNB group and the non-CR-GNB group |
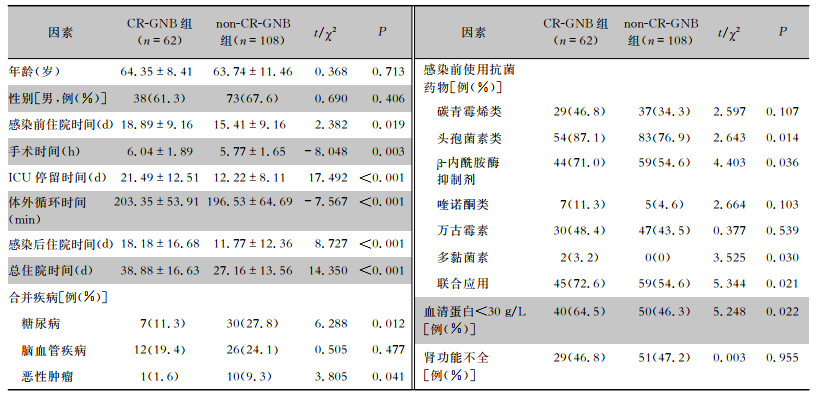
|
将单因素分析具有统计学意义的变量通过二元logistic回归进行多因素分析,结果显示手术时间、ICU停留时间和体外循环时间是心脏外科瓣膜术后患者CR-GNB感染的独立危险因素(均P<0.05)。见表 4。
| 表 4 心脏瓣膜术后患者CR-GNB感染的多因素logistic回归分析 Table 4 Multivariate logistic regression analysis on CR-GNB infection in patients after cardiac valve surgery |
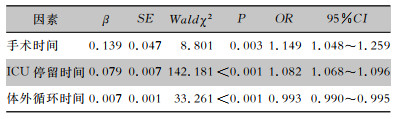
|
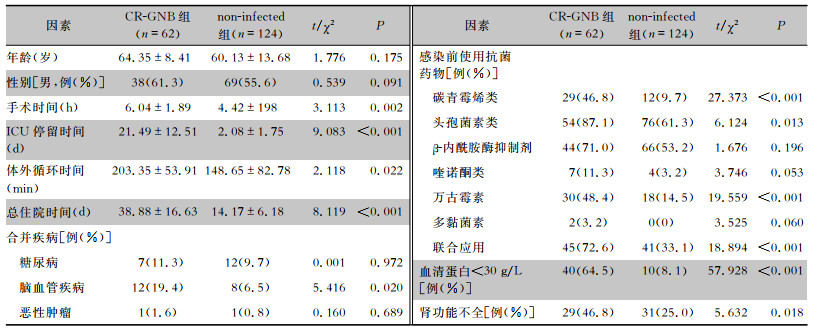
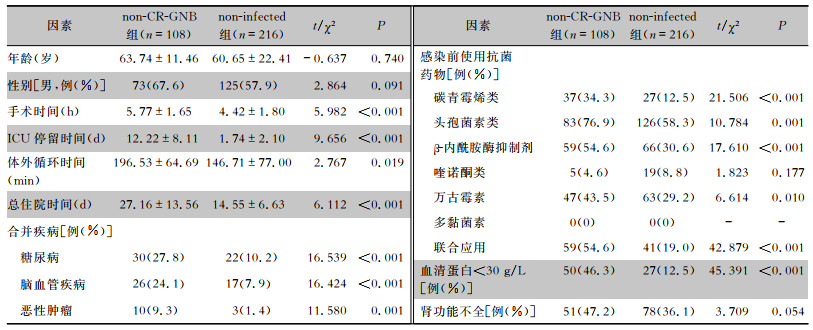
选取同时期瓣膜术后非感染患者,按照年龄、性别与不同感染组进行2 ∶1配对分组比较,结果显示CR-GNB组患者手术时间、ICU停留时间和体外循环时间较non-infected组更长,CR-GNB组患者感染前使用碳青霉烯类、头孢菌素类、万古霉素、联合应用抗菌药物的比例,以及合并脑血管疾病、低蛋白血症、肾功能不全的比例均较non-infected组更高(均P<0.05)。非non-CR-GNB组患者手术时间、ICU停留时间和体外循环时间均较non-infected组更长,感染发生前使用碳青霉烯类、头孢菌素类、β-内酰胺酶抑制剂、万古霉素和联合应用抗菌菌药物,以及合并糖尿病、脑血管疾病、恶性肿瘤、低蛋白血症的比例均较non-infected组更高(均P<0.05)。住院患者无论发生CR-GNB或non-CR-GNB感染与non-infected组相比较,总住院时间均明显延长(均P<0.05)。见表 5、6。CR-GNB组和non-CR-GNB组患者共死亡54例,全因病死率为31.8%(54/170);non-infected组患者共死亡17例,全因病死率为5.0%(17/340);两组患者全因病死率比较,差异具有统计学意义(P<0.05)。
| 表 5 CR-GNB组与non-infected组患者的临床特征分析 Table 5 Clinical characteristics of patients in the CR-GNB group and the non-infected group |
|
| 表 6 non-CR-GNB组与non-infected组患者的临床特征分析 Table 6 Clinical characteristics of patients in the non-CR-GNB group and the non-infected group |
|
接受各种心脏手术(包括心脏内直视手术)的患者存在多重耐药细菌感染并发症,发生率为0.6%~10%[12]。本研究中该院心脏瓣膜术后HAI发生率为2.7%,与既往的研究结果类似。术后患者一旦发生耐药细菌感染,严重影响患者预后,尤其是发生耐药细菌感染,病死率高于非耐药细菌感染患者[13]。关于术后感染病原菌的分布情况,有研究[3]发现,侵入性心血管术后感染的多重耐药菌主要为革兰阴性菌,占57%,以大肠埃希菌(40%)和肺炎克雷伯菌(30%)为主,而检出的革兰阳性菌及其耐药率一直维持在较低且稳定的水平。本研究中296例患者心脏瓣膜术后感染病原菌以革兰阴性杆菌为主,占57.4%(170例)。CHINET中国细菌耐药监测[6]数据显示,2021年革兰阴性细菌分离率为71.4%,常见分离菌为大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌,而革兰阳性细菌如金黄色葡萄球菌和表皮葡萄球菌的分离率呈下降趋势,且葡萄球菌对万古霉素、去甲万古霉素、利奈唑胺、康替唑胺、替考拉宁、替加环素和利福平高度敏感;2013—2021年分离的肺炎克雷伯菌对碳青霉烯类耐药率从10.3%上升至23.1%,同时铜绿假单胞菌对碳青霉烯类耐药一直维持在20%以上,而鲍曼不动杆菌对亚胺培南的耐药率也由59.4%上升至76.6%。美国一项关于HAI革兰阴性菌分布的回顾性研究[14]发现,鲍曼不动杆菌和铜绿假单胞菌是最常见的碳青霉烯类耐药细菌,其次是肺炎克雷伯菌和少见的大肠埃希菌。本研究中,CR-GNB中以鲍曼不动杆菌、肺炎克雷伯菌和铜绿假单胞菌最常见,并且较non-CR-GNB组对于临床常用抗菌药物的耐药率更高。虽然最新指南[15]与专家共识[16]推荐以替加环素或多黏菌素为基础的联合用于CR-GNB感染的临床治疗,但同样受限于肝肾功能损伤、皮肤黏膜色素沉着和神经系统损伤等不良反应,最佳联合用药方案、剂量和疗程缺乏循证医学证据,以及并不优秀的药代动力学参数特性,使得抗CR-GNB感染的治疗效果欠佳甚至几乎无药可用[17-18]。可见随着革兰阴性杆菌对碳青霉烯类的耐药率逐年上升,而耐药率相对较低的抗菌药物在使用中面临的不良反应问题不容忽视,以及并不优秀的药代动力学参数特性,使得革兰阴性杆菌感染治疗越来越困难。因此,目前对临床医生而言,治疗术后患者革兰阴性菌感染变得越来越棘手,尤其一旦发生耐药革兰阴性菌感染,会增加住院时间,加重经济负担,进而影响临床结局[19]。
临床医生应尽量避免住院患者出现多重耐药菌感染,了解感染发生的影响因素变得至关重要。有研究[14]发现,男性(54.5%)、60岁以上(52.1%)是HAI感染的重要人群,并且以肺部、血流、尿路为耐药细菌感染发生的常见部位,往往与住院患者频繁接受有创操作,包括气管插管、动静脉置管、留置导尿管,以及入住ICU有关,此类患者往往合并众多基础疾病、免疫功能抑制,容易发生多重耐药细菌HAI,且感染后更容易进展为重症甚至感染性休克。合并糖尿病和(或)恶性肿瘤的患者往往因自身免疫功能缺陷等原因,随着住院时间的延长不可避免的使用广谱抗菌药物,可能与HAI的发生有关[20-21]。碳青霉烯类药物曾经是治疗多重耐药革兰阴性杆菌感染的一线用药,随着其临床广泛使用,甚至不合理滥用,细菌对其耐药率逐年上升。在其他条件不变的情况下,碳青霉烯类药物的暴露会使多重耐药革兰阴性杆菌感染风险增加5.13倍[22]。
有研究[23]明确提出,感染前抗菌药物暴露及使用剂量和持续时间是导致细菌耐药性攀升的危险因素。近年来抗菌药物在临床上大量甚至不合理应用,使得细菌耐药形势异常严峻,抗感染治疗非常棘手,再加上细菌耐药机制不断进化、新型抗菌药物的开发面临巨大压力,需时刻提醒临床医生合理谨慎地使用指南推荐的抗菌药物,以延缓细菌耐药的进一步发展[24]。术中体外循环持续时间是心脏术后发生HAI的危险因素[25]。本研究中无论是CR-GNB与non-CR-GNB组比较,还是感染组与non-infected组比较,发现手术时间、ICU停留时间和体外循环时间延长,感染前更多使用头孢菌素类、β-内酰胺酶抑制剂、多黏菌素及联合应用抗菌药物,以及合并更多基础疾病,上述因素均与感染发生及感染细菌耐药率的增加有关。本研究发现手术时间、ICU停留时间和体外循环时间是CR-GNB感染的独立危险因素,提示心脏术后耐药细菌感染发生的影响因素众多,不同程度地导致了患者住院时间延长、经济负担加重,并严重影响其预后。
综上所述,本研究探讨心脏外科瓣膜术后患者发生HAI的影响因素,尤其是治疗非常棘手的CR-GNB HAI发生的影响因素,心脏外科瓣膜术后感染CR-GNB会导致感染后住院时间延长,并最终导致总住院时间的延长,应引起临床医生的重视。临床医生应加强心脏外科侵入性手术治疗期间围手术期管理,优化手术操作,合理使用抗菌药物,减少细菌耐药的发生。本研究的局限性在于数据均来源于单中心观察性研究,数据可能不具有普遍代表性,有待多中心加以证实。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
中华人民共和国国家卫生部. 关于印发医院感染诊断标准(试行)的通知: 卫医发[2001] 2号[EB/OL]. (2001-11-07)[2023-03-20]. http://www.nhc.gov.cn/yzygj/s3593/200804/e19e4448378643a09913ccf2a055c79d.shtml. Ministry of Health of the People's Republic of China. Notice on issuing the diagnostic standards for hospital infection (trial): Wei Yi Fa[2001] No. 2[EB/OL]. (2001-11-07)[2023-03-20]. http://www.nhc.gov.cn/yzygj/s3593/200804/e19e4448378643a09913ccf2a055c79d.shtml. |
| [2] |
吴安华, 文细毛, 李春辉, 等. 2012年全国医院感染现患率与横断面抗菌药物使用率调查报告[J]. 中国感染控制杂志, 2014, 13(1): 8-15. Wu AH, Wen XM, Li CH, et al. China national point prevalence survey on healthcare-associated infection and antimicro-bial use in 2012[J]. Chinese Journal of Infection Control, 2014, 13(1): 8-15. |
| [3] |
Pierce GN, Resch C, Mourin M, et al. Bacteria and the gro-wing threat of multidrug resistance for invasive cardiac interven-tions[J]. Rev Cardiovasc Med, 2022, 23(1): 15. |
| [4] |
中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识编写组, 中国医药教育协会感染疾病专业委员会, 中华医学会细菌感染与耐药防控专业委员会. 中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识[J]. 中华医学杂志, 2021, 101(36): 2850-2860. Expert Consensus Compilation Group on Diagnosis, Treatment and Prevention of Carbapenem-Resistant Enterobacteriaceae Bacterial Infections in China, Infectious Diseases Professional Committee of Chinese Medical Education Association, Bacte-rial Infection and Drug Resistance Prevention and Control Committee of Chinese Medical Association. Expert consensus on diagnosis, treatment and prevention and control of carbape-nem-resistant Enterobacteriaceae bacterial infections in China[J]. National Medical Journal of China, 2021, 101(36): 2850-2860. |
| [5] |
Abdul Salim S, Masoud AT, Thongprayoon C, et al. Systema-tic review and Meta-analysis of antibiotic and antimicrobial lock solutions for prevention of hemodialysis catheter-related infections[J]. ASAIO J, 2021, 67(10): 1079-1086. DOI:10.1097/MAT.0000000000001382 |
| [6] |
胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530. Hu FP, Guo Y, Zhu DM, et al. Surveillance of bacterial resistance in China in 2021[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(5): 521-530. |
| [7] |
Medina E, Pieper DH. Tackling threats and future problems of multidrug-resistant bacteria[J]. Curr Top Microbiol Immunol, 2016, 398: 3-33. |
| [8] |
Mohamed A, Daef E, Nafie A, et al. Characteristics of carbapenem-resistant Gram-negative bacilli in patients with ventilator-associated pneumonia[J]. Antibiotics (Basel), 2021, 10(11): 1325. DOI:10.3390/antibiotics10111325 |
| [9] |
于翠香, 王西艳. 《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》解读[J]. 中国医刊, 2021, 56(9): 951-953. Yu CX, Wang XY. Interpretation of The guidelines for the diagnosis and treatment of ventilator-associated pneumonia in adult hospitals of China(2018)[J]. Chinese Journal of Medicine, 2021, 56(9): 951-953. DOI:10.3969/j.issn.1008-1070.2021.09.008 |
| [10] |
张鸿娟, 单斌, 孟雪斐, 等. 不同部位来源的耐碳青霉烯类肠杆菌目细菌检出情况及耐药性分析[J]. 中国合理用药探索, 2021, 18(10): 81-88. Zhang HJ, Shan B, Meng XF, et al. Detection and drug resistance analysis of carbapenem-resistant Enterobacterales in different site infections[J]. Chinese Journal of Rational Drug Use, 2021, 18(10): 81-88. DOI:10.3969/j.issn.2096-3327.2021.10.018 |
| [11] |
Nordmann P, Poirel L. Epidemiology and diagnostics of carbapenem resistance in Gram-negative bacteria[J]. Clin Infect Dis, 2019, 69(Suppl 7): S521-S528. |
| [12] |
Ko RE, Huh K, Kim DH, et al. Nosocomial infections in in-hospital cardiac arrest patients who undergo extracorporeal cardiopulmonary resuscitation[J]. PLoS One, 2020, 15(12): e0243838. DOI:10.1371/journal.pone.0243838 |
| [13] |
Bhatt PJ, Ali M, Rana M, et al. Infections due to multidrug-resistant organisms following heart transplantation: epidemio-logy, microbiology, and outcomes[J]. Transpl Infect Dis, 2020, 22(1): e13215. |
| [14] |
Cai B, Echols R, Magee G, et al. Prevalence of carbapenem-resistant Gram-negative infections in the united states predomi-nated by Acinetobacter baumannii and Pseudomonas aeruginosa[J]. Open Forum Infect Dis, 2017, 4(3): ofx176. DOI:10.1093/ofid/ofx176 |
| [15] |
Zeng M, Xia J, Zong ZY, et al. Guidelines for the diagnosis, treatment, prevention and control of infections caused by carbapenem-resistant Gram-negative bacilli[J]. J Microbiol Immunol Infect, 2023. DOI:10.1016/j.jmii.2023.01.017.Epubaheadofprint |
| [16] |
王明贵, Guan X, He L, 等. 广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制: 中国专家共识[J]. 中国感染与化疗杂志, 2017, 17(1): 82-93. Wang MG, Guan X, He L, et al. Laboratory diagnosis, clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli: a Chinese consensus statement[J]. Chinese Journal of Infection and Chemotherapy, 2017, 17(1): 82-93. |
| [17] |
Shi XP, Zuo CC, Yu LL, et al. Real-world data of tigecycline-associated drug-induced liver injury among patients in china: a 3-year retrospective study as assessed by the updated RUCAM[J]. Front Pharmacol, 2021, 12: 761167. DOI:10.3389/fphar.2021.761167 |
| [18] |
中国研究型医院学会危重医学专业委员会, 中国研究型医院学会感染性疾病循证与转化专业委员会. 多黏菌素临床应用中国专家共识[J]. 中华急诊医学杂志, 2019, 28(10): 1218-1222. Critical Care Medicine Professional Committee of China Research Hospital Association, Infectious Diseases Evidence Based and Transformation Professional Committee of Chinese Society of Research Hospitals. Chinese expert consensus on polymyxins in the clinical practice[J]. Chinese Journal of Emergency Medicine, 2019, 28(10): 1218-1222. |
| [19] |
Kalil AC, Metersky ML, Klompas M, et al. Executive summary: management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J]. Clin Infect Dis, 2016, 63(5): 575-582. |
| [20] |
Jara MC, Frediani AV, Zehetmeyer FK, et al. Multidrug-resistant hospital bacteria: epidemiological factors and susceptibility profile[J]. Microb Drug Resist, 2021, 27(3): 433-440. |
| [21] |
何义菊, 叶慧, 罗云婷, 等. 耐碳青霉烯类鲍曼不动杆菌血流感染的不同治疗策略与预后影响因素分析[J]. 中华传染病杂志, 2020, 38(9): 544-550. He YJ, Ye H, Luo YT, et al. Therapeutic options and risk factors of mortality in patients with carbapenem-resistant Acinetobacter baumannii bloodstream infections[J]. Chinese Journal of Infectious Diseases, 2020, 38(9): 544-550. |
| [22] |
李雪, 张旺, 陈素明, 等. 重症监护病房耐碳青霉烯类鲍曼不动杆菌感染患者死亡的影响因素分析[J]. 中华预防医学杂志, 2021, 55(12): 1419-1425. Li X, Zhang W, Chen SM, et al. Risk factors of carbapenem resistant Acinetobacter baumannii infection in intensive care unit[J]. Chinese Journal of Preventive Medicine, 2021, 55(12): 1419-1425. |
| [23] |
Tsao LH, Hsin CY, Liu HY, et al. Risk factors for healthcare-associated infection caused by carbapenem-resistant Pseudomonas aeruginosa[J]. J Microbiol Immunol Infect, 2018, 51(3): 359-366. |
| [24] |
袁瑾懿, 林东昉. 美国感染病学会对产超广谱β内酰胺酶肠杆菌目细菌、碳青霉烯类耐药肠杆菌目细菌和难治性耐药铜绿假单胞菌的治疗指导原则[J]. 中国感染与化疗杂志, 2021, 21(5): 633-638. Yuan JY, Lin DF. Infectious Diseases Society of America guidance on the treatment of extended-spectrum β-lactamase producing Enterobacterales (ESBL-E), carbapenem-resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa)[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(5): 633-638. |
| [25] |
He SY, Chen BC, Li W, et al. Ventilator-associated pneumonia after cardiac surgery: a Meta-analysis and systematic review[J]. J Thorac Cardiovasc Surg, 2014, 148(6): 3148-3155.e5. |



