随着内镜诊疗技术的迅速发展,十二指肠镜和线阵超声内镜已成为胰胆管疾病的重要诊疗工具[1]。由于十二指肠镜的前端侧视镜、抬钳器及抬钳器腔道等结构特殊,使用清洗刷难以充分刷洗。线阵超声内镜是超声扫描平面与内镜长轴平行的超声内镜,可对消化道管壁及周围邻近器官或结构进行纵向扫描。除有十二指肠镜类似的抬钳器结构外,线阵超声内镜前端装有扇形线阵超声探头,同时还有水囊腔道,使其再处理更具挑战性。近年来,与十二指肠镜相关的多重耐药菌感染事件不断暴发,引发了患者的严重感染和死亡[2-5]。Bartles等[6]研究指出,十二指肠镜和线性超声内镜再处理后分别有4.0%、7.7%的标本存在微生物污染,其中0.1%和0.3%的标本中检测到高度关注微生物。微生物学监测是验证内镜再处理效果最直接和最重要的方法,是内镜再处理质量控制的金标准[7]。因此,为有效预防内镜诊疗引起的医院感染及其传播风险,执行微生物学监测,保障内镜再处理质量至关重要。我国2012年颁布的《医院消毒卫生标准》GB 15982—2012[8]及2017年实施的《软式内镜清洗消毒技术规范》WS 507—2016(以下简称《规范》)[9]提出了软式内镜的微生物学监测方法。2018年美国食品药品监督管理局(FDA)、美国疾病控制与预防中心(CDC)和美国微生物学会(ASM)[10]联合发布了十二指肠镜微生物学监测标准化方案。本研究团队依据以上规范、指南等要求,制定《十二指肠镜和线阵超声内镜微生物学监测现状调查问卷》,并调查了全国313所医疗机构内镜中心十二指肠镜和线阵超声内镜的微生物学监测情况,以了解现阶段十二指肠镜和线阵超声内镜的微生物监测现状,分析微生物学监测工作中存在的问题,为进一步规范和完善十二指肠镜和线阵超声内镜的微生物学监测提供参考依据。
1 资料与方法 1.1 资料来源2022年11月21—30日采用便利抽样方法,对我国27个省313所三级医疗机构消化内镜中心的十二指肠镜和线阵超声内镜微生物学监测情况进行问卷调查。
1.2 方法 1.2.1 问卷设计调查问卷由研究者查阅内镜微生物学监测相关文献,结合国内外指南和规范,以及当前十二指肠镜和线阵超声内镜的微生物学监测情况制定调查问卷初稿,经课题组讨论,咨询6名内镜行业专家和感染控制领域专家及预调查结果,最终修改确定形成《十二指肠镜和线阵超声内镜微生物学监测现状调查问卷》终稿。调查问卷共设置15道题目,题型包含单选、多选和填空题,内容分为四部分:(1)内镜中心一般资料;(2)十二指肠镜和线阵超声内镜的微生物学监测执行频率和检测数量;(3)十二指肠镜和线阵超声内镜的微生物学监测采样情况;(4)十二指肠镜和线阵超声内镜的微生物学监测结果和风险控制情况。
1.2.2 调查方法由研究者向各大医疗机构负责人解释本研究目的,通过程序软件制成电子问卷在微信平台发放并进行问卷调查培训,在保证调查者对问卷调查内容及调查方法不存在疑问后填写。为保证问卷调查的同质性,问卷采用统一的指导用语。接受调查者保证问卷填写完整后方可提交,并通过限定问卷作答次数、时间等保证问卷回收质量。收到的问卷经过软件后台提取数据进行统计分析。
1.3 相关定义 1.3.1 检测全部检测:是指每次微生物学监测对全部内镜均进行检测。随机抽检:是指每次微生物学监测随机抽取部分内镜进行检测。按比例轮换抽检:是指每次微生物学监测按照一定比例轮换抽取部分内镜进行检测。
1.3.2 采样方法腔道采样:(1)普通冲洗采样法,使用生理盐水或含有中和剂的洗脱液冲洗内镜腔道,多为欧洲国家采用;(2)泵辅助采样法,使用蠕动泵收集内镜腔道洗脱液,依据中国内镜相关国家标准;(3)刷辅助采样法(冲-刷-冲采样法),基于普通冲洗采样法,使用刷子协助收集,多为美国、澳大利亚、加拿大等国家采用。抬钳器/先端帽采样:(1)冲洗法,使用生理盐水或含有中和剂的洗脱液冲洗采样;(2)拭子法,基于冲洗法使用拭子协助采样;(3)刷洗法,基于冲洗法使用小毛刷协助采样。
1.3.3 隔离内镜是指内镜进行微生物学监测后不放行内镜,等待培养结果反馈后再考虑是否放行、使用内镜。
1.4 统计方法应用SPSS 25.0软件对数据资料进行分析,计数资料以频数和百分比(%)描述。
2 结果 2.1 基本情况共发放调查问卷364份,有效回收337份,有效回收率92.58%。调查覆盖我国27个省级行政区,共337所医疗机构,其中三级医疗机构313所,二级医疗机构24所。基于二级医疗机构样本量较少,不具备代表性,在本研究中不纳入分析。纳入的313所三级医疗机构中,306所(97.76%)医疗机构对十二指肠镜和线阵超声内镜进行微生物学监测,7所(2.24%)医疗机构未进行监测。执行微生物学监测的306所医疗机构中,149所医疗机构均开展十二指肠镜和线阵超声内镜检测,145所医疗机构仅开展十二指肠镜检测,12所医疗机构仅开展线阵超声内镜检测。
2.2 微生物学监测频率和检测数量各医疗机构对十二指肠镜和线阵超声内镜微生物学监测的频率主要为每月监测1次(分别为49.32%、44.10%)和每季度监测1次(分别为44.22%、46.58%)。调查的医疗机构检测数量主要以全部检测和按比例轮换抽检为主,其中十二指肠镜全部检测占比52.72%,按比例轮换抽检占比34.69%;线阵超声内镜全部检测占比45.34%,按比例轮换抽检占比43.48%。见表 1。
| 表 1 十二指肠镜和线阵超声内镜的微生物学监测频率和检测数量 Table 1 Frequency and quantity of microbiological monitoring on duodenoscopes and linear array ultrasound endoscopes |
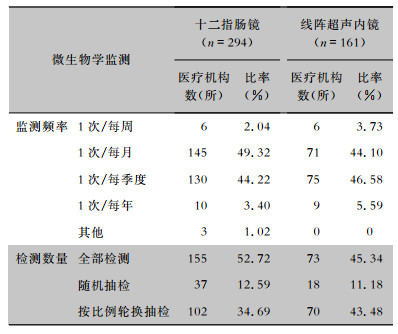
|
十二指肠镜和线阵超声内镜腔道微生物学监测采样情况中,大部分医疗机构对活检腔道采样(分别为91.50%、93.79%),但有2.72%的医疗机构对十二指肠镜腔道未采样,1.86%的医疗机构对线阵超声内镜腔道未采样。在先端部特殊结构的采样中,82.99%的医疗机构对十二指肠镜抬钳器采样,85.71%的医疗机构对线阵超声内镜抬钳器采样,65.99%的医疗机构对十二指肠镜先端帽采样。见表 2。
| 表 2 十二指肠镜和线阵超声内镜各部位微生物学监测情况 Table 2 Microbiological monitoring results of each site in duodenoscopes and linear array ultrasound endoscopes |
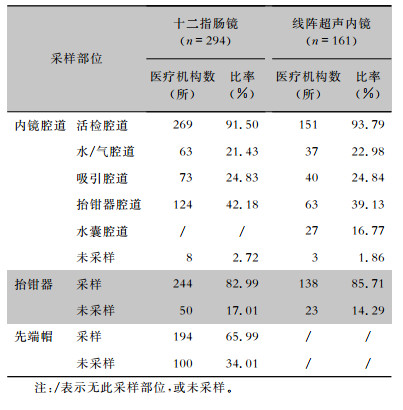
|
在执行十二指肠镜腔道采样的286所医疗机构中,采样方法主要为普通冲洗采样法(83.22%),泵辅助采样法和刷辅助采样法占比较少,分别为8.39%、5.59%。在执行线阵超声内镜腔道采样的158所医疗机构中,采样方法主要为普通冲洗采样法(78.48%),泵辅助采样法和刷辅助采样法占比较少,分别为11.39%、5.70%。见表 3。
| 表 3 十二指肠镜和线阵超声内镜腔道的微生物学监测采样方法 Table 3 Microbiological monitoring sampling methods of duodenoscopes and linear array ultrasound endoscopes |
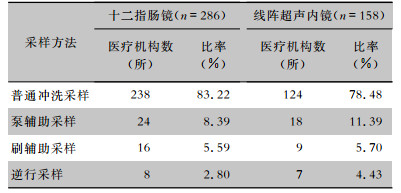
|
在执行十二指肠镜抬钳器采样的244所医疗机构中,大部分医疗机构的采样方法为冲洗法(56.15%),其次是拭子法(33.20%);在执行线阵超声内镜抬钳器采样的138所医疗机构中,大部分医疗机构的采样方法为冲洗法(52.17%),其次是拭子法(37.68%);在执行十二指肠镜先端帽采样的194所医疗机构中,大部分医疗机构的采样方法为拭子法(54.12%),其次是冲洗法(29.90%)。见表 4。
| 表 4 十二指肠镜和线阵超声内镜抬钳器及先端部的微生物学监测采样方法 Table 4 Microbiological monitoring sampling methods of the forceps and distal caps of duodenoscopes and linear array ultrasound endoscopes |
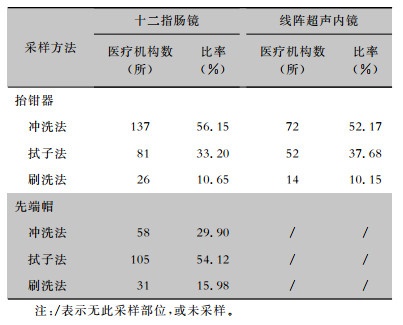
|
十二指肠镜和线阵超声内镜微生物学监测结果判定,分别有60.20%、58.39%的医疗机构以活检腔道微生物数量判断,其余医疗机构以多个腔道(部位)中最高微生物数量(分别为26.87%、29.19%)或多个腔道(部位) 的微生物数量相加(分别为12.93%、12.42%)作为结果判定指标。近一年微生物学监测结果显示,有37.07%的医疗机构十二指肠镜检测不合格,45.96%的医疗机构线阵超声内镜检测不合格。45.24%医疗机构未在微生物学培养结果显示前隔离十二指肠镜,41.61%医疗机构未在微生物学培养结果显示前隔离线阵超声内镜。见表 5。
| 表 5 十二指肠镜和线阵超声内镜微生物学监测结果判定方法及风险控制情况 Table 5 Judging method for microbiological monitoring results and control of risks of duodenoscopes and linear array ultrasound endoscopes |
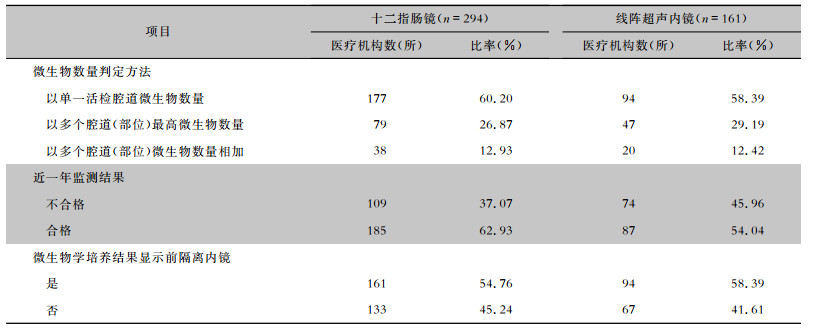
|
十二指肠镜检测不合格的109所医疗机构中,88.07%的医疗机构对十二指肠镜再处理并检测合格后使用,1.84%的医疗机构则不处理直接使用。线阵超声内镜检测不合格的74所医疗机构中,91.89%医疗机构对线阵超声内镜再处理并检测合格后使用,1.35%医疗机构则不处理直接使用。见表 6。
| 表 6 十二指肠镜和线阵超声内镜微生物学监测不合格的处理方式 Table 6 Handling of unqualified microbiological monitoring on duodenoscopes and linear array ultrasound endoscopes |
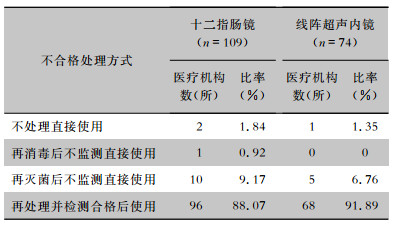
|
十二指肠镜和线阵超声内镜结构特殊,设计复杂,再处理面临着独特的挑战,微生物学监测是目前保障内镜再处理质量的最可靠方法。中国、美国等规范和指南[8, 11-12]均建议,对内镜进行微生物学监测,以防止微生物通过污染内镜传播,降低内镜相关医院感染风险。本研究调查的313所三级医疗机构中,有7所(2.24%)医疗机构未对内镜进行微生物学监测,表明仍有少部分医疗机构未执行规范要求的微生物学监测,即使是三级医疗机构。十二指肠镜的微生物总体污染率高达15%,线阵超声内镜的污染率在1.1%~8%[13-14],十二指肠镜和线阵超声内镜即使经标准方法处理后仍显示有微生物污染,甚至检测出多重耐药菌[15-16]。因此,在临床实际应用中需高度重视十二指肠镜和线阵超声内镜的微生物学监测,各层级质量监控部门需加大内镜微生物学监测的监管力度,并落实到每个医疗机构。
目前,各国微生物学监测的频率和检测数量呈现多样性,缺乏一致性建议。中国和比利时等规范[9, 17]推荐,所有内镜每季度至少监测1次,检测数量采用按比例轮换抽检的方式。澳大利亚和荷兰等指南[18-19]推荐,十二指肠镜、线阵超声内镜等治疗内镜每月监测1次。本调查中显示各医疗机构对十二指肠镜和线阵超声内镜微生物学监测的频率主要为每月监测1次(分别为49.32%、44.10%)和每季度监测1次(分别为44.22%、46.58%),检测数量以全部检测(分别为52.72%、45.34%)和按比例轮换抽检(分别为34.69%、43.48%)为主。每季度监测1次及按比例轮换抽检符合我国《规范》[9]的要求,而每月监测1次并全部检测可带来更加严密的监测,减少安全隐患。每条内镜都存在同等的感染风险,医疗机构的内镜感染隐患可能因微生物学监测的频率和检测数量而有所不同,遵守国家规范和指南要求的监测频率和检测数量是最低要求。
十二指肠镜和超声内镜微生物学监测的采样部位包括活检腔道、水/气腔道、抬钳器腔道以及抬钳器等,不同医疗机构对于微生物学监测采样部位的选择各不相同。本调查中大部分医疗机构对十二指肠镜和线阵超声内镜的活检腔道进行了采样(分别为91.50%、93.79%),但对活检腔道、水/气腔道、吸引腔道和抬钳器腔道等腔道均采样的医疗机构占比较低,约2%的医疗机构对内镜腔道未采样。Alfa等[20]对十二指肠镜所有腔道的采样检测发现,微生物检出率为14.18%(20/141),活检腔道、水/气腔道及抬钳器腔道间微生物检出率比较,差异均无统计学意义。由此可见,抬钳器腔道和水/气腔道等腔道同活检腔道一样值得被关注,均应纳入微生物学监测的采样中。关于先端部特殊结构的采样,82.99%和85.71%医疗机构分别对十二指肠镜和线阵超声内镜抬钳器进行采样,同时65.99%医疗机构对十二指肠镜先端帽采样。研究[21-23]指出,十二指肠镜和线阵超声内镜的特殊结构抬钳器为临床微生物传播的主要来源,微生物污染程度比内镜其他部位更为严重,容易引起微生物残留和积聚,可导致患者发生交叉感染。因此,每个医疗机构应对内镜抬钳器、先端帽等特殊结构有充分认识,重视内镜特殊结构的监测。
采样方法是微生物监测中的关键,不同采样方法对内镜微生物的培养结果有一定影响。Ji等[24]试验发现,泵辅助采样法和刷辅助采样法采集内镜腔道的微生物检出率明显高于普通冲洗法,可提高检测的灵敏度。本调查中,十二指肠镜和线阵超声内镜腔道采样方法多为普通冲洗法(分别为83.22%、78.48%),泵辅助采样法(分别为8.39%、11.39%)和刷辅助采样法(分别为5.59%、5.70%)占比较低。普通冲洗法在识别再处理失败内镜有效性方面可能存在一定缺陷,推荐至少每半年应用泵辅助法或刷辅助采样法采样一次。本调查中,医疗机构对十二指肠镜和线阵超声内镜抬钳器的采样方法主要为冲洗法(分别为56.15%、52.17%),采用拭子法和刷洗法采样均较少。Gazdik等[25]研究报道,十二指肠镜和线阵超声内镜抬钳器采用拭子法检测残留细菌的效果明显优于刷洗法,能够更好地捕获细菌并到达抬钳器的小裂缝,与拭子法相比,清洗刷法采样标本微生物回收率提高两倍。推荐对内镜抬钳器、先端帽等特殊结构进行重点监测,同时使用拭子法采样以提高内镜微生物检出率。
各国微生物学监测结果的合格标准及判定方法存在差异。本调查中,医疗机构(分别为60.20%、58.39%)主要以活检腔道微生物数量作为微生物学监测的结果判定指标,少数医疗机构以多个腔道(部位)的微生物数量相加(分别为12.93%、12.42%)作为结果判定指标。此外,我国《规范》[9]中内镜合格标准为菌落总数≤20 CFU/件且无致病微生物检出,美国指南中内镜合格标准为<10 CFU/件且未检测到高度关注微生物。虽然不同指南和规范中的合格标准不同,但均提到高度关注微生物,高度关注微生物是指如大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌等具有较高致病性的微生物。美国FDA报道[26],3%~4.4%的十二指肠镜受到低/中度关注微生物的污染,受高度关注微生物污染的十二指肠镜为4.1%~6.1%。Chapman等[14]研究结果显示,线阵超声内镜经严格标准高水平消毒处理后,仍培养出高度关注微生物,其中4.2%内镜检测出革兰阴性杆菌。持续检测出高度关注微生物已成为内镜感控关注的重点,相关部门应立即采取行动并发出风险警告。
对微生物检测不合格的风险内镜进行有效的原因分析和补救是微生物学监测的目的所在[27]。本调查显示,37.07%医疗机构近一年十二指肠镜检测不合格,其中1.84%医疗机构不处理直接使用;45.96%医疗机构近一年线阵超声内镜检测不合格,其中1.35%医疗机构不处理直接使用。不合格内镜可能对患者健康产生严重危害,尽管无法追溯调查医疗机构不合格内镜检出的微生物类别,但内镜感染问题已持续多年列入美国紧急医疗研究机构(ECRI)颁布的“十大健康技术危害”[28-29]中。因此,医疗机构在识别和阻止风险内镜进入临床诊疗的安全意识仍有待加强,针对不合格内镜应分析原因并补救,再处理检测合格后方可继续使用。美国FDA/CDC/ASM指南[10]要求,十二指肠镜在微生物学培养48 h且结果为阴性方可解除隔离,供临床进一步使用。本调查中45.24%和41.61%医疗机构未在微生物学培养结果报告前对十二指肠镜和线阵超声内镜进行隔离。究其原因,主要与微生物学监测的培养周期过长,无法满足临床内镜的周转需求有关。微生物学监测复杂,费时且昂贵,存在结果延迟1~2 d的局限性,通常在潜在暴露发生后才能获得微生物的检测结果[7]。但目前尚无其他有效验证再处理效果的替代方法。因此,推荐对十二指肠镜和超声内镜在短周期内轮换抽检监测,保障内镜在培养结果报告前隔离的同时不影响临床的正常诊疗工作。
综上所述,十二指肠镜和线阵超声内镜的微生物学监测应增加检测频率及检测数量,同时采取多腔道(部位)联合采样,以及有助于提高微生物阳性检出率的刷辅助法和泵辅助法进行采样。此外,多腔道(部位)的结果判定方法对识别风险内镜更具敏感性,在保障临床诊疗安全方面有一定积极作用。但本研究仍存在一定的局限性:受人力、物力等制约采用便利抽样的方法,样本代表性略显不足。建议在今后研究中,扩大样本量并采用分层随机抽样,提高样本代表性。最后,相关部门应加快修订内镜微生物学监测指南或出台标准,完善规范行业监测行为,最大程度预防和降低内镜相关感染风险,保障内镜再处理质量和患者诊疗安全。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Qiu LJ, Zhou ZH, Liu QF, et al. Investigating the failure of repeated standard cleaning and disinfection of a Pseudomonas aeruginosa-infected pancreatic and biliary endoscope[J]. Am J Infect Control, 2015, 43(8): e43-e46. DOI:10.1016/j.ajic.2015.04.204 |
| [2] |
Verfaillie CJ, Bruno MJ, Voor in't Holt AF, et al. Withdrawal of a novel-design duodenoscope ends outbreak of a VIM-2-producing Pseudomonas aeruginosa[J]. Endoscopy, 2015, 47(6): 493-502. DOI:10.1055/s-0034-1391886 |
| [3] |
Smith ZL, Oh YS, Saeian K, et al. Transmission of carbape-nem-resistant Enterobacteriaceae during ERCP: time to revisit the current reprocessing guidelines[J]. Gastrointest Endosc, 2015, 81(4): 1041-1045. DOI:10.1016/j.gie.2014.11.006 |
| [4] |
Rubin ZA, Kim S, Thaker AM, et al. Safely reprocessing duodenoscopes: current evidence and future directions[J]. Lancet Gastroenterol Hepatol, 2018, 3(7): 499-508. DOI:10.1016/S2468-1253(18)30122-5 |
| [5] |
Balan GG, Sfarti CV, Chiriac SA, et al. Duodenoscope-associated infections: a review[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(12): 2205-2213. DOI:10.1007/s10096-019-03671-3 |
| [6] |
Bartles RL, Leggett JE, Hove S, et al. A randomized trial of single versus double high-level disinfection of duodenoscopes and linear echoendoscopes using standard automated reproce-ssing[J]. Gastrointest Endosc, 2018, 88(2): 306-313.e2. DOI:10.1016/j.gie.2018.02.016 |
| [7] |
Ji XY, Ning PY, Fei CN, et al. Comparison of channel sampling methods and brush heads in surveillance culture of endoscope reprocessing: a propensity score matching and paired study[J]. Saudi J Gastroenterol, 2022, 28(1): 46-53. DOI:10.4103/sjg.sjg_437_21 |
| [8] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 医院消毒卫生标准: GB 15982—2012[S]. 北京: 中国标准出版社, 2012. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration. Hygienic standard for disinfection in hospitals: GB 15982-2012[S]. Beijing: Standards Press of China, 2012. |
| [9] |
刘运喜, 邢玉斌, 巩玉秀. 软式内镜清洗消毒技术规范WS 507—2016[J]. 中国感染控制杂志, 2017, 16(6): 587-592. Liu YX, Xing YB, Gong YX. Regulation for cleaning and disinfection technique of flexible endoscope[J]. Chinese Journal of Infection Control, 2017, 16(6): 587-592. |
| [10] |
Centers for Disease Control and Prevention. Duodenoscope surveillance sampling & culturing reducing the risks of infection[EB/OL]. (2019-11-01)[2022-03-15]. https://www.cdc.gov/hai/organisms/cre/cre-duodenoscope-surveillance-protocol.html.
|
| [11] |
Rutala WA, Weber DJ, the Healthcare Infection Control Practices Advisory Committee (HICPAC). Guideline for disinfection and sterilization in healthcare facilities, 2008[EB/OL]. (2019-05-01)[2023-03-15]. https://stacks.cdc.gov/view/cdc/11560/cdc_11560_DS1.pdf.
|
| [12] |
Reprocessing Guideline Task Force, Petersen BT, Cohen J, et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2016 update[J]. Gastrointest Endosc, 2017, 85(2): 282-294.e1. DOI:10.1016/j.gie.2016.10.002 |
| [13] |
Rauwers AW, Voor In't Holt AF, Buijs JG, et al. Nationwide risk analysis of duodenoscope and linear echoendoscope contamination[J]. Gastrointest Endosc, 2020, 92(3): 681-691.e1. DOI:10.1016/j.gie.2020.05.030 |
| [14] |
Chapman CG, Siddiqui UD, Manzano M, et al. Risk of infection transmission in curvilinear array echoendoscopes: results of a prospective reprocessing and culture registry[J]. Gastro-intest Endosc, 2017, 85(2): 390-397.e1. DOI:10.1016/j.gie.2016.07.049 |
| [15] |
Brandabur JJ, Leggett JE, Wang L, et al. Surveillance of guideline practices for duodenoscope and linear echoendoscope reprocessing in a large healthcare system[J]. Gastrointest Endosc, 2016, 84(3): 392-399.e3. DOI:10.1016/j.gie.2016.03.1480 |
| [16] |
Becq A, Snyder GM, Heroux R, et al. Prospective assessment of the effectiveness of standard high-level disinfection for echo-endoscopes[J]. Gastrointest Endosc, 2019, 89(5): 984-989. DOI:10.1016/j.gie.2018.12.024 |
| [17] |
Hoge Gezondheidsraad. Aanbevelingen inzake het onderhoud van flexibel warmtegevoelig endoscopisch material en de preventie van infecties[EB/OL]. (2012-03-13)[2023-03-15]. https://www.health.belgium.be/sites/default/files/uploads/fields/fpshealth-theme-file/19076833/Brochure%20-%20Aanbevelingen%20inzake%20het%20onderhoud%20van%20flexibel%20warmtegevoelig%20endoscopisch%20materiaal%20en%20de%20preventie%20van%20infecties%20(mei%202010)%20(HGR%208355).pdf.
|
| [18] |
Stuurgroep flexibele endoscopen reiniging en desinfectie (SFERD). Professional standard handbook cleaning and disinfection flexible endoscopes [EB/OL]. (2017-09-06)[2023-03-15]. https://www.infectiepreventieopleidingen.nl./downloads/SFERDHandbook4_1.pdf.
|
| [19] |
Gastroenterological Society of Australia (GESA). Endoscopy infection control (third edition 2010)[EB/OL]. (2011)[2022-03-15]. https://www.nzno.org.nz/Portals/0/Files/Documents/Groups/Gastroenterology/2017-10-Endoscopy_infection_control%20%28low%29%202011.pdf.
|
| [20] |
Alfa MJ, Sepehri S, Olson N, et al. Establishing a clinically relevant bioburden benchmark: a quality indicator for adequate reprocessing and storage of flexible gastrointestinal endoscopes[J]. Am J Infect Control, 2012, 40(3): 233-236. DOI:10.1016/j.ajic.2011.02.023 |
| [21] |
Bourigault C, Le Gallou F, Bodet N, et al. Duodenoscopy: an amplifier of cross-transmission during a carbapenemase-producing Enterobacteriaceae outbreak in a gastroenterology pathway[J]. J Hosp Infect, 2018, 99(4): 422-426. DOI:10.1016/j.jhin.2018.04.015 |
| [22] |
马慧. 医院十二指肠镜消毒及微生物污染现况研究[D]. 北京: 中国疾病预防控制中心, 2017. Ma H. Investigation on disinfect and bacterial contamination of duodenoscopes in hospital[D]. Beijing: Chinese Center for Disease Control and Prevention, 2017. |
| [23] |
黄茜, 张燕霞, 刘林林, 等. 142家医院十二指肠镜再处理现况问卷调查[J]. 中华医院感染学杂志, 2021, 31(22): 3487-3491. Huang X, Zhang YX, Liu LL, et al. Reprocessing practice of duodenoscopes in 142 hospitals[J]. Chinese Journal of Nosocomiology, 2021, 31(22): 3487-3491. |
| [24] |
Ji XY, Ning PY, Fei CN, et al. The importance of sampling technique and rinse water for assessing flexible gastrointestinal endoscope reprocessing: a 3-year study covering 59 centers[J]. Am J Infect Control, 2020, 48(1): 19-25. DOI:10.1016/j.ajic.2019.07.008 |
| [25] |
Gazdik MA, Coombs J, Burke JP, et al. Comparison of two culture methods for use in assessing microbial contamination of duodenoscopes[J]. J Clin Microbiol, 2016, 54(2): 312-316. DOI:10.1128/JCM.02754-15 |
| [26] |
U.S. Food and Drug Administration. The FDA provides inte-rim results of duodenoscope reprocessing studies conducted in real-world settings: FDA safety communication [EB/OL]. (2018-12-13)[2023-03-15]. https://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm6.
|
| [27] |
Alfa MJ, Singh H. Contaminated flexible endoscopes: Review of impact of channel sampling methods on culture results and recommendations for root-cause analysis[J]. Infect Control Hosp Epidemiol, 2022, 43(5): 623-638. DOI:10.1017/ice.2021.128 |
| [28] |
Ma S, Feng LL, Jiang ZY, et al. Comparative study of microbiological monitoring results from three types of sampling methods after gastrointestinal endoscope reprocessing[J]. Biomed Res Int, 2019, 2019: 7940468. |
| [29] |
ECRI Institute. Top 10 health technology hazards for 2022[EB/OL]. (2022-01-19)[2023-03-15]. https://www.iomc.org/resources/Documents/ECRI_Top10Hazards_2022_ExecutiveBrief.pdf.
|



