Mechanisms of resistance to ceftazidime/avibactam of carbapenem-resis-tant Klebsiella pneumoniae
-
摘要:
目的 探讨耐碳青霉烯类肺炎克雷伯菌(CRKP)的分子流行病学特点,揭示其对头孢他啶/阿维巴坦(CZA)的耐药机制。 方法 收集2021年1月—2023年9月徐州医科大学附属医院临床首次分离的CZA耐药CRKP,采用基因扩增法和胶体金法检测blaKPC、blaNDM、blaOXA、blaVIM和blaIMP五种碳青霉烯酶基因携带情况,采用实时荧光定量聚合酶链反应(RT-qPCR)方法检测产肺炎克雷伯菌碳青霉烯酶肺炎克雷伯菌(KPC-KP)相对拷贝数以及表达量,采用全基因测序方法分析KPC突变株的突变位点,以分析CRKP流行特征及对CZA的耐药机制。 结果 共分离73株对CZA耐药的CRKP,其中37株(50.68%)为KPC+NDM联产菌株,33株(45.21%)为单产NDM的菌株(单产NDM-5 23株,单产NDM-1 10株),3株单产KPC的菌株。发现菌株KP-2842为ST11型KPC-33突变株;菌株KP-2127和KP-2189为产KPC-2菌株,与肺炎克雷伯菌ATCC BAA-1705相比,其blaKPC拷贝量分别上调1.04~3.86倍,而表达量分别增加6.66~12.93倍;胶体金法与PCR结合双向测序方法两者结果一致性良好,同时可以覆盖联产酶及KPC-33突变体的检测。 结论 该院CRKP对CZA耐药机制主要由金属酶NDM介导,其中NDM、KPC联产是本地区CRKP的主要特点,部分菌株对CZA耐药可能由blaKPC-2高拷贝和高表达导致,并在江苏地区的ST11型CRKP中首次发现了KPC-33突变体。 -
关键词:
- 肺炎克雷伯菌 /
- 碳青霉烯酶 /
- 突变 /
- 头孢他啶/阿维巴坦 /
- 耐碳青霉烯类肺炎克雷伯菌
Abstract:Objective To explore the molecular epidemiological characteristics of carbapenem-resistant Klebsiella pneumoniae (CRKP), and reveal its mechanism of resistance to ceftazidime/avibactam (CZA). Methods CZA-resistant CRKP strains initially isolated from the Affiliated Hospital of Xuzhou Medical University from January 2021 to September 2023 were collected. The carriage of 5 carbapenemase genes (blaKPC, blaNDM, blaOXA, blaVIM, blaIMP) were detected with gene amplification method and colloidal gold method. The relative copy number and expression level of Klebsiella pneumoniae (KP) carbapenemase-producing KP (KPC-KP) was detected with real-time quantitative polymerase chain reaction (RT-qPCR), mutation sites of KPC mutation strains were analyzed with whole-genome sequencing, and epidemic characteristics of CRKP and resistance mechanism to CZA were analyzed. Results A total of 73 CZA-resistant CRKP strains were isolated, with 37 (50.68%) being KPC and NDM co-producing strains, 33 (45.21%) NDM-producing alone (23 strains producing NDM-5 and 10 strains producing NDM-1), and 3 KPC-producing alone. KP-2842 strain was identified as ST11-type KPC-33 variant, KP-2127 and KP-2189 strains produced KPC-2. Compared with KP ATCC BAA-1705, the copy number of blaKPC in these strains up-regulated by 1.04-3.86 fold, and the expression increased by 6.66-12.93 fold, respectively. Colloidal gold and PCR methods demonstrated good consistency and the ability to detect the enzyme co-producing and KPC-33 variant. Conclusion In this hospital, the resistance of CRKP to CZA is primarily mediated by the metalloenzyme NDM, with co-production of NDM and KPC being a characteristic of CRKP. High copy number and expression level of blaKPC-2 also contribute to CZA resistance. This study identified the KPC-33 variant for the first time in ST11-type CRKP in Jiangsu Province. -
耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)因其高耐药性、高传播性和高病死率已对临床抗感染治疗构成了严峻挑战[1]。在应对CRKP感染的治疗药物中,多黏菌素、替加环素在疗效和安全性方面存在使用限制,因此头孢他啶/阿维巴坦(ceftazidime/avibactam, CZA)已成为CRKP感染治疗的较优选择[2]。CZA是我国于2019年被批准用于临床治疗的一种新型复合制剂[3],对多重耐药革兰阴性杆菌引起的复杂性腹腔内感染、复杂性泌尿系统感染,以及医院获得性肺炎有较好的疗效,是目前治疗产KPC、AmpC等非金属酶CRKP感染的主要药物之一,但其抗菌谱不覆盖产NDM、IMP等金属酶的CRKP[4-5]。随着CZA的广泛应用已出现了较多耐药病例的报道,而且呈上升趋势[6]。CZA耐药CRKP的出现进一步提升了临床耐碳青霉烯类肠杆菌目细菌(CRE)感染治疗的难度,目前其耐药机制以及相关流行病学数据较为缺乏。为此,本研究就徐州医科大学附属医院2021年1月—2023年9月CZA耐药CRKP的流行病学特征、耐药机制进行分析,以延缓CZA耐药,为临床抗感染精准治疗提供实验室依据。
1. 材料与方法
1.1 菌株来源
试验纳入菌株为徐州医科大学附属医院2021年1月—2023年9月临床各科室分离的不重复CZA耐药CRKP菌株(对亚胺培南或美罗培南任一耐药)。试验对照菌株肺炎克雷伯菌ATCC BAA-1705由南通大学附属医院许波银老师赠送。本研究获该院伦理委员会批准(审批号XYFY2022-KL008-01)。
1.2 仪器与试剂
MALDI-TOF MS(德国布鲁克),VITEK 2 Compact及药敏卡AST-N335(法国梅里埃),聚合酶链式反应(PCR)仪(美国BIO-RAD),CZA药敏纸片(意大利Liofilchem),DNA Marker、PCR引物、Agarose N、GelRed核酸染料、SGExcel FastSYBR Master预混液(上海生工生物公司),碳青霉烯酶胶体金试剂盒(丹娜生物科技),TRIzol试剂(上海李记生物公司),磁珠法细菌DNA提取试剂盒D6361-02(广州美基生物科技),逆转录试剂盒(武汉塞维尔公司)。
1.3 方法
1.3.1 菌株鉴定及药物敏感试验
将血平板上分离的单个纯菌落采用质谱仪复核菌种,VITEK 2 Compact进行药物敏感试验,药物敏感折点判读参照美国临床实验室标准化协会(CLSI)[7]标准,替加环素药敏折点判读参照美国食品药品监督局(FDA)[8]标准,CZA采用纸片扩散法检测,抑菌圈直径≤20 mm为耐药。
1.3.2 临床资料的收集
使用电子病历系统病例查阅栏收集3例产KPC酶的肺炎克雷伯菌(KPC-KP)感染患者的诊断、治疗和转归资料。
1.3.3 碳青霉烯酶基因的检测
(1) 胶体金法:将73株CZA耐药CRKP培养获得纯菌落,在每个EP管中加入300 μL裂解液,挑取纯菌落置于裂解液中,漩涡震荡10 s使细菌在裂解液中充分混匀后静置10 min,吸取200 μL于免疫层析试纸的两个加样孔,等待15 min观察结果[9]。(2)PCR法:煮沸法提取73株CZA耐药的CRKP基因组,采用PCR及凝胶电泳,双向测序检测5种最常见的碳青霉烯酶基因,引物由生工生物南京分公司合成,引物设计及反应体系设置见参考文献[10]方法,引物参数见表 1。将扩增产物提交上海生工生物公司测序,采用Snapgene将序列与GeneBank中下载的模板基因比对分析。
表 1 碳青霉烯酶基因引物序列及相关参数Table 1 Primer sequences and related parameters of carba-penemase genes目的基因 引物序列(5’-3’) 退火温度(℃) 产物长度(bp) blaKPC F:ATCGCCGTCTAGTTCTGCTG 60 811 R:TCGCTGTGCTTGTCATCCTT blaNDM F:GCATTAGCCGCTGCATTGAT 60 704 R:TGGCTCATCACGATCATGCT blaVIM F:TAGCCGAGGTAGAGGGGAAC 60 383 R:TGCCTGCTACTCAACGACTG blaIMP F:AAGAAGTTAACGGGTGGGGC 60 385 R:CTTTCAGGCAGCCAAACCAC blaOXA-48 F:ATTATCGGAATGCCAGCGGT 60 706 R:GCAGCCCTAAACCATCCGAT 注:F为上游引物;R为下游引物。 1.3.4 全基因组测序
使用磁珠法提取KPC突变菌株的基因组DNA,寄送至上海生工生物公司完成全基因组测序及序列拼接,在proksee网站(https://proksee.ca/)进行全基因组序列分析。提取KPC突变菌株7个管家基因序列,在相关网站完成多位点序列分型(MLST,https://cge.food.dtu.dk/services/MLST/)。
1.3.5 blaKPC相对拷贝数的检测
采用煮沸法提取3株KPC-KP的DNA,以肺炎克雷伯菌ATCC BAA-1705为对照菌株,采用实时荧光定量聚合酶链反应(real-time quantitative PCR, RT-qPCR)法检测blaKPC拷贝数,引物序列及参数见表 2。反应体系配置为:2×SGExcel FastSYBR Mixture 10 μL,前后引物各0.4 μL,DNA模板1 μL,无菌无酶水8.2 μL。反应参数设置为:95℃ 5 min;95℃ 5 s,56℃ 10 s,72℃ 10 s,循环40次;内部参照基因为管家基因rpoB,采用2-ΔΔCT公式计算相对拷贝数,所有菌株DNA提取3次,qPCR设置3个复孔。
表 2 RT-qPCR扩增引物及相关参数Table 2 RT-qPCR amplification primers and related para-meters目的基因 引物序列(5’-3’) 退火温度(℃) 产物长度(bp) blaKPC F: CGGAACCTGCGGAGTGTATGG 56 119 R: CGCTGTGCTTGTCATCCTTGTTA rpoB F: TGTAGAGCGTGCGGTGAAAGAG 58 88 R: GGAAATCGGCTTGGCGTTGATC 注:F为上游引物;R为下游引物。 1.3.6 blaKPC相对表达量的检测
采用TRIzol法提取KPC-KP RNA(1×108个细菌溶解于1 mL TRIzol),逆转录试剂盒法获得其cDNA后,采用RT-qPCR法进行相对表达量检测。对照菌株、内部参照基因、RT-qPCR引物、反应参数同1.3.5。采用2-ΔΔCT公式计算相对表达量,所有菌株RNA提取3次,qPCR设置3个复孔。
1.4 统计学处理
RT-qPCR数据采用Welch’s t-test(双尾)进行统计学分析,计量资料用中位数(四分位数)[M(P25,P75)]表示,P≤0.05为差异具有统计学意义。
2. 结果
2.1 菌株特征及分布
73株CZA耐药CRKP分离患者中,男性占比61.64%,年龄为63(32,74)岁;17株分离自年龄<1岁的患者,40株分离自>60岁的患者。菌株主要来源于痰(69.86%)、导管(10.96%) 及尿(6.85%)标本,主要分离自各科室重症监护病房(ICU,67.12%)、神经外科病房(21.92%)及血液内科病房(2.74%)。见表 3。
表 3 耐CZA的CRKP特征及分布情况Table 3 Characteristics and distribution of CZA-resistant CRKP来源 株数(n=73) 构成比(%) 标本 痰 51 69.86 导管 8 10.96 尿 5 6.85 血 4 5.48 脓液 2 2.74 支气管肺泡灌洗液 2 2.74 腹腔引流液 1 1.37 科室 新生儿ICU 17 23.28 神经外科病房 16 21.92 神经内科ICU 12 16.44 急诊ICU 6 8.22 综合ICU 6 8.22 神经外科ICU 5 6.85 呼吸科ICU 3 4.11 血液内科病房 2 2.74 神经内科病房 2 2.74 呼吸科病房 1 1.37 普外科病房 1 1.37 泌尿外科病房 1 1.37 胃肠外科 1 1.37 2.2 药敏试验结果
药敏试验结果显示,73株CZA耐药CRKP对多数抗菌药具有耐药性,尤其对头孢菌素类及青霉素类抗生素耐药率已达100%,对氨基糖苷类、喹诺酮类、四环素类、磺胺类及单环β-内酰胺类药物氨曲南的耐药率稍低,但也超过60%,仅发现1株CRKP对多黏菌素耐药,所有CRKP对替加环素均敏感,见表 4。17株对氨曲南敏感的CRKP均来源于新生儿ICU。
表 4 73株CZA耐药CRKP对17种抗菌药物的耐药情况Table 4 Resistance of 73 CZA-resistant CRKP strains to 17 antimicrobial agents抗菌药物 耐药株数 耐药率(%) 哌拉西林/他唑巴坦 73 100 替卡西林/克拉维酸 73 100 头孢吡肟 73 100 头孢他啶 73 100 头孢哌酮/舒巴坦 73 100 氨曲南 56 76.71 亚胺培南 72 98.63 美罗培南 73 100 阿米卡星 45 61.64 妥布霉素 51 69.86 米诺环素 47 64.38 多西环素 55 75.34 替加环素 0 0 左氧氟沙星 52 71.23 环丙沙星 61 83.56 复方磺胺甲 
52 71.23 多黏菌素 1 1.37 2.3 碳青霉烯酶基因型检测结果
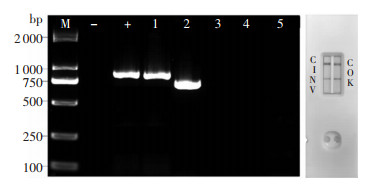
碳青霉烯酶基因型胶体金法检测结果显示,73株耐CZA的CRKP中,37株同时产KPC和NDM,33株单产NDM株,3株单产KPC。碳青霉烯酶基因型PCR结合双向测序与胶体金方法结果一致率为100%。见表 5。KPC与NDM联产菌株PCR产物电泳及胶体金检测结果见图 1。
表 5 CZA耐药CRKP菌株两种检测方法检出碳青霉烯酶基因型分布Table 5 Distribution of carbapenemase genotypes detected by two methods for CZA-resistant CRKP strains碳青霉烯酶基因型 胶体金法 PCR法 株数 构成比(%) 株数 构成比(%) blaKPC-2+blaNDM-1 37 50.68 37 50.68 blaNDM 33 45.21 33 45.21 blaNDM-5 - - 23 31.51 blaNDM-1 - - 10 13.70 blaKPC 3 4.11 3 4.11 blaKPC-2 - - 2 2.74 blaKPC-33 - - 1 1.37 合计 73 100 73 100 注:-代表胶体金法不能区分基因亚型,数据不存在。 2.4 KPC突变菌株全基因组测序结果
对73株CZA耐药CRKP菌株进行Sanger测序后,发现1株blaKPC-2突变株KP-2842,基因组测序结果显示为ST11型,在blaKPC-2的532发生碱基突变(G532T),导致在KPC-2酶第179位的氨基酸天冬氨酸被酪氨酸取代(D179Y),经比对与blaKPC-33序列一致。
2.5 KPC-KP blaKPC相对拷贝数及表达量
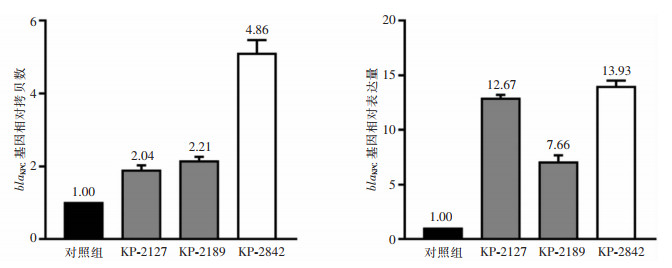
共检出3株KPC-KP(KP-2127、KP-2189、KP-2842)菌株,与对照菌株肺炎克雷伯菌ATCC BAA-1705相比,blaKPC相对拷贝量分别上调至2.04、2.21、4.86倍,相对表达量分别增加至12.67、7.66、13.93倍。见图 2。
2.6 3株KPC-KP感染患者治疗与转归
KP-2127感染患者,32岁,男性,因前交通动脉瘤破裂伴蛛网膜下腔出血入住神经外科ICU,住院第24天痰培养检出CZA耐药CRKP,经呼吸内科会诊后改为多黏菌素静脉滴注及雾化吸入治疗,第39天患者病情好转转入社区医院继续康复治疗。KP-2189感染患者,77岁,女性,因小脑出血破入脑室入住神经外科病房,住院期间因肺部感染使用注射用磷酸阿米卡星治疗14 d,治疗第13天痰培养检出CZA耐药CRKP,患者家属要求转院治疗。KP-2842感染患者,62岁,女性,因多发性颅内动脉瘤破裂伴蛛网膜下腔出血入住神经外科,住院第6天痰培养检出碳青霉烯类敏感肺炎克雷伯(CSKP),住院第24天痰培养检出CZA敏感CRKP,期间使用注射用头孢尼西钠、头孢他啶、左氧氟沙星等多种药物,住院第29天痰培养检出CZA耐药CRKP,改用替加环素治疗7 d后痰培养仍显示该病原菌未被清除,转入社区医院继续治疗。
3. 讨论
本文对临床标本分离的73株CZA耐药CRKP的标本来源、耐药性及耐药机制进行研究,发现分离自年龄<1岁和>60岁的患者占比最高,此与这类患者抵抗力较弱、感染风险高有关,菌株分离自痰标本占比最高,达69.86%,与相关研究[11-12]结果一致,提示呼吸道标本是CZA耐药CRKP的主要来源,加强呼吸道卫生的管理或可一定程度预防CZA耐药CRKP感染。本研究发现CZA耐药CRK感染病例多来源于ICU,一方面与入住该科的患者免疫力低下,常接受侵入性操作及应用多种抗菌药物有关。既往研究[13]表明,入住ICU是感染CRKP的危险因素之一;另一方面因CRKP可移动元件常能介导耐药基因水平传播,导致该类耐药菌常可以在医疗机构内,尤其是ICU内传播流行。因此,医院应将ICU作为感染防控的重点科室。
对临床分离的CRKP菌株进行准确、快速的酶型检测可减少临床经验性广谱抗菌药物的不合理使用。目前实验室检测碳青霉烯酶的手段多样,包括mCIM-eCIM联合试验、APB-EDTA试验、Carba NP试验等表型检测方法,以及本试验采用的测序和胶体金基因型检测方法。本研究胶体金方法和测序结果呈现出高度一致性,而且覆盖了联产酶和KPC突变体KPC-33酶,同时灵敏度及准确性也良好,无需特殊的设备,操作简单快速便于推广,可指导临床医生根据碳青霉烯酶型选择治疗方案。
据中国细菌耐药监测网(CHINET)[14]监测数据,肺炎克雷伯菌对碳青霉烯类药物的耐药率已达20%以上。CRKP主要的耐药机制是产碳青霉烯酶,但所产酶型具有区域和人群分布差异[15]。在我国,丝氨酸酶KPC和金属酶NDM的产生是其对碳青霉烯类耐药的首要原因,成人以KPC酶为主,儿童以NDM酶为主[16]。CZA能有效抑制A、C类及部分D类β-内酰胺酶,但对B类金属酶无抑制作用[17]。本研究73株CZA耐药CRKP中,有70株(95.89%)产NDM,表明产生金属酶是该院CRKP对CZA耐药的主要机制,与Chen等[18]的研究结果相符。其中有37株联产NDM和KPC,这使得临床治疗难度更大,可选择的药物更加局限。因CZA无法水解金属酶NDM[17],其应用对产该酶的菌株有一定的筛选作用。来自欧洲的一项研究[19]表明,在CZA投入使用后的筛选压力下,该医疗机构ICU内CRKP菌株碳青霉烯酶的优势酶型从丝氨酸酶KPC转变为金属酶VIM。因此,在抗菌药物应用之前准确、快速检测碳青霉烯酶基因型,对于临床CRKP感染的精准治疗和延缓耐药的产生是非常必要的。
不同碳青霉烯酶对抗菌药物的活性存在差异,当其产多种碳青霉烯酶时常呈现多药耐药、高水平耐药[20],因此使用单一药物治疗效果往往不佳,意味着这部分菌株的临床治疗更加困难,对其治疗需要联合用药或研发新的抗菌药物复合制剂。2013年巴西首次报道了1株KPC-NDM联产的霍氏肠杆菌,后又在印度等地区的肺炎克雷伯菌中检出[21-22],新型冠状病毒感染流行期间巴西曾报道同时携带这两种基因的CRKP引起的医院感染暴发[23],本研究发现的KPC与NDM联产菌株除1株外均为2021年新型冠状病毒感染流行期间检出,提示可能存在这种菌株的局部流行。Gao等[20]研究表明,KPC-2与NDM-1联产菌株有较强的适应性和传播性,进化分析显示,可能是blaKPC-2阳性CRKP获得了一个携带blaNDM-1的质粒进化而来,并可稳定遗传,提示这种联产菌株是今后实验室和临床需要重点关注的耐药菌。
药敏试验结果显示,73株CZA耐药CRKP对头孢菌素类和青霉素类药物均耐药,对喹诺酮类左氧氟沙星、磺胺类复方磺胺甲
目前已知的CRKP对CZA的耐药机制还有基于KPC-2、KPC-3部分氨基酸的突变形成新的KPC亚型,如KPC-31、KPC-33等,除此之外还有野生型blaKPC拷贝及表达增加合并膜通透性改变或者外排泵表达增加等[30]。本研究发现1株KPC-KP为KPC-33突变体,该种突变体曾在我国北京[31]、上海[32-33]和河南[34]等地区被检出,这是在江苏地区首次发现ST11型CRKP菌株携带blaKPC-33,此外,还有2株对CZA耐药的KPC-KP经测序并未发现KPC-2的编码基因突变,RT-qPCR结果显示其blaKPC-2相对拷贝数及表达量较肺炎克雷伯菌ATCC BAA-1705有不同程度上调,这可能是其出现CZA耐药的主要原因,是否合并产β-内酰胺酶(ESBLs)基因表达、膜孔通透性改变及外排上调等机制有待进一步研究。
本研究表明随着CZA的广泛使用,其耐药菌株在药物的选择压力下逐渐增加,产金属酶NDM是该院CRKP对CZA耐药的主要机制,其中KPC-2、NDM-1联产为最显著的特点,同时该院部分CRKP因blaKPC-2突变或拷贝数上调导致其对CZA耐药,虽然本研究仅是一家单中心研究,无法代替整个地区的真实流行情况,但是这些数据仍应引起实验室和临床的足够重视,实验室应该积极提供碳青霉烯酶型检测,以便临床医生根据酶型结果进行精准治疗,双方密切配合以控制该耐药菌在医疗机构内传播与流行。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 碳青霉烯酶基因引物序列及相关参数
Table 1 Primer sequences and related parameters of carba-penemase genes
目的基因 引物序列(5’-3’) 退火温度(℃) 产物长度(bp) blaKPC F:ATCGCCGTCTAGTTCTGCTG 60 811 R:TCGCTGTGCTTGTCATCCTT blaNDM F:GCATTAGCCGCTGCATTGAT 60 704 R:TGGCTCATCACGATCATGCT blaVIM F:TAGCCGAGGTAGAGGGGAAC 60 383 R:TGCCTGCTACTCAACGACTG blaIMP F:AAGAAGTTAACGGGTGGGGC 60 385 R:CTTTCAGGCAGCCAAACCAC blaOXA-48 F:ATTATCGGAATGCCAGCGGT 60 706 R:GCAGCCCTAAACCATCCGAT 注:F为上游引物;R为下游引物。 表 2 RT-qPCR扩增引物及相关参数
Table 2 RT-qPCR amplification primers and related para-meters
目的基因 引物序列(5’-3’) 退火温度(℃) 产物长度(bp) blaKPC F: CGGAACCTGCGGAGTGTATGG 56 119 R: CGCTGTGCTTGTCATCCTTGTTA rpoB F: TGTAGAGCGTGCGGTGAAAGAG 58 88 R: GGAAATCGGCTTGGCGTTGATC 注:F为上游引物;R为下游引物。 表 3 耐CZA的CRKP特征及分布情况
Table 3 Characteristics and distribution of CZA-resistant CRKP
来源 株数(n=73) 构成比(%) 标本 痰 51 69.86 导管 8 10.96 尿 5 6.85 血 4 5.48 脓液 2 2.74 支气管肺泡灌洗液 2 2.74 腹腔引流液 1 1.37 科室 新生儿ICU 17 23.28 神经外科病房 16 21.92 神经内科ICU 12 16.44 急诊ICU 6 8.22 综合ICU 6 8.22 神经外科ICU 5 6.85 呼吸科ICU 3 4.11 血液内科病房 2 2.74 神经内科病房 2 2.74 呼吸科病房 1 1.37 普外科病房 1 1.37 泌尿外科病房 1 1.37 胃肠外科 1 1.37 表 4 73株CZA耐药CRKP对17种抗菌药物的耐药情况
Table 4 Resistance of 73 CZA-resistant CRKP strains to 17 antimicrobial agents
抗菌药物 耐药株数 耐药率(%) 哌拉西林/他唑巴坦 73 100 替卡西林/克拉维酸 73 100 头孢吡肟 73 100 头孢他啶 73 100 头孢哌酮/舒巴坦 73 100 氨曲南 56 76.71 亚胺培南 72 98.63 美罗培南 73 100 阿米卡星 45 61.64 妥布霉素 51 69.86 米诺环素 47 64.38 多西环素 55 75.34 替加环素 0 0 左氧氟沙星 52 71.23 环丙沙星 61 83.56 复方磺胺甲 
52 71.23 多黏菌素 1 1.37 表 5 CZA耐药CRKP菌株两种检测方法检出碳青霉烯酶基因型分布
Table 5 Distribution of carbapenemase genotypes detected by two methods for CZA-resistant CRKP strains
碳青霉烯酶基因型 胶体金法 PCR法 株数 构成比(%) 株数 构成比(%) blaKPC-2+blaNDM-1 37 50.68 37 50.68 blaNDM 33 45.21 33 45.21 blaNDM-5 - - 23 31.51 blaNDM-1 - - 10 13.70 blaKPC 3 4.11 3 4.11 blaKPC-2 - - 2 2.74 blaKPC-33 - - 1 1.37 合计 73 100 73 100 注:-代表胶体金法不能区分基因亚型,数据不存在。 -
[1] Tsioutis C, Eichel VM, Mutters NT. Transmission of Klebsiella pneumoniae carbapenemase (KPC)-producing Klebsiella pneumoniae: the role of infection control[J]. J Antimicrob Chemother, 2021, 76(Suppl 1): i4-i11. [2] Tsuji BT, Pogue JM, Zavascki AP, et al. International consensus guidelines for the optimal use of the polymyxins: endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-Infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and So-ciety of Infectious Diseases Pharmacists (SIDP)[J]. Pharmacotherapy, 2019, 39(1): 10-39. doi: 10.1002/phar.2209 [3] van Duin D, Bonomo RA. Ceftazidime/avibactam and ceftolo-zane/tazobactam: second-generation β-lactam/β-lactamase inhibitor combinations[J]. Clin Infect Dis, 2016, 63(2): 234-241. doi: 10.1093/cid/ciw243 [4] Shields RK, Nguyen MH, Chen L, et al. Ceftazidime-avibactam is superior to other treatment regimens against carbape-nem-resistant Klebsiella pneumoniae bacteremia[J]. Antimicrob Agents Chemother, 2017, 61(8): e00883-17. [5] Petraitiene R, Petraitis V, Kavaliauskas P, et al. Pharmacokinetics and efficacy of ceftazidime-avibactam in the treatment of experimental pneumonia caused by Klebsiella pneumoniae carbapenemase-producing K. pneumoniae in persistently neutropenic rabbits[J]. Antimicrob Agents Chemother, 2020, 64(4): e02157-19. [6] Wang YH, Wang J, Wang R, et al. Resistance to ceftazidime-avibactam and underlying mechanisms[J]. J Glob Antimicrob Resist, 2020, 22: 18-27. doi: 10.1016/j.jgar.2019.12.009 [7] CLSI. Performance standards for antimicrobial susceptibility testing: M100 30th Edition[S]. Malvern, PA, USA: CLSI, 2020. [8] 中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组. 多黏菌素类与替加环素及头孢他啶/阿维巴坦药敏方法和报告专家共识[J]. 中华检验医学杂志, 2020, 43(10): 964-972. Society of Clinical Microbiology and Infection of China International Exchange and Promotion Association for Medical and Healthcare, Clinical Microbiology Group of the Laboratory Medicine Society of the Chinese Medical Association, Clinical Microbiology Group of the Microbiology and Immunology So-ciety of the Chinese Medical Association. Expert consensus on polymyxins, tigecycline and ceftazidime/avibactam susceptibi-lity testing[J]. Chinese Journal of Laboratory Medicine, 2020, 43(10): 964-972. [9] 丹娜(天津)生物科技股份有限公司, 丹娜(湖南)生物科技有限责任公司, 丹娜(天津)医学检验有限公司. 碳青霉烯酶免疫层析检测试纸及其制备方法、试剂盒和应用: CN202211185654.7[P]. 2023-04-14. Dynamiker Biotechnology (Tianjin) Co., Ltd, Dynamiker Biotechnology (Hunan) Co., Ltd, Dynamiker (Tianjin) Medical Laboratory Co., Ltd. Carbapenemase immunochromatogra-phic test paper and its preparation method, kit and application: CN202211185654.7[P]. 2023-04-14. [10] Poirel L, Walsh TR, Cuvillier V, et al. Multiplex PCR for detection of acquired carbapenemase genes[J]. Diagn Microbiol Infect Dis, 2011, 70(1): 119-123. doi: 10.1016/j.diagmicrobio.2010.12.002 [11] 胡小品, 袁国航, 吴瑶瑶, 等. 中国西南地区3所综合性医院耐碳青霉烯类肺炎克雷伯菌流行病学特征及耐药性[J]. 中国感染控制杂志, 2022, 21(2): 121-127. doi: 10.12138/j.issn.1671-9638.20221872 Hu XP, Yuan GH, Wu YY, et al. Molecular epidemiological characteristics and antimicrobial resistance of carbapenem-resistant Klebsiella pneumoniae in three general hospital in southwest China[J]. Chinese Journal of Infection Control, 2022, 21(2): 121-127. doi: 10.12138/j.issn.1671-9638.20221872 [12] 黄丽萍, 肖力英, 陈东杰, 等. 福州地区耐碳青霉烯肺炎克雷伯菌对头孢他啶-阿维巴坦的药敏情况及耐药分析[J]. 福建医药杂志, 2021, 43(5): 5-9. Huang LP, Xiao LY, Chen DJ, et al. Analysis of drug sensitivity and resistance of carbapenem-resistant Klebsiella pneumoniae to ceftazidime-avibactam in Fuzhou[J]. Fujian Medical Journal, 2021, 43(5): 5-9. [13] Liu P, Li X, Luo M, et al. Risk factors for carbapenem-resis-tant Klebsiella pneumoniae infection: a Meta-analysis[J]. Microb Drug Resist, 2018, 24(2): 190-198. doi: 10.1089/mdr.2017.0061 [14] 胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2022, 22(5): 521-530. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of antimicrobial resistance among the bacterial isolates in 2021[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(5): 521-530. [15] Han RR, Shi QY, Wu S, et al. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Microbiol, 2020, 10: 314. doi: 10.3389/fcimb.2020.00314 [16] Jiang MX, Li H, Liu X, et al. Genomic analysis revealed the international and domestic transmission of carbapenem-resis-tant Klebsiella pneumoniae in Chinese pediatric patients[J]. Microbiol Spectr, 2023, 11(2): e0321322. doi: 10.1128/spectrum.03213-22 [17] Sanz Herrero F. Ceftazidime-avibactam[J]. Rev Esp Quimio-ter, 2022, 35(Suppl 1): 40-42. [18] Chen D, Xiao L, Hong D, et al. Epidemiology of resistance of carbapenemase-producing Klebsiella pneumoniae to ceftazidime-avibactam in a Chinese hospital[J]. J Appl Microbiol, 2022, 132(1): 237-243. [19] Papadimitriou-Olivgeris M, Bartzavali C, Lambropoulou A, et al. Reversal of carbapenemase-producing Klebsiella pneumo-niae epidemiology from blaKPC- to blaVIM-harbouring isolates in a Greek ICU after introduction of ceftazidime/avibactam[J]. J Antimicrob Chemother, 2019, 74(7): 2051-2054. [20] Gao H, Liu YD, Wang RB, et al. The transferability and evolution of NDM-1 and KPC-2 co-producing Klebsiella pneumo-niae from clinical settings[J]. EBioMedicine, 2020, 51: 102599. [21] Ahmed MAEGES, Yang YX, Yang YQ, et al. Emergence of hypervirulent carbapenem-resistant Klebsiella pneumoniae coharboring a blaNDM-1-carrying virulent plasmid and a blaKPC-2-carrying plasmid in an egyptian hospital[J]. mSphere, 2021, 6(3): e00088-21. [22] Vásquez-Ponce F, Dantas K, Becerra J, et al. Detecting KPC-2 and NDM-1 coexpression in Klebsiella pneumoniae complex from human and animal hosts in South America[J]. Microbiol Spectr, 2022, 10(5): e0115922. [23] Boralli CMDS, Paganini JA, Meneses RS, et al. Characterization of blaKPC-2 and blaNDM-1 plasmids of a K. pneumoniae ST11 outbreak clone[J]. Antibiotics (Basel), 2023, 12(5): 926. [24] Zhou JJ, Yang JW, Hu FP, et al. Clinical and molecular epidemiologic characteristics of ceftazidime/avibactam-resistant carbapenem-resistant Klebsiella pneumoniae in a neonatal intensive care unit in China[J]. Infect Drug Resist, 2020, 13: 2571-2578. [25] Bocanegra-Ibarias P, Camacho-Ortiz A, Garza-González E, et al. Aztreonam plus ceftazidime-avibactam as treatment of NDM-1-producing Klebsiella pneumoniae bacteraemia in a neutropenic patient: last resort therapy?[J]. J Glob Antimicrob Resist, 2020, 23: 417-419. [26] Lu GP, Tang H, Xia ZX, et al. In vitro and in vivo antimicrobial activities of ceftazidime/avibactam alone or in combination with aztreonam against carbapenem-resistant Enterobacterales[J]. Infect Drug Resist, 2022, 15: 7107-7116. [27] Zou DY, Huang Y, Zhao XN, et al. A novel New Delhi meta-llo-β-lactamase variant, NDM-14, isolated in a Chinese Hospital possesses increased enzymatic activity against carbapenems[J]. Antimicrob Agents Chemother, 2015, 59(4): 2450-2453. [28] 丁丽, 郑永贵, 吴湜, 等. 抗菌药物联合治疗产NDM-5型金属酶肺炎克雷伯菌血流感染1例[J]. 中国感染与化疗杂志, 2022, 22(3): 336-338. Ding L, Zheng YG, Wu S, et al. Combined antimicrobial treatment of NDM-5 producing Klebsiella pneumoniae bloodstream infection: one case report[J]. Chinese Journal of Infection and Chemotherapy, 2022, 22(3): 336-338. [29] 临床常用四环素类药物合理应用多学科专家共识编写组, 中华预防医学会医院感染控制分会, 中国药理学会临床药理分会. 临床常用四环素类药物合理应用多学科专家共识[J]. 中华医学杂志, 2023, 103(30): 2281-2296. Editing Group for Multidisciplinary Expert Consensus on the Rational Use of Tetracyclines Commonly Used in Clinical Practice, Hospital Infection Control Branch of Chinese Preventive Medicine Association, Clinical Pharmacology Branch of Chinese Pharmacological Society. Multidisciplinary expert consensus on the rational use of tetracyclines commonly used in clinical practice[J]. National Medical Journal of China, 2023, 103(30): 2281-2296. [30] Xiong LY, Wang XT, Wang Y, et al. Molecular mechanisms underlying bacterial resistance to ceftazidime/avibactam[J]. WIREs Mech Dis, 2022, 14(6): e1571. [31] Wang CL, Zhao JK, Liu ZB, et al. In vivo selection of imipenem resistance among ceftazidime-avibactam-resistant, imipenem-susceptible Klebsiella pneumoniae isolate with KPC-33 carbapenemase[J]. Front Microbiol, 2021, 12: 727946. [32] Ding L, Shen SQ, Han RR, et al. Ceftazidime-avibactam in combination with imipenem as salvage therapy for ST11 KPC-33-producing Klebsiella pneumoniae[J]. Antibiotics (Basel), 2022, 11(5): 604. [33] Shi QY, Han RR, Guo Y, et al. Multiple novel ceftazidime-avibactam-resistant variants of blaKPC-2-positive Klebsiella pneumoniae in two patients[J]. Microbiol Spectr, 2022, 10(3): e0171421. [34] Li DB, Li KY, Dong HL, et al. Ceftazidime-avibactam resis-tance in Klebsiella pneumoniae sequence type 11 due to a mutation in plasmid-borne blaKPC-2 to blaKPC-33, in Henan, China[J]. Infect Drug Resist, 2021, 14: 1725-1731.

 下载:
下载: