Surveillance data of disinfection efficacy for gastroscopes and enteroscopes in 184 medical institutions from 2010 to 2022
-
摘要:
目的 了解中国医疗机构胃镜和肠镜的消毒质量, 为消化内镜的科学消毒提供指导。 方法 2010—2022年依托"全国医院消毒与感染控制监测"项目对中国30个省份184所医疗机构胃镜和肠镜的消毒工作进行调查, 并对胃镜和肠镜的清洗消毒质量进行分析。 结果 2010—2022年, 184所医疗机构共采集6 421份消毒后内镜标本, 包括4 011份胃镜标本, 2 410份肠镜标本。2010—2022年, 中国胃镜消毒合格率从87.6%上升至97.9%, 肠镜消毒合格率从75.9%上升至95.4%。二级医疗机构内镜消毒的平均合格率低于三级医疗机构(87.5% VS 92.1%)。不同种类内镜消毒剂的消毒效果也存在差异, 其中过氧乙酸的合格率最高(95.6%~95.7%), 邻苯二甲醛次之(93.6%~95.0%), 而酸性氧化电位水的合格率较低, 仅为55.0%~85.0%。 结论 中国胃镜及肠镜的消毒质量持续改善, 但仍需要加强日常消毒质量的监测。 Abstract:Objective To evaluate the disinfection quality of gastroscopes and enteroscopes in medical institutions across China, and provide scientific guidance for the disinfection of digestive endoscopes. Methods From 2010 to 2022, relying on the "National Hospital Disinfection and Infection Control Surveillance" project, the disinfection status of gastroscopes and enteroscopes in 184 medical institutions in 30 provinces in China was investigated, clea-ning and disinfection quality of gastroscopes and enteroscopes was analyzed. Results From 2010 to 2022, a total of 6 421 post-disinfection endoscope specimens were collected from 184 medical institutions, including 4 011 gastroscope specimens and 2 410 enteroscope specimens. From 2010 to 2022, the qualified rate of disinfection of gastroscopes and enteroscopes in China increased from 87.6% to 97.9% and 75.9% to 95.4%, respectively. The average qualified rate of disinfection of endoscopes in secondary medical institutions was lower than that in tertiary medical institutions (87.5% vs 92.1%). The disinfection efficacy of different kinds of endoscopic disinfectants was also different, among which the qualified rate of peracetic acid was the highest (95.6%-95.7%), followed by o-phthalaldehyde (93.6%-95.0%). The qualified rate of acidic electrolyzed-oxidizing water was low, only 55.0%-85.0%. Conclusion The disinfection quality of gastroscopes and enteroscopes in China has been continuously improved, and it is still necessary to strengthen the surveillance on daily disinfection quality. -
近年来,我国内镜技术发展迅速,内镜检查已成为临床诊疗中的关键工具。软式内镜,如胃镜、肠镜等因直接接触患者消化道黏膜,需严格执行高水平消毒。然而,国内外仍时有因内镜诊疗引发感染暴发的报道,这些医院感染事件通常与内镜清洁和消毒不彻底密切相关[1-3]。多项调查显示,我国部分医疗机构在内镜清洗消毒方面仍存在诸多问题,包括消毒合格率较低,从业人员清洗消毒知识缺乏,以及操作流程不规范等[4-7]。2006—2012年监测数据显示,超过5%的消化内镜消毒后菌落总数>9×102 CFU/条[8]。2022年对全国492所医疗机构胃肠镜微生物学监测现状调查结果显示,30.37%的医疗机构在近一年检出不合格内镜[9]。为了控制消化内镜的医院感染风险,迫切需要全面了解内镜清洗消毒工作的质量。2010—2022年,中国疾病预防控制中心(简称疾控中心)环境与健康相关产品安全所联合各省市疾控中心开展了“全国医院消毒与感染控制监测项目”,对我国30个省份184所医疗机构的消化内镜清洗消毒质量进行持续监测。本研究回顾性分析了该监测项目十余年的数据,旨在深入探讨胃肠镜清洗消毒过程中存在的问题。
1. 对象与方法
1.1 监测对象
依托“全国医院消毒与感染控制监测项目”,在北京市、天津市、河北省、山西省、辽宁省、吉林省、黑龙江省、上海市、江苏省、浙江省、安徽省、山东省、河南省、湖北省、湖南省、广东省、四川省、贵州省、云南省、甘肃省、宁夏回族自治区、新疆维吾尔自治区、青海省、重庆市、福建省、江西省、海南省、陕西省、内蒙古自治区、广西壮族自治区30个省份184所哨点医疗机构开展胃肠镜清洗消毒效果监测研究。2010—2022年在监测项目开展期间,每所哨点医疗机构至少监测1年。
1.2 监测内容
监测内容包括现场问卷调查和消毒后内镜的微生物污染水平。现场调查包括内镜清洗消毒方式和消毒剂种类等,以调查表和现场咨询的方式完成。微生物污染水平监测是对医疗机构清洗消毒后的胃镜、肠镜进行标本采集,并送实验室分析其微生物污染水平。
1.3 监测方法
由省级疾控中心工作人员每季度至医疗机构内镜室(中心)现场采样,填写医院内镜监测表,采集标本低温运送至省级疾控中心实验室检测。
1.3.1 现场采样方法
取清洗消毒后内镜立刻采样,监测部位为内镜的内腔面,采用无菌注射器抽取50 mL含相应中和剂的洗脱液,从钳口冲洗内镜管路,并全量收集,立刻送检。
1.3.2 实验室检测方法
将洗脱液充分混匀,分别用无菌吸管吸取1.0 mL洗脱液,平行接种2个无菌平皿。置于36℃±1℃温箱培养48 h,计数菌落数,即为1 mL洗脱液中的菌落总数。将剩余洗脱液在无菌条件下采用滤膜(0.45 μm)过滤浓缩,将滤膜接种于凝固的营养琼脂平板上,置36℃±1℃温箱培养48 h,计数菌落数。
1.4 结果计算和合格判定
参考GB 15982—2012《医院消毒卫生标准》,当滤膜法不可计数时,菌落总数(CFU/件)=两平行平板的菌落总数×50;当滤膜法可计数时,总菌落总数(CFU/件)=两平行平板的菌落数+滤膜上菌落数。内镜消毒后判定合格标准为:细菌总数<20 CFU/件。
1.5 数据分析
数据统计分析应用SPSS for Windows软件(V24),以P≤0.05表示差异具有统计学意义。
2. 结果
2.1 胃镜和肠镜消毒合格率及内镜自动清洗消毒机使用比例
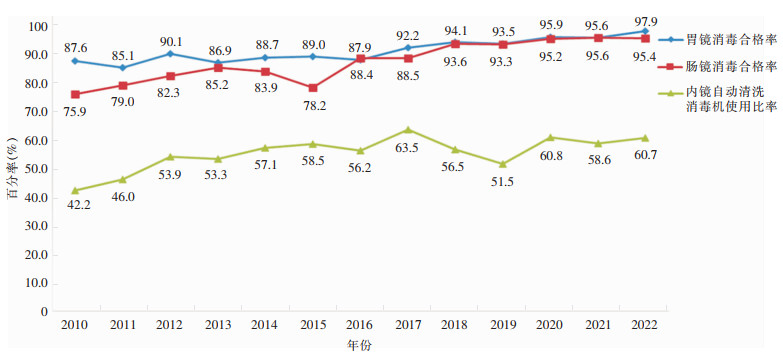
2010—2022年,监测项目从184所医疗机构采集6 421份消毒后内镜标本,包括4 011份胃镜标本,2 410份肠镜标本。2010—2022年胃镜和肠镜的微生物合格率都呈现波动上升的趋势, 胃镜的合格率从87.6%上升至97.9%,肠镜的合格率则从75.9%增至95.4%。内镜自动清洗消毒机使用比率由42.2%升至60.7%,见图 1。
2.2 不同等级医疗机构、内镜消毒剂的消毒效果
二级医疗机构共采集内镜1 557条,整体消毒合格率为87.5%。在二级医疗机构中,过氧乙酸的合格率最高(95.7%),其次为邻苯二甲醛(OPA,95.0%),酸性氧化电位水(AEOW)的合格率最低(55.0%)。三级医疗机构共采集内镜4 864条,整体消毒合格率为92.1%,高于二级医疗机构(87.5%),差异有统计学意义(P<0.001)。在三级医疗机构中,过氧乙酸的合格率最高(95.6%),其次为OPA(93.6%),AEOW的合格率最低(85.0%)。见表 1。
表 1 不同等级医疗机构内镜消毒合格率情况Table 1 Qualified rate of endoscope disinfection in medical institutions of different grades内镜消毒剂 二级医疗机构 三级医疗机构 χ2 P 监测数量 合格率(%) 监测数量 合格率(%) 戊二醛 713 83.0 1 280 90.9 26.797 <0.001 OPA 437 95.0 2 089 93.6 1.114 0.291 AEOW 40 55.0 472 85.0 23.044 <0.001 过氧乙酸 188 95.7 567 95.6 0.008 0.929 含氯消毒剂 110 84.5 412 90.5 3.251 0.071 其他消毒剂 69 88.4 44 97.7 / / 合计 1 557 87.5 4 864 92.1 28.122 <0.001 注:/表示因其他消毒剂类别包含多种消毒剂,且样本量较小,因此未进行统计分析。 2.3 5种内镜消毒剂使用比例的动态变化
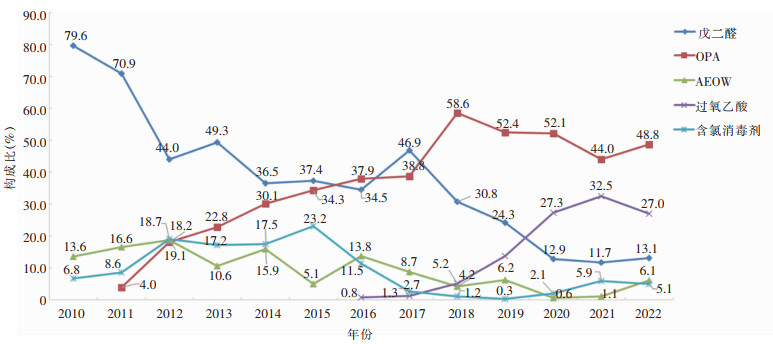
2010—2022年数据显示,戊二醛在2010年是主导的内镜消毒剂,占比达80%。此后OPA的使用比例逐渐上升,至2022年使用比率约为50%。自2016年起,过氧乙酸的使用显著增加,至2022年其使用比率接近30%。相较之下,AEOW和含氯消毒剂的使用比率较低。见图 2。
3. 讨论
本组监测研究结果表明,2010—2022年我国胃镜和肠镜的消毒合格率呈现波动上升的趋势,表明我国消化内镜的消毒质量在不断改善,但二级医疗机构消毒后胃镜和肠镜的整体合格率(87.5%)较三级医疗机构(92.1%)仍有较大差距。
我国内镜消毒质量的持续提升可能得益于多个关键因素。近年来,卫生行政部门陆续出台的GB 15982—2012《医院消毒卫生标准》、GB 30689—2014《内镜自动清洗消毒机卫生要求》、WS 507—2016《软式内镜清洗消毒技术规范》及GB/T 38497—2020《内镜消毒效果评价方法》在内的一系列卫生标准,加强了对内镜清洗消毒工作的指导和监管。这些标准的连续出台体现了我国监管部门对内镜清洗消毒工作的重视,也反映了医疗机构对内镜清洗消毒工作理解的不断深入和管理水平的持续提高。本研究的数据显示,我国内镜清洗消毒自动化程度大幅上升。内镜自动清洗消毒机的广泛应用也促进了消毒质量的提升[10-12]。
虽然我国内镜消毒合格率整体在逐步提高,但二级医疗机构和三级医疗机构之间存在差异,如戊二醛、AEOW等内镜消毒剂在三级医疗机构中的合格率高于二级医疗机构。说明除了内镜消毒剂本身外,还有其他因素影响内镜消毒的质量,比如从业人员的专业技能,医疗机构基础设施,以及质量控制制度的执行力等[13-14]。
戊二醛作为一种经典的消毒剂,因其广泛的灭菌谱、可靠的效果、较低的成本及良好的材料兼容性而广泛应用。本组监测结果显示,戊二醛作为内镜消毒剂的使用比例正在不断下降。至2022年,其使用比例已低于OPA和过氧乙酸,不过在二级医疗机构中戊二醛仍然是使用最多的内镜消毒剂。分析导致这种现象的原因:可能是戊二醛消毒剂具有明显的黏膜毒性和皮肤刺激性,限制了其在内镜手工清洗中的应用[15]。而且随着新型内镜消毒剂的不断出现,这些新型内镜消毒剂在不良反应和消毒效率上表现得更为优秀[16]。如与OPA和过氧乙酸等内镜消毒剂相比,戊二醛达到高水平消毒标准需要更长时间[17]。本研究结果显示,在二级医疗机构中,使用戊二醛的内镜消毒合格率远低于OPA和过氧乙酸,提示在二级医疗机构中,戊二醛内镜消毒剂在使用过程中可能存在某些潜在问题,如戊二醛消毒剂浓度是否进行有效的监测,戊二醛消毒剂pH值是否处于适宜范围,以及是否在保质期内使用等,需要进一步调查验证。
AEOW是一种具有低浓度有效氯、高氧化还原电位的酸性水溶液。在严格控制灭菌参数的试验条件下,AEOW表现出良好的杀菌能力[18]。然而在本研究中,AEOW在二级医疗机构和三级医疗机构中均呈现了较低的合格率。可能是由于AEOW杀菌能力在室温下会逐渐衰减,需要现产现用。此外,AEOW对有机物高度敏感,如果清洗不彻底会非常影响其消毒效果。本监测结果显示,在三级医疗机构中,AEOW的合格率低于OPA、过氧乙酸等内镜消毒剂。说明即使在严格的制度保障和高水平操作下,AEOW在实际应用中的杀菌能力仍然相对较弱,较其他内镜消毒剂表现出一定的劣势。
根据本研究的监测结果,过氧乙酸以及OPA这两种内镜消毒剂在二级医疗机构和三级医疗机构中均表现良好,而且这两种内镜消毒剂在二级医疗机构和三级医疗机构中的合格率比较,差异无统计学意义。原因可能是,过氧乙酸以及OPA两种内镜消毒剂主要用于内镜自动清洗消毒机,受人为因素影响较小,操作流程规范,保证了内镜的消毒质量[19-20]。在消毒效果及效率上,过氧乙酸以及OPA较其他内镜消毒剂也表现出较大的优势。
美国医疗器械促进协会发布的ANSI/AAMI ST91《医疗机构中软式和半硬式内窥镜的处理》要求中度危险性医疗器材需要进行高水平消毒或者灭菌,此与我国卫生标准中对胃肠镜的消毒要求一致。ANSI/AAMI ST91列举了多种用于软式内镜的高水平消毒剂,包括戊二醛、OPA、过氧乙酸等,这些内镜消毒剂也在我国医疗机构中广泛应用。需要注意的是虽然有多种消毒剂可以用于内镜的高水平消毒,但是每种内镜消毒剂都各有优点和缺点,在选择时需要注意材料相容性、毒性、使用条件和成本等因素。
本研究的结论需要考虑几个限制因素。首先,监测项目会及时将发现的问题反馈给哨点医院,帮助其改进操作流程。这种即时的反馈可能使得参与监测的医疗机构在消毒合格率上相比于未参与项目的医疗机构表现得更好。其次,二级医疗机构中AEOW内镜消毒标本量较少,可能会影响到合格率计算的准确性和可靠性。最后,对于一些较少见的内镜消毒剂,如过氧化氢,目前还未被包含在监测计划中,所以其消毒效果还需要进一步的研究与验证。
贡献声明:段弘扬负责课题设计与实施研究,王佳奇负责统计分析和论文撰写,张宝莹负责数据收集和数据分析,张琪负责文献查阅及数据收集,张流波负责设计试验和质量审查,沈瑾负责课题设计和论文指导。
利益冲突:所有作者均声明不存在利益冲突。
王佳奇为共同第一作者。
-
表 1 不同等级医疗机构内镜消毒合格率情况
Table 1 Qualified rate of endoscope disinfection in medical institutions of different grades
内镜消毒剂 二级医疗机构 三级医疗机构 χ2 P 监测数量 合格率(%) 监测数量 合格率(%) 戊二醛 713 83.0 1 280 90.9 26.797 <0.001 OPA 437 95.0 2 089 93.6 1.114 0.291 AEOW 40 55.0 472 85.0 23.044 <0.001 过氧乙酸 188 95.7 567 95.6 0.008 0.929 含氯消毒剂 110 84.5 412 90.5 3.251 0.071 其他消毒剂 69 88.4 44 97.7 / / 合计 1 557 87.5 4 864 92.1 28.122 <0.001 注:/表示因其他消毒剂类别包含多种消毒剂,且样本量较小,因此未进行统计分析。 -
[1] DiazGranados CA, Jones MY, Kongphet-Tran T, et al. Outbreak of Pseudomonas aeruginosa infection associated with contamination of a flexible bronchoscope[J]. Infect Control Hosp Epidemiol, 2009, 30(6): 550-555. doi: 10.1086/597235 [2] Kovaleva J, Peters FTM, van der Mei HC, et al. Transmission of infection by flexible gastrointestinal endoscopy and bronchoscopy[J]. Clin Microbiol Rev, 2013, 26(2): 231-254. doi: 10.1128/CMR.00085-12 [3] Weber DJ, Rutala WA. Lessons learned from outbreaks and pseudo-outbreaks associated with bronchoscopy[J]. Infect Control Hosp Epidemiol, 2012, 33(3): 230-234. doi: 10.1086/664495 [4] Muscarella LF, New York State Health Officials. Recommendations for preventing hepatitis C virus infection: analysis of a Brooklyn endoscopy clinic's outbreak[J]. Infect Control Hosp Epidemiol, 2001, 22(11): 669. doi: 10.1086/503391 [5] 班海群, 张流波. 全国39家医院内镜清洗消毒质量监测结果分析[J]. 中国卫生标准管理, 2013, 4(4): 70-75. Ban HQ, Zhang LB. Analysis of the disinfection quality of endoscope in 39 hospitals of China[J]. China Health Standard Management, 2013, 4(4): 70-75. [6] 李贤煌, 黄子怡, 张洋洋, 等. 全国492所医疗机构胃肠镜微生物学监测现况调查[J]. 中华医院感染学杂志, 2023, 33(14): 2204-2209. Li XH, Huang ZY, Zhang YY, et al. Current status of microbiological monitoring of gastroenteroscopes in 492 medical institutions of China[J]. Chinese Journal of Nosocomiology, 2023, 33(14): 2204-2209. [7] Shih HY, Wu DC, Huang WT, et al. Glutaraldehyde-induced colitis: case reports and literature review[J]. Kaohsiung J Med Sci, 2011, 27(12): 577-580. doi: 10.1016/j.kjms.2011.06.036 [8] Dubel EV, Sheprinsky PE. Comparison of effectiveness of manual and automatic processing of endoscope[J]. Medical alphabet, 2019, 1(15): 42-44. doi: 10.33667/2078-5631-2019-1-15(390)-42-44 [9] Barton AK, Roschanski N, Merle R, et al. Influence of diffe-rent cleaning, disinfection and drying methods on endoscope hygiene in equine medicine[J]. Pferdeheilkunde Equine Medicine, 2017, 33(2): 165-171. doi: 10.21836/PEM20170209 [10] 谢凌捷, 冯振华, 周林娟, 等. 绍兴市医疗机构消化内镜清洗消毒质量现状[J]. 中国消毒学杂志, 2020, 37(12): 951-952. Xie LJ, Feng ZH, Zhou LJ, et al. Current status of the quality of cleaning and disinfection of digestive endoscopes in Shao-xing medical institutions[J]. Chinese Journal of Disinfection, 2020, 37(12): 951-952. [11] 周淑玲, 刘晓惠, 王连新. 山东省德州市35家医院院感管理现状调查分析[J]. 预防医学论坛, 2022, 28(4): 277-280. Zhou SL, Liu XH, Wang LX. Investigation and analysis on status of infection management in 35 hospitals, Dezhou city, Shandong province[J]. Preventive Medicine Tribune, 2022, 28(4): 277-280. [12] 于志臻, 沈伟, 潘臣炜, 等. 医疗机构戊二醛消毒剂使用安全性研究[J]. 环境与职业医学, 2008, 25(3): 292-294. Yu ZZ, Shen W, Pan CW, et al. Investigation on safe use of glutaraldehyde in health care facilities[J]. Journal of Environmental & Occupational Medicine, 2008, 25(3): 292-294. [13] Cooke RPD, Goddard SV, Whymant-Morris A, et al. An evaluation of Cidex OPA (0.55% ortho-phthalaldehyde) as an alternative to 2% glutaraldehyde for high-level disinfection of endoscopes[J]. J Hosp Infect, 2003, 54(3): 226-231. doi: 10.1016/S0195-6701(03)00040-9 [14] Gregory AW, Schaalje GB, Smart JD, et al. The mycobactericidal efficacy of ortho-phthalaldehyde and the comparative resistances of Mycobacterium bovis, Mycobacterium terrae, and Mycobacterium chelonae[J]. Infect Control Hosp Epidemiol, 1999, 20(5): 324-330. doi: 10.1086/501625 [15] Kurahashi M, Ito T, Naka A. Spatial disinfection potential of slightly acidic electrolyzed water[J]. PLoS One, 2021, 16(7): e0253595. doi: 10.1371/journal.pone.0253595 [16] 窦斐, 张建美. 邻苯二甲醛在内镜消毒中的应用进展[J]. 中国消毒学杂志, 2022, 39(10): 792-795. Dou F, Zhang JM. Progress in the application of o-phthalaldehyde in endoscopic disinfection[J]. Chinese Journal of Disinfection, 2022, 39(10): 792-795. [17] 朱亭亭, 李涛, 张流波, 等. 一种过氧乙酸消毒剂对内镜的消毒与灭菌效果及其腐蚀性研究[J]. 中国消毒学杂志, 2020, 37(11): 805-808. Zhu TT, Li T, Zhang LB, et al. Study on the effect of peracetic acid disinfectant on disinfection and sterilization of endoscopes and its corrosiveness[J]. Chinese Journal of Disinfection, 2020, 37(11): 805-808. [18] Vizcaino-Alcaide MJ, Herruzo-Cabrera R, Fernandez-Aceñero MJ. Comparison of the disinfectant efficacy of perasafe and 2% glutaraldehyde in in vitro tests[J]. J Hosp Infect, 2003, 53(2): 124-128. doi: 10.1053/jhin.2002.1296 [19] 樊景春, 张行, 蔡玲, 等. 三种消毒剂胃镜消毒效果的Meta分析[J]. 中华消化内镜杂志, 2019, 36(8): 591-596. Fan JC, Zhang X, Cai L, et al. Comparison of disinfection effects of three disinfectants on gastroscope: a Meta analysis[J]. Chinese Journal of Digestive Endoscopy, 2019, 36(8): 591-596. [20] Karnik PP, Dave NM, Nataraj G, et al. Comparison of efficacy and cost-effectiveness of 0.55% ortho-phthalaldehyde and 2% glutaraldehyde for disinfection of laryngoscopes: a prospective pilot study[J]. Indian J Anaesth, 2017, 61(6): 490-493. doi: 10.4103/ija.IJA_22_17

 下载:
下载: