2. 延边大学附属医院消化内科, 吉林 延吉 133000;
3. 延边大学附属医院感染科, 吉林 延吉 133000;
4. 延边大学附属医院手术室, 吉林 延吉 133000
2. Department of Gastroenterology, Yanbian University Hospital, Yanji 133000, China;
3. Department of Infection, Yanbian University Hospital, Yanji 133000, China;
4. Operating Room, Yanbian University Hospital, Yanji 133000, China
肝脏结构改变和功能受损,以及系统性炎症反应和免疫功能失调,导致肝硬化患者对病原微生物和内源性毒素的清除能力下降,容易引发脓毒症[1-2]。脓毒症产生的炎症可能会进一步引起胃肠黏膜屏障功能损伤和肠道菌群失调,导致胃肠功能障碍,如此形成恶性循环[3]。因此,明确肝硬化脓毒症与胃肠功能障碍之间的关联,可为临床诊疗提供新的视角和思路。胃肠道功能障碍广泛指胃肠道功能损伤,包括动力和/或吸收障碍、黏膜完整性破坏和微生物组变化等,其临床症状表现多变,对患者生活质量影响较大[4]。急性胃肠损伤(acute gastrointestinal injury, AGI)分级是评估胃肠道功能损伤程度的重要工具[5],通过分级描述方式对患者总体消化功能进行主观评估,有助于危重患者病情评估和病程管理,但受到一定的科学性限制[6]。肠脂肪酸结合蛋白(intestinal fatty acid-binding protein, I-FABP)被视为肠上皮细胞损伤标志物[7],与全身炎症、细菌移位和临床肠道功能障碍相关[8],与肝硬化临床病程及预后存在关联[9]。在此背景下,课题组假设胃肠功能障碍可能在肝硬化脓毒症发生和发展过程中发挥重要作用,比较AGI、I-FABP对肝硬化脓毒症发生和发展的影响,探讨AGI、I-FABP与肝硬化脓毒症患者生存结局的关系。
1 对象与方法 1.1 研究对象2020年9月—2023年3月某院重症监护病房(ICU)收治的肝硬化脓毒症住院患者,回顾性分析患者临床资料。纳入标准:(1)住院成年患者;(2)肝硬化通过组织学或明确的临床和放射学检查获得证实;(3)脓毒症诊断标准符合脓毒症3.0,即感染引起的序贯性器官功能衰竭评估(sequential organ failure assessment, SOFA)评分≥2分[10]。排除标准:(1)无肝硬化病史引起的脓毒症;(2)肝内外恶性肿瘤;(3)胃肠道手术或炎症性肠病患者;(4)主要研究数据不完整。同时选择同期41例失代偿肝硬化患者作为对照组,入组条件为患者年龄、性别与病例组匹配,排除标准与病例组相似。本研究通过该院医学伦理委员会的审核和批准[(2020)伦审字(211)]。
1.2 研究设计通过查阅医院电子病历系统,记录患者的人口统计学、临床实验室结果和治疗措施,以及入院时终末期肝病模型(model of end-stage liver disease, MELD)评分和SOFA评分。AGI分级由两位内科医生回顾性分析患者住院病历评估获得。入院时采集患者血标本,离心后将上清液储存在-80℃冰箱集中检测分析。采用酶联免疫吸附测定(ELISA)试剂盒(R&D Systems, USA)检测血清I-FABP浓度,标本预先稀释2倍再定量检测,参照产品说明操作,建立标准曲线,检测范围为31.3~2 000 pg/mL,Eon酶标仪由美国Bio Tek公司提供。所有实验室结果均为该院临床实验室检测。对研究人群随访3个月,随访时间指入院诊疗至死亡或门诊/电话进行最后一次随访的时间。肝硬化患者死亡或病情恶化放弃治疗均视为不良结局。根据患者随访30天和90天生存结局,将病例组分为生存组和死亡组。
1.3 诊断和分级标准失代偿性肝硬化是指患者存在腹腔积液、黄疸、静脉曲张出血或肝性脑病。肝硬化严重程度MELD评分计算公式为:9.6×Ln(Cre mg/dL)+3.8×Ln(TBIL mg/dL)+11.2×Ln(INR)+6.4×病因(胆汁淤积性和酒精性肝硬化为0,病毒等其他原因肝硬化为1)。脓毒症严重程度SOFA评分根据呼吸(PaO2/FiO2比率)、心血管(平均动脉压和升压药剂量)、肝脏(血胆红素浓度)、凝血(血小板计数)、肾脏(血肌酐浓度/24 h尿量)和神经系统(Glasgow昏迷评分)计算[11]。胃肠功能障碍AGI分级标准[5],Ⅰ级为肠道功能暂时部分受损,但仍可进食;Ⅱ级为胃肠道无法充分消化和吸收,可能需要应用肠内营养等手段进行优化;Ⅲ级为胃肠功能明显受损,需要进行营养支持以缓解症状;Ⅳ级为胃肠道损伤已直接威胁生命,并伴有多器官功能障碍综合征和休克。
1.4 统计方法应用SPSS 26.0和GraphPad prism 8.0软件进行数据分析。呈正态分布的计量资料采用x±s表示,两组间比较采用独立样本t检验。非正态分布的计量资料采用M(P25, P75)表示,两组间比较采用Mann-Whitney U检验。计数资料采用卡方检验。两变量间相关性采用Spearman相关分析。多组间趋势性分析采用单因素ANOVA检验。多变量Cox回归分析影响患者预后的危险因素。Kaplan-Meier方法分析时间相关病死率,通过对数秩检验评估差异。采用受试者工作特征(ROC)曲线及曲线下面积(AUC)评估研究参数对生存结局的预测性能,使用MedCalc软件比较各指标的诊断性能。P≤0.05为差异有统计学意义。
2 结果 2.1 一般情况纳入符合脓毒症3.0诊断标准的成年肝硬化脓毒症患者84例,作为病例组,患者平均年龄(60.38±11.45)岁,其中男性51例,女性33例。同时选择41例失代偿期肝硬化患者作为对照组。与对照组比较,病例组患者MELD评分、AGI分级、I-FABP、降钙素原(PCT)、C反应蛋白(CRP)的水平明显升高,差异均具有统计学意义(均P<0.05)。见表 1。
| 表 1 两组患者的基线特征 Table 1 Baseline characteristics of two groups of patients |

|
Spearman相关分析显示,不同研究队列的AGI与其他参数均无明显相关性,而I-FABP与MELD、PCT呈正相关,与ALB呈负相关。此外,对照组AGI与I-FABP存在正相关趋势(r=0.279,P=0.077)。见图 1。
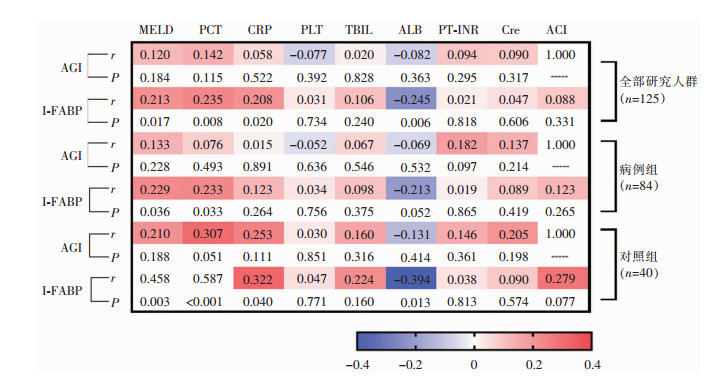 |
| 图 1 AGI评分及I-FABP与临床基线指标的关系 Figure 1 Relationship between AGI score, I-FABP, and clinical baseline indexes |
单因素ANOVA趋势性检验显示,病例组SOFA评分随AGI分级增加而升高(P=0.038),Bonferroni校正后显示,AGI 4级患者SOFA评分略高于AGI 2级和3级患者(P值分别为0.034、0.586)。此外,SOFA评分与I-FABP间呈正相关(r=0.334,P=0.002),表明胃肠道功能障碍与脓毒症严重程度相关。见图 2。
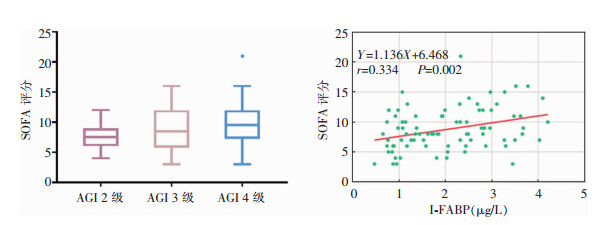 |
| 图 2 SOFA评分及与胃肠功能障碍的相关性 Figure 2 SOFA score and correlation with gastrointestinal dysfunction |
肝硬化脓毒症患者30天全因病死率为25.0%(21/84),90天病死率为35.7%(30/84),其中30天、90天死亡患者的I-FABP值均高于生存者[分别为2.73(1.37, 3.49) μg/L VS 1.83(1.05, 2.55)μg/L;2.38(1.53, 2.98)μg/L VS 1.78(0.94, 2.79)μg/L,P值分别为0.014、0.032]。组间AGI分级比较,差异均无统计学意义(P值分别为0.140、0.055)。肝硬化脓毒症患者不良预后的危险因素多因素Cox回归分析结果显示,患者年龄、I-FABP、SOFA评分与30天、90天生存结局相关(均P<0.05),MELD评分仅与30天病死率相关(P=0.044),而AGI与30天、90天生存结局均无明显关联(P值分别为0.192、0.440)。见表 2。
| 表 2 肝硬化脓毒症患者30天、90天死亡危险因素多变量Cox回归分析 Table 2 Multivariate Cox regression analysis on risk factors for 30-day and 90-day mortality in liver cirrhosis patients with sepsis |
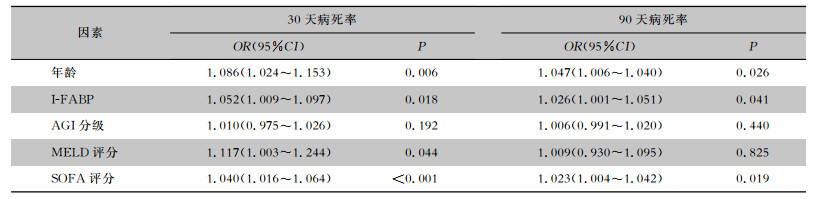
|
采用ROC曲线分析预后危险因素对生存结局的影响,结果显示SOFA评分的AUC略大于MELD评分、I-FABP,但差异无统计学意义(均P>0.05)。I-FABP联合SOFA或MELD评分对病死率预测效能明显提升(均P<0.001)。I-FABP联合SOFA对30天病死率的AUC为0.818,灵敏度为76.19%,特异度为74.60%,高于I-FABP联合MELD组合(P=0.024);但二者90天病死率的诊断效能差异无统计学意义(P=0.491)。见表 3和图 3。
| 表 3 研究参数对成年肝硬化脓毒症患者生存结局的预测性能比较 Table 3 Comparison of predictive performance of research parameters on survival outcomes in adult liver cirrhosis patients with sepsis |
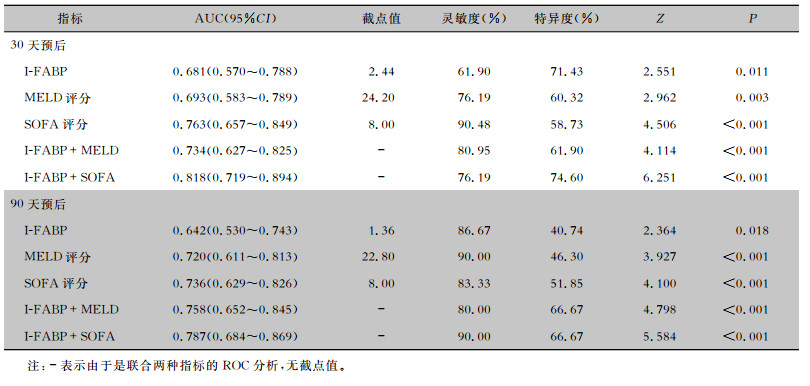
|
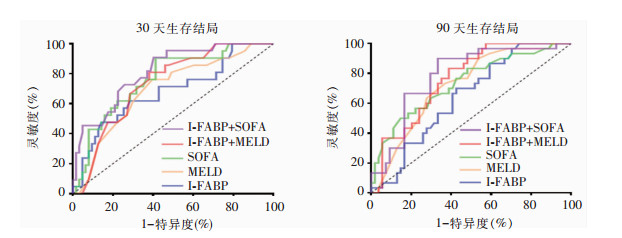 |
| 图 3 研究参数预测成年肝硬化脓毒症患者生存结局的ROC曲线 Figure 3 Research parameter-based ROC curve for predicting survival outcomes in adult liver cirrhosis patients with sepsis |
Kaplan-Meier曲线分析显示,根据I-FABP四分位数(q1≤1.10;1.10<q2≤2.01;2.01<q3≤2.83;q4>2.83)分层的肝硬化脓毒症患者30天病死率(q1:9.5%;q2:19.0%;q3:23.8%;q4:47.6%)和90天病死率(q1:23.8%;q2:33.3%;q3:33.3%;q4:52.4%),差异均有统计学意义(P值分别为0.003、0.031)。I-FABP水平较低的患者病死率较低,反之则明显升高。见图 4。
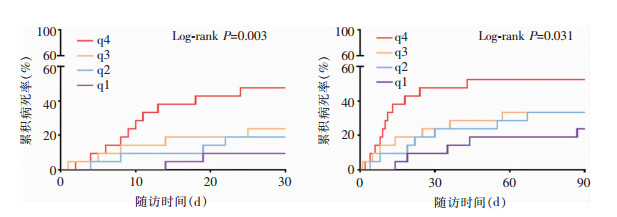 |
| 图 4 I-FABP四分位数分层患者的30天和90天累计病死率 Figure 4 30-day and 90-day cumulative mortality of patients stratified by I-FABP quartile |
肝硬化由于免疫功能失衡和肠道菌群移位等因素,感染后易发生脓毒症,导致患者预后不良,而胃肠功能障碍可能在脓毒症进程中发挥重要作用。本研究通过AGI分级和I-FABP评估胃肠道功能障碍,有4个主要发现:第一,肝硬化脓毒症患者的AGI分级和I-FABP水平高于失代偿期肝硬化患者;第二,AGI、I-FABP与脓毒症SOFA评分具有较好的相关性;第三,I-FABP升高是肝硬化脓毒症患者30天、90天死亡的独立危险因素;第四,I-FABP可以提高SOFA评分对生存结局的预测能力。
肠上皮细胞损伤或坏死时,I-FABP释放入血,其水平反映肠屏障功能受损程度[7, 9]。AGI主要通过危重患者的消化道症状或特征主观评估其损伤程度[5]。本研究结果显示,肝硬化脓毒症组患者AGI分级和I-FABP水平高于肝硬化对照组,且两组I-FABP与炎症因子均存在相关性,说明脓毒症全身炎症反应综合征(SIRS)过度损伤肝硬化患者肠黏膜完整性,与国内研究[12]结果相近。也有研究[13]显示,I-FABP与脓毒症SIRS无明显关联,分析其原因可能与本研究人群为肝硬化患者有关。I-FABP水平与肝硬化门静脉高压及病情严重程度相关[9, 14],结合本研究中AGI、I-FABP与SOFA评分相关性较高,说明SIRS与胃肠道功能障碍可能互为因果,间接支持胃肠道功能障碍在脓毒症多器官功能衰竭中发挥作用。
本研究结果显示,I-FABP是肝硬化脓毒症患者30天、90天死亡的独立危险因素,且I-FABP四分位数显示出良好的预后区分能力,表明肠上皮损伤程度与生存结局密切相关。研究[15]结果显示,AGI分级与生存结局无关。结合本研究结果分析原因,一方面是胃肠道症状的临床评估依赖于临床医生的主观评价[5],对不同严重程度的肠道功能障碍难以准确区分,特别是存在腹腔积液或肝性脑病等失代偿期并发症时,评估难度增大;另一方面I-FABP作为肠道损伤标志物反应灵敏,能客观反映病情进展。
本研究发现I-FABP可以提高SOFA评分对生存结局的预测能力,突显SOFA评分因缺乏胃肠道功能障碍评估而存在的局限性。目前,没有任何临床评分可以涵盖胃肠道所有功能,如内分泌、免疫和屏障功能等[16]。同样,SOFA评分也没有涵盖各个器官的所有功能,但SOFA评分的优势在于结合不同器官系统评估危重患者的多器官功能障碍综合征[11]。因此,本研究将反映胃肠功能的客观参数I-FABP引入器官功能评估体系中,有助于提高临床的可操作性和重复性。
综上所述,肝硬化脓毒症患者AGI程度和I-FABP水平明显升高,并与SOFA评分有较好相关性。血清I-FABP可以提高SOFA评分对生存结局的预测效能,有助于临床优化治疗方案,改善肝硬化患者预后。
作者贡献声明:韩才均负责课题设计,资料分析,撰写论文;黄媛、吴政燮、金星参与收集数据、病历分析和修改论文;金花参与随访登记和数据整理;朴美花拟定写作思路及最后定稿。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Fernández J, Prado V, Trebicka J, et al. Multidrug-resistant bacterial infections in patients with decompensated cirrhosis and with acute-on-chronic liver failure in Europe[J]. J Hepatol, 2019, 70(3): 398-411. DOI:10.1016/j.jhep.2018.10.027 |
| [2] |
贝小歌, 陈金军, 黎倍伶. 宏基因组学测序技术在肝硬化脓毒症中的应用[J]. 临床肝胆病杂志, 2021, 37(9): 2206-2209. Bei XG, Chen JJ, Li BL. Application of metagenomic next-generation sequencing in sepsis in liver cirrhosis[J]. Journal of Clinical Hepatology, 2021, 37(9): 2206-2209. |
| [3] |
Reintam Blaser A, Poeze M, Malbrain MLNG, et al. Gastrointestinal symptoms during the first week of intensive care are associated with poor outcome: a prospective multicentre study[J]. Intensive Care Med, 2013, 39(5): 899-909. DOI:10.1007/s00134-013-2831-1 |
| [4] |
Reintam Blaser A, Preiser JC, Fruhwald S, et al. Gastrointestinal dysfunction in the critically ill: a systematic scoping review and research agenda proposed by the Section of Metabolism, Endocrinology and Nutrition of the European Society of Intensive Care Medicine[J]. Crit Care, 2020, 24(1): 224. DOI:10.1186/s13054-020-02889-4 |
| [5] |
Reintam Blaser A, Malbrain MLNG, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM working group on abdominal problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [6] |
Asrani VM, Brown A, Huang W, et al. Gastrointestinal dysfunction in critical illness: a review of scoring tools[J]. JPEN J Parenter Enteral Nutr, 2020, 44(2): 182-196. DOI:10.1002/jpen.1679 |
| [7] |
Pelsers MMAL, Hermens WT, Glatz JFC. Fatty acid-binding proteins as plasma markers of tissue injury[J]. Clin Chim Acta, 2005, 352(1/2): 15-35. |
| [8] |
Piton G, Capellier G. Biomarkers of gut barrier failure in the ICU[J]. Curr Opin Crit Care, 2016, 22(2): 152-160. |
| [9] |
韩才均, 吴政燮, 黄媛, 等. 肠脂肪酸结合蛋白与肝硬化患者细菌感染和不良预后的相关性研究[J]. 中国感染控制杂志, 2023, 22(3): 315-321. Han CJ, Wu ZX, Huang Y, et al. Correlation between intestinal fatty acid-binding protein and bacterial infection as well as poor prognosis in patients with liver cirrhosis[J]. Chinese Journal of Infection Control, 2023, 22(3): 315-321. |
| [10] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [11] |
Vincent JL, Moreno R, Takala J, et al. The SOFA (sepsis-related organ failure assessment) score to describe organ dysfunction/failure. on behalf of the working group on sepsis-related problems of the European Society of Intensive Care Medicine[J]. Intensive Care Med, 1996, 22(7): 707-710. DOI:10.1007/BF01709751 |
| [12] |
朱承睿, 丁仁彧, 孙旖旎, 等. 肠脂肪酸结合蛋白与严重脓毒症患者肠道损伤的相关性研究[J]. 中华危重病急救医学, 2014, 26(6): 420-424. Zhu CR, Ding RY, Sun YN, et al. Correlation of intestinal fatty acid binding protein and intestinal injury in severe sepsis[J]. Chinese Critical Care Medicine, 2014, 26(6): 420-424. |
| [13] |
Hietbrink F, Besselink MGH, Renooij W, et al. Systemic inflammation increases intestinal permeability during experimental human endotoxemia[J]. Shock, 2009, 32(4): 374-378. DOI:10.1097/SHK.0b013e3181a2bcd6 |
| [14] |
Sandler NG, Koh C, Roque A, et al. Host response to translocated microbial products predicts outcomes of patients with HBV or HCV infection[J]. Gastroenterology, 2011, 141(4): 1220-1230.e3. DOI:10.1053/j.gastro.2011.06.063 |
| [15] |
Reintam Blaser A, Padar M, Mändul M, et al. Development of the gastrointestinal dysfunction score (GIDS) for critically ill patients-a prospective multicenter observational study (iSOFA study)[J]. Clin Nutr, 2021, 40(8): 4932-4940. DOI:10.1016/j.clnu.2021.07.015 |
| [16] |
Reintam Blaser A, Preiser JC, Fruhwald S, et al. Gastrointestinal dysfunction in the critically ill: a systematic scoping review and research agenda proposed by the Section of Metabolism, Endocrinology and Nutrition of the European Society of Intensive Care Medicine[J]. Crit Care, 2020, 24(1): 224. DOI:10.1186/s13054-020-02889-4 |



