2. 东南大学医学院, 江苏 南京 210009
2. Southeast University School of Medicine, Nanjing 210009, China
B群链球菌(group B Streptococcus, GBS),也称无乳链球菌(Streptococcus agalactiae),是一种革兰阳性β溶血性链球菌。通常定植于妇女阴道和人体肠道中,可引起人体皮肤感染、心内膜炎、产后感染、新生儿脓毒败血症和新生儿脑膜炎,因可引起侵袭性感染,临床对此应给予重视[1]。目前临床上对GBS感染的研究多数在围产期和新生儿期相关疾病,非妊娠成人群体GBS感染相关报道较少[2-3]。GBS在尿液中时有分离,导致尿路感染(urinary tract infection, UTI)的情况时有发生,临床症状也较为复杂,诊断有赖于尿培养和临床症状、体征,可根据有无UTI症状分为有症状UTI和无症状性菌尿(asymptomatic bacteriuria, ASB)。细菌所致的UTI主要为以大肠埃希菌为代表的革兰阴性菌,而对于中段尿培养中分离出GBS,其临床意义尚不明确,少见研究[4-5]报道。本研究以某院2020年2月—2022年12月中段尿中检出的GBS为研究对象,查阅患者同日尿常规结果并收集患者的临床资料进行统计学分析,旨在分析尿培养中检出GBS的意义,为GBS UTI的临床诊治提供依据。
1 材料与方法 1.1 中段尿培养和细菌计数无菌尿杯收集患者中段尿,送至实验室后用一次性10 μL定量接种环(意大利COPAN公司)取一环尿液在哥伦比亚血琼脂平板(Thermo scientific)的一半区域做“丰”字密集划线(原始区),再取10 μL尿液经1 mL灭菌生理盐水稀释后在另一半区域同样划线(计数区)。置于35℃、5% CO2培养箱(Thermo scientific)培养18~24 h,观察可疑目标菌落。若平板原始区菌落线状密集相连,且计数区菌落数>10 CFU,则判断尿培养细菌菌落数为≥105 CFU/mL;若平板原始区菌落分散计数在100~1 000 CFU且计数区在1~10 CFU,则判断尿培养细菌菌落数为104~105 CFU/mL;若平板原始区菌落散在<100 CFU,则判断尿培养细菌菌落数为≤104 CFU/mL。若出现3种或以上细菌生长,提示可疑污染。
1.2 菌株鉴定及药物敏感试验对血平板上生长的可疑菌落,使用VITEK 2 Compact全自动鉴定仪配套GP鉴定卡(法国生物梅里埃公司)进行生化鉴定,同时使用VITEK MS及配套试剂(法国生物梅里埃公司)进行质谱确定。药物敏感试验采用P639药敏卡进行最低抑菌浓度(MIC)测定。测试的抗菌药物包括青霉素、氨苄西林、左氧氟沙星、莫西沙星、克林霉素、四环素、替加环素、万古霉素、利奈唑胺和呋喃妥因,质控菌株为肺炎链球菌ATCC 49619。结果的判读和解释依据美国临床实验室标准化协会(CLSI)M100 S30文件[6]。
1.3 尿常规检测采用尿干化学分析仪UC-3500和尿流式沉渣分析仪UF-5000 (日本SYSMEX公司)及其原装配套试剂测定。尿红细胞、白细胞>16个/μL则为阳性。项目每日质控均在控。
1.4 临床资料的收集通过实验室信息系统搜索2020年2月—2022年12月南京某医院住院和门诊患者中段尿培养分离出GBS的菌株信息,通过医院病历系统查阅患者入院记录、现病史、出院诊断等信息。纳入标准为患者同日送检中段尿培养和尿常规,病例资料完整可靠,剔除临床资料欠完整病例和同一患者重复送检标本。收集尿常规和细菌药敏试验结果。有症状UTI指有尿路刺激征,即尿频、尿急、尿痛或其中之一的表现,伴或不伴发热、下腹部疼痛、腰痛等症状;ASB指无上述表现及症状[7]。
1.5 统计学方法应用SPSS 22.0统计软件对数据进行统计分析,计量资料均以x±s表示,率的比较采用卡方检验,P≤0.05为差异具有统计学意义。
2 结果 2.1 一般情况2020年2月—2022年12月该院尿标本共检出非重复细菌9 081株。居前3位的细菌分别为大肠埃希菌(3 082株,33.9%)、粪肠球菌(907株,10.0%)和肺炎克雷伯菌(720株,7.9%)。共分离GBS 425株,占4.7%,位列第6。剔除60株临床资料不完整和尿常规非同日标本,共纳入365株进行分析。365例中段尿分离出GBS的患者中,男性169例(46.3%),女性196例(53.7%),男女性别比1 ∶1.16;年龄14~93岁,平均年龄(55.4±15.2)岁,其中男性(58.1±13.8)岁,女性(53.0±15.9)岁。
2.2 GBS分离患者的临床特征365例中段尿分离GBS患者中,男性有症状UTI低于女性(19.5% VS 29.6%;χ2=4.912,P=0.027),见表 1。患者来源于17个科室,居前5位的科室依次为泌尿外科(237例,64.9%)、肾内科(39例,10.7%)、内分泌科(14例,3.8%)、风湿免疫科(14例,3.8%)和感染病科(12例,3.3%),其基础疾病包括高血压病136例,糖尿病95例,泌尿系统结石120例,泌尿系统肿瘤98例。9例患者妊娠中晚期尿液中检出GBS,211例患者接受泌尿系统手术,术前均使用抗菌药物,205例在术后留置导尿管。
| 表 1 不同性别GBS UTI患者症状发生情况 Table 1 Development of symptoms in GBS UTI patients of different genders |

|
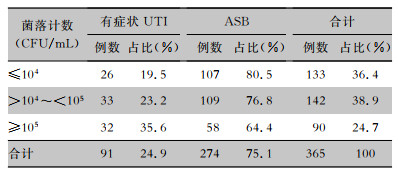
尿培养GBS菌落计数≤104 CFU/mL的患者占36.4%,104~105 CFU/mL者占38.9%,≥105 CFU/mL者占24.7%。不同水平菌落计数的ASB患者占比高于有症状UTI患者(χ2=7.704,P=0.021)。有症状UTI患者占24.9%,随着中段尿培养GBS菌落计数的增加,有症状UTI患者比例呈升高趋势(χ2=6.836,P=0.009)。见表 2。
| 表 2 不同尿培养GBS菌落计数患者UTI临床症状发生情况 Table 2 Development of UTI clinical symptoms in patients with different GBS colony counts in urine culture |
|
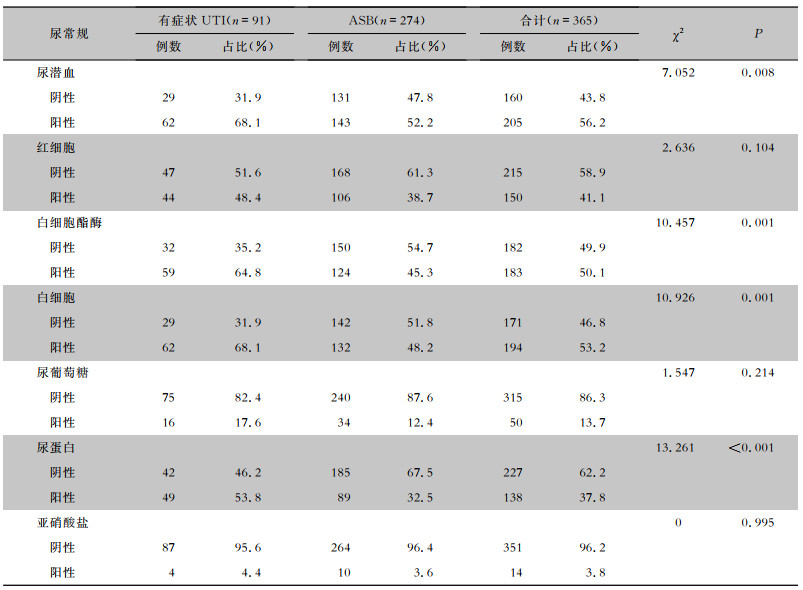
365例尿培养分离GBS患者,尿培养送检当日尿常规干化学法潜血、白细胞酯酶、尿蛋白和亚硝酸盐阳性分别占56.2%、50.1%、37.8%、3.8%,尿沉渣红细胞和白细胞阳性分别占41.1%、53.2%。有症状UTI患者中尿潜血、白细胞酯酶、白细胞及尿蛋白阳性率均高于ASB(均P<0.05)。见表 3。
| 表 3 365例尿培养分离GBS患者尿培养送检当日尿常规检测结果 Table 3 Urine routine test results on the day of urine culture of 365 patients who were isolated GBS from urine |
|
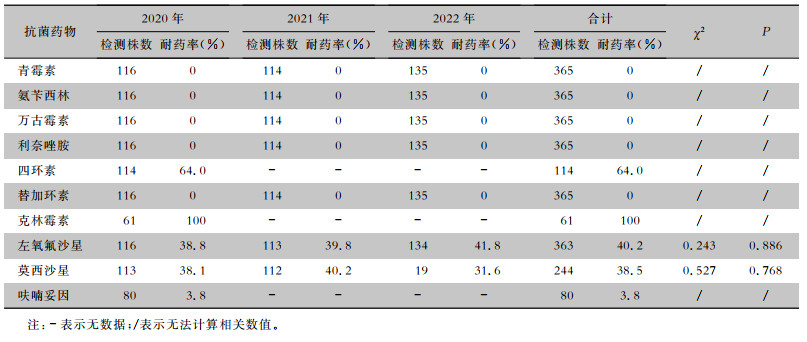
365株GBS对抗菌药物的敏感试验结果显示,未检出对青霉素、氨苄西林、万古霉素、利奈唑胺、替加环素耐药的菌株;GBS对左氧氟沙星、莫西沙星的耐药率在40%左右,对四环素、克林霉素的耐药率>60%。各年度GBS对抗菌药物的耐药率比较,差异无统计学意义(P>0.05)。见表 4。
| 表 4 2020—2022年尿培养分离的GBS对抗菌药物耐药情况 Table 4 Antimicrobial resistance of GBS isolated from urine culture from 2020 to 2022 |
|
UTI是最常见的感染性疾病之一,中段尿培养为UTI提供了直接病原学诊断依据。GBS Lancefield血清分型为B群,是一种人畜水产共患病原体。在哥伦比亚血琼脂平板上,GBS菌落较其他链球菌大,呈灰白半透明,周围有狭窄β溶血现象,CAMP试验阳性,有较高的辨识度。该院近三年尿培养分离病原菌主要为大肠埃希菌、粪肠球菌、肺炎克雷伯菌、屎肠球菌、奇异变形杆菌,与国内其他文献[8-9]报道的尿路中常见细菌一致。本研究中段尿标本分离的GBS占比4.7%,不同地区不同医院报道的分离比例略有差异[10]。既往GBS更多地在围产期妇女和新生儿中被关注,本研究发现中段尿分离出GBS的患者中男性占比46.3%,年龄多集中在中老年。GBS在非妊娠成人群体中的检出,包括在血液中的检出,以及其引起的侵袭性感染,逐渐受到重视。
本研究中通过临床病例资料挖掘,尿标本中分离出GBS的人群多数患有糖尿病,高血压等慢性基础疾病,其中糖尿病是发生UTI的一项重要危险因素。64.9%的患者是在泌尿外科入院后,常规术前检查中从尿标本分离GBS,这些患者通常存在泌尿道解剖或功能的异常,如结石、肿瘤、狭窄、前列腺炎或神经源性膀胱,这些可能会引起尿潴留,从而降低尿路及生殖道上皮防御细菌入侵的能力。另外,长期留置导尿管,也会增加UTI的风险[11]。
相较于男性,由于女性特殊的生理结构,更容易发生有症状性UTI。本研究发现,女性中有29.6%的患者为症状性UTI,而成年男性则很少发生UTI。本研究中仅24.9%的患者表现为有症状性UTI,其中包括下尿路排尿相关症状(尿频、尿急、尿痛),亦包括上UTI的全身症状(如发热、寒战、腰痛、恶心、呕吐等),且随着中段尿培养细菌计数菌落数的增加,有UTI症状的患者比例也增加,中段尿培养细菌菌落数量对UTI症状存在正性影响。而75.1%的患者表现为ASB,表明GBS在这部分人群尿路中可能只是处于短暂地或持续地定植,而不表现出感染征象,可能与尿液的收集方式有关。本研究主要为自然排尿收集中段尿,可能会受到尿道口周围菌群影响。因此,在观察培养基上细菌生长情况时,应注意菌落纯度与计数,此对培养结果的临床解读有着重要意义。是否出现症状性UTI与GBS和宿主间相互作用有关,涉及到宿主细胞内信号分子传递,宿主免疫应答调控和炎症因子的释放等,UTI的易感性与宿主基因有关。也有证据[12]显示雌激素水平降低也是绝经后女性易发生UTI的因素。GBS的主要致病因子有荚膜多糖、CAMP因子、Alp蛋白家族、溶血素、Sip蛋白和FbsA蛋白[13-14],其中荚膜多糖、Sip蛋白与GBS在尿路上皮的黏附和定植关系密切。ASB常见的细菌为大肠埃希菌,而GBS导致的ASB亦比较常见,值得关注[15]。对于孕期女性和一些需要进行侵入性泌尿外科手术的患者,需要进行GBS筛查,并给予治疗。孕期尿液筛查出GBS具有重要的临床意义,在泌尿外科手术前进行抗菌药物治疗干预是必要的。除此,一般对于ASB不需要进行GBS筛查和治疗[16]。
分析365例中段尿分离出GBS的患者尿常规结果发现,有症状UTI中64.8%的尿白细胞酯酶阳性,68.1%的尿白细胞阳性。尿中白细胞是判断UTI的重要指标,但需要注意的是有三成以上的尿常规未出现白细胞。尿中出现白细胞,而没有菌尿,也需要注意评估是否存在结核病、结石、移植排异或肿瘤的可能性。尿潜血和尿蛋白在诊断UTI中也有一定价值。糖尿病患者尿液的高糖环境易引起菌群繁殖,加重机体氧化应激,更容易发生UTI[17]。本研究中仅3.8%的患者尿液亚硝酸盐阳性,主要是因为革兰阳性菌包括GBS,一般不具有硝酸盐还原酶。尿常规可对UTI做出快速初步判断,但存在局限性,容易出现假阳性和漏诊,规范诊治需要中段尿细菌培养。
随着临床上抗菌药物的广泛应用,对尿液中分离的GBS进行药物敏感性分析尤为重要,研究中发现GBS对克林霉素、四环素的耐药率较高,与国内外研究[18-19]一致,不建议临床选择这两种抗生素用于GBS感染的治疗,且克林霉素在尿液中浓度低,通常不宜作为泌尿系统感染的治疗[20]。近三年该院分离的GBS对左氧氟沙星和莫西沙星的耐药率都在40%左右,可能与氟喹诺酮类抗菌药物在UTI中使用频率高有关,其主要耐药机制为DNA解旋酶和拓扑异构酶基因Ⅳ存在突变[21]。另外莫西沙星在尿液中浓度低,药品说明书适应证不包括UTI,超适应证使用没有效果优势,临床应在药敏报告指导下使用左氧氟沙星[22]。本研究未发现GBS对青霉素和氨苄西林耐药,对于GBS引起的感染青霉素和氨苄西林仍然是首选治疗药物。GBS对青霉素敏感也可以预测对头孢唑林、头孢噻肟、头孢吡肟和碳青霉烯类敏感,对于这些抗生素无需进行药敏试验[6]。虽然GBS对万古霉素、利奈唑胺高度敏感,但一般不作为GBS感染治疗的首选药物。替加环素尿液浓度低,且不良反应较多,一般也不用于UTI的治疗[23]。
本研究也存在一些不足,如未对GBS的血清型进行分析。研究[24-25]表明,GBS血清型Ⅴ与UTI的相关性高于其他血清型。本研究忽略了少部分患者使用了抗菌药物,未能持续跟踪GBS在中段尿中的检出情况。
本研究发现,尿液中GBS在非妊娠成人中检出较常见。从实验室角度分析发现,尿液中分离出GBS的患者多数为ASB,但不应忽视其潜在致病性,GBS在特定人群中检出有重要意义。应重视实验室分析前质量控制,尿培养应在抗菌药物使用之前留取中段尿,并做好尿道口周围的清洁消毒,避免定植菌的带入。尿培养结果判读应结合尿常规及患者的临床症状、体征综合考虑,临床应正确区分尿培养阳性与UTI,积极送检特定标本进行细菌培养,以避免抗菌药物的不合理应用。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Armistead B, Oler E, Adams Waldorf K, et al. The double life of group B Streptococcus: asymptomatic colonizer and potent pathogen[J]. J Mol Biol, 2019, 431(16): 2914-2931. DOI:10.1016/j.jmb.2019.01.035 |
| [2] |
Furfaro LL, Chang BJ, Payne MS. Perinatal Streptococcus agalactiae epidemiology and surveillance targets[J]. Clin Microbiol Rev, 2018, 31(4): e00049-18. |
| [3] |
Rosa-Fraile M, Alós JI. Group B Streptococcus neonatal infections, the ongoing history[J]. Enferm Infecc Microbiol Clin (Engl Ed), 2022, 40(7): 349-352. DOI:10.1016/j.eimc.2022.01.002 |
| [4] |
Mongilardi N, Wilson BM, Bej TA, et al. Group B Streptococcus in the urine in nonpregnant adults: disease or distraction?[J]. Antimicrob Steward Healthc Epidemiol, 2022, 2(1): e131. DOI:10.1017/ash.2022.236 |
| [5] |
Swain B, Rakshit A, Sahu KK, et al. Group B Streptococcus: an unusual cause for urinary tract infection[J]. J Clin Diagn Res, 2017, 11(8): DL05-DL06. |
| [6] |
Clinical and Laboratory Standards Institute. Performance stan-dards for antimicrobial susceptibility testing: M100-S30th edition[S]. Wayne, PA, USA: CLSI, 2020.
|
| [7] |
王辰, 王建安. 内科学[M]. 3版. 北京: 人民卫生出版社, 2015: 664-664. Wang C, Wang JA. Medicine[M]. 3rd ed. Beijing: People's Medical Publishing House, 2015: 664-672. |
| [8] |
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年尿标本细菌耐药监测报告[J]. 中国感染控制杂志, 2021, 20(1): 52-59. China Antimicrobial Resistance Surveillance System. Antimicrobial resistance of bacteria from urine specimens: survei-llance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(1): 52-59. |
| [9] |
王德成, 管仲莹. 辽宁省2017年至2021年尿培养主要病原菌分布及临床意义[J]. 微生物学杂志, 2022, 42(5): 81-87. Wang DC, Guan ZY. Distribution of main pathogens in urine culture in Liaoning Province during 2017-2021 and clinical significance[J]. Journal of Microbiology, 2022, 42(5): 81-87. |
| [10] |
赵梅, 杨丹, 贾伟, 等. 2018—2020年多中心尿标本分离菌分布及耐药性分析[J]. 中国抗生素杂志, 2021, 46(11): 1008-1013. Zhao M, Yang D, Jia W, et al. Bacterial distribution and drug resistance of bacteria from urine specimens in a multicenter from 2018 to 2020[J]. Chinese Journal of Antibiotics, 2021, 46(11): 1008-1013. DOI:10.3969/j.issn.1001-8689.2021.11.004 |
| [11] |
Shuman EK, Chenoweth CE. Urinary catheter-associated infections[J]. Infect Dis Clin North Am, 2018, 32(4): 885-897. DOI:10.1016/j.idc.2018.07.002 |
| [12] |
Lüthje P, Hirschberg AL, Brauner A. Estrogenic action on innate defense mechanisms in the urinary tract[J]. Maturitas, 2014, 77(1): 32-36. DOI:10.1016/j.maturitas.2013.10.018 |
| [13] |
Toniolo C, Balducci E, Romano MR, et al. Streptococcus agalactiae capsule polymer length and attachment is determined by the proteins CpsABCD[J]. J Biol Chem, 2015, 290(15): 9521-9532. DOI:10.1074/jbc.M114.631499 |
| [14] |
Dobrut A, Brzychczy-Włoch M. Immunogenic proteins of group B streptococcus-potential antigens in immunodiagnostic assay for GBS detection[J]. Pathogens, 2021, 11(1): 43. DOI:10.3390/pathogens11010043 |
| [15] |
Luu T, Albarillo FS. Asymptomatic bacteriuria: prevalence, diagnosis, management, and current antimicrobial stewardship implementations[J]. Am J Med, 2022, 135(8): e236-e244. DOI:10.1016/j.amjmed.2022.03.015 |
| [16] |
Nicolle LE, Gupta K, Bradley SF, et al. Clinical practice guideline for the management of asymptomatic bacteriuria: 2019 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2019, 68(10): e83-e110. |
| [17] |
Gul M, Kurutas E, Ciragil P, et al. Urinary tract infection aggravates oxidative stress in diabetic patients[J]. Tohoku J Exp Med, 2005, 206(1): 1-6. DOI:10.1620/tjem.206.1 |
| [18] |
彭捷, 黄荣富, 钟文, 等. 围产期孕妇泌尿生殖道无乳链球菌的感染与耐药性分析[J]. 中华医院感染学杂志, 2017, 27(8): 1841-1844. Peng J, Huang RF, Zhong W, et al. Infection situation and drug resistance of group B Streptococcus in urogenital tract of pregnant women[J]. Chinese Journal of Nosocomiology, 2017, 27(8): 1841-1844. |
| [19] |
do Nascimento CS, Dos Santos NFB, Ferreira RCC, et al. Streptococcus agalactiae in pregnant women in Brazil: prevalence, serotypes, and antibiotic resistance[J]. Braz J Micro-biol, 2019, 50(4): 943-952. DOI:10.1007/s42770-019-00129-8 |
| [20] |
Guay D. Update on clindamycin in the management of bacte-rial, fungal and protozoal infections[J]. Expert Opin Pharmacother, 2007, 8(14): 2401-2444. DOI:10.1517/14656566.8.14.2401 |
| [21] |
Wehbeh W, Rojas-Diaz R, Li XY, et al. Fluoroquinolone-resistant Streptococcus agalactiae: epidemiology and mechanism of resistance[J]. Antimicrob Agents Chemother, 2005, 49(6): 2495-2497. DOI:10.1128/AAC.49.6.2495-2497.2005 |
| [22] |
李婷婷, 孙吉, 李慧. 3种喹诺酮类药治疗尿路感染效果的Meta分析[J]. 中国现代医学杂志, 2018, 28(33): 76-82. Li TT, Sun J, Li H. Efficacy of three Quinolone antimicrobial agents in treatment of urinary tract infection: a Meta-analysis of randomized controlled trials[J]. China Journal of Modern Medicine, 2018, 28(33): 76-82. |
| [23] |
Yaghoubi S, Zekiy AO, Krutova M, et al. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: narrative review[J]. Eur J Clin Microbiol Infect Dis, 2022, 41(7): 1003-1022. |
| [24] |
Paveenkittiporn W, Ungcharoen R, Kerdsin A. Streptococcus agalactiae infections and clinical relevance in adults, Thailand[J]. Diagn Microbiol Infect Dis, 2020, 97(1): 115005. DOI:10.1016/j.diagmicrobio.2020.115005 |
| [25] |
Ulett KB, Benjamin WH Jr, Zhuo FL, et al. Diversity of group B Streptococcus serotypes causing urinary tract infection in adults[J]. J Clin Microbiol, 2009, 47(7): 2055-2060. |



