“非典型肺炎”一词适用于由肺炎支原体、军团菌和肺炎衣原体引起的肺炎,一些学者主张其他新出现的能够引起非典型肺炎的病原体也应列入[1]。衣原体(Chlamydia spp.)是一种严格胞内寄生的革兰染色阴性的原核细胞微生物。流产衣原体是衣原体科的一种人畜共患病原体,已被报道可感染多种动物,包括山羊、绵羊、牦牛、猪、马、兔、豚鼠、老鼠和养殖的毛皮动物[2-8]。此外,流产衣原体也能引起人类流产[9-10]、死产、妊娠败血症[11-13]和盆腔炎症性疾病。然而,至今全球仅报告6例与流产衣原体相关的肺炎个案[11, 14-18],其中2例来自国内学者[16, 18]。故本研究对一所医院收治的4例由流产衣原体引起的非典型重症肺炎患者的临床特点进行回顾性分析,全面探讨该疾病的临床特征、诊治要点及注意事项。此为国内第一次报告多例由流产衣原体引起的非典型重症肺炎。
1 对象与方法 1.1 研究对象对2021年1月—2022年11月福建医科大学附属泉州第一医院重症医学科收治并诊断为流产衣原体非典型重症肺炎的4例患者进行回顾性分析。所有数据在分析前均为匿名数据。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 研究方法 1.2.1 基本资料收集患者的性别、年龄、临床表现、动物接触史、基础疾病、治疗用药、并发症、转归等基本临床资料。
1.2.2 检验与影像入院后执行静脉采血程序标准采集患者血标本;检测血常规采用全血细胞分析仪(日本希森美康公司),检测血生化采用生化分析仪(美国BCs公司)进行分析,血气分析使用美国Werfen公司全自动血气分析仪(GEM3000),检测C反应蛋白(CRP)使用普门特定蛋白分析仪,检测降钙素原(PCT)采用全自动免疫荧光分析法(法国梅里埃公司VIDAS),检测白介素6(IL-6)使用cobas8000e801免疫分析仪(德国罗氏公司)。严格依据临床规范留取上呼吸道标本;检测流感病毒核酸采用PCR毛细电泳片段分析法(宁波海尔施),检测新型冠状病毒(SARS-CoV-2)核酸采用新型冠状病毒肺炎(COVID -19)RT-PCR Detection Kit(上海复兴)核酸扩增检测法。严格依据临床规范留取痰及支气管肺泡灌洗液(BALF)标本;痰或BALF细菌培养采用Phoenix100全自动微生物鉴定药敏分析仪和配套试剂(美国BD公司)。胸部CT采用GE Optima CT660功能型高清128层CT(美国GE公司)进行影像扫描。
1.2.3 宏基因组二代测序(mNGS)收集4例患者BALF标本以及1例患者外周血标本进行mNGS检测(上海宝腾生物医药科技股份有限公司)。具体测序方法:(1)DNA提取。使用HostZEROTM Microbial DNA Kit试剂盒(D4310,ZYMO RESEARCH)提取DNA。(2)文库构建和测序。使用KAPA HyperPlus Library Preparation Kit试剂盒(KK8514,KAPA),按照操作说明构建文库;使用Agilent 2100 Bioanalyzar对文库插入片段的长度进行质控分析,应用Qubit dsDNA HS Assay Kit (Thermo Fisher Scientific Inc.)质控文库浓度;测序使用NextSeq CN500平台。通过分析去除低质量和长度<35 bp的序列进行生物信息分析;然后对比计算减去人类参考基因组使用Burrows-Wheeler,去除的低复杂度的序列的数据同时对比到病毒、细菌、真菌和寄生虫4个微生物基因组数据进行分类,生成高质量的测序数据。下载自国家生物技术信息中心数据分类参考(ftp://ftp.ncbi.nlm.nih.gov/genomes/)。
2 结果 2.1 基本资料4例流产衣原体非典型重症肺炎患者均为男性,急性起病,均表现为发热(体温高峰39.0~39.8℃),咳嗽、咳痰且痰量不多。3例患者有家禽接触史,1例有流产羊接触史,见表 1。4例患者年龄为63~73岁,均为老年患者,从有临床症状到出现急性呼吸衰竭的间隔时长为1~6 d;病例1、4是以神经系统为首发表现收治于神经专科,出现呼吸衰竭后转入重症监护病房(ICU),病例2、3收住呼吸内科普通病房后短期内出现呼吸衰竭转入ICU;4例患者肺部听诊均有呼吸急促,病肺呼吸音减低,有少许湿性啰音。4例患者病情均危重,在氧流量5 L/min吸氧下血氧饱和度(SPO2)明显下降(<88%),入院时氧合指数(PaO2/FiO2)均<200 mmHg,随病情发展呈进行性下降,需积极呼吸机支持,入住ICU第1天急性生理和慢性健康评分Ⅱ(APACHE Ⅱ)为16~25分,序贯器官衰竭评分(SOFA)为4~11分,见表 2。
| 表 1 4例患者基本信息及临床表现 Table 1 Basic information and clinical manifestations of 4 patients |
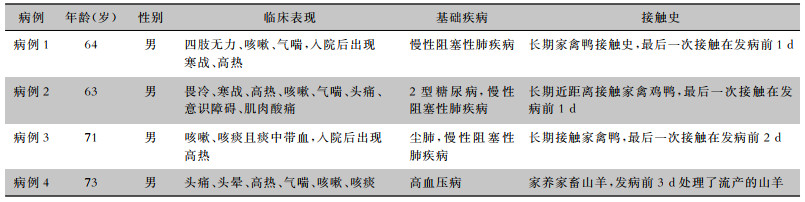
|
| 表 2 4例患者入住ICU第1~3天临床相关指标结果 Table 2 Clinical related indicators of 4 patients from day 1 to day 3 of admitting to the ICU |
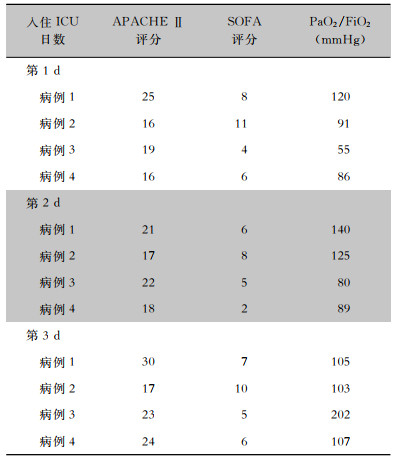
|
2例患者白细胞计数(WBC)升高,4例患者中性粒细胞百分比(NEUT%)均升高,3例患者血小板计数(PLT)轻度降低;4例患者出现天冬氨酸转氨酶(AST)升高,2例患者丙氨酸转氨酶(ALT)升高,3例患者肌酸激酶升高,2例患者出现轻度低钠血症,4例患者均出现不同程度血清肌酐上升;4例患者CRP、PCT、IL-6明显升高;4例患者胸部CT表现以单个或多个肺叶累及为主,渗出实变,可伴有少许胸腔积液,其中病例1的肺部病变快速进展,短期内累及多个肺叶。见表 3、图 1。
| 表 3 4例患者实验室及影像学检查 Table 3 Laboratory and imaging examinations of 4 patients |
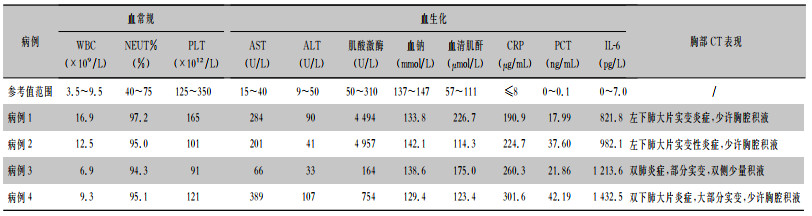
|
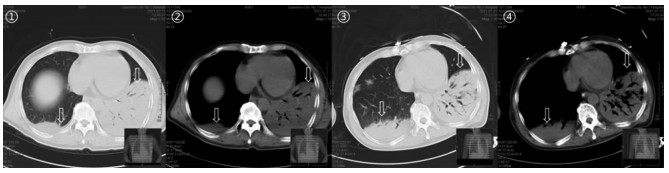 |
| 注:①②为病例1入院第1天胸部CT情况;③④为病例1入院第5天胸部CT情况;病例1病变累及双肺,以左肺为著,大片实变(如箭头所指),累及胸膜可见胸腔积液,入院后病变仍进展,以右肺进展为著(③④较①②进展)。 图 1 病例1胸部CT肺部病变进展情况 Figure 1 Progress of lung lesions on chest CT in case 1 |
4例患者BALF mNGS均检出不同序列数的其他病原体,见表 4;病例2的外周血mNGS检测出流产衣原体(74个序列数)和鹦鹉热衣原体(7个序列数)。4例患者上呼吸道标本流感病毒、SARS-CoV-2核酸检测均为阴性。4例患者痰或BALF标本一般细菌培养均为阴性。
| 表 4 4例患者BALF mNGS检测结果 Table 4 BALF mNGS detection results of 4 patients |
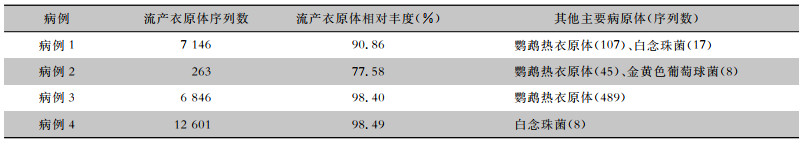
|
结合患者的临床表现、接触史、胸部CT、mNGS等结果,诊断为流产衣原体导致的非典型重症肺炎,治疗调整以多西环素为基础的抗感染治疗方案后,4例患者体温逐渐降至正常,PaO2/FiO2改善,复查胸部CT肺部炎性病变消散吸收,好转出院。见表 5。
| 表 5 4例流产衣原体非典型重症肺炎患者的治疗与转归 Table 5 Treatment and outcomes of 4 patients with C. abortus. atypical severe pneumonia |

|
衣原体门包括1个衣原体纲(Chlamydia),1个衣原体目(Chlamydiales);衣原体目下设8个科,其中衣原体科(Chlamydiaceae)是引起人和动物患病的相关衣原体种,目前总共有14个衣原体种,包括沙眼衣原体(C.trachomatis)、流产衣原体(C. abortus)、肺炎衣原体(C. pneumoniae)、鹦鹉热衣原体(C. psittaci)、猪衣原体(C. suis)、豚鼠衣原体(C. muridarum)、猫衣原体(C. felis)、家畜衣原体(C. pecorum)、豚鼠衣原体(C. caviae)、鸟衣原体(C. avium)、家禽衣原体(C. gallinacea)、变温衣原体(C. poikilothermis)、蛇衣原体(C. serpentis)和伪鸮衣原体(C. buteonis),还有4种候选种,包括朱鹭衣原体(C. ibidis)、美洲树蚺(C. corallus)、马岛蚺衣原体(C. sanzinia)和龟衣原体(C. testudinis)[19]。衣原体广泛分布于世界各地,流产衣原体是其中的一种[20],可引起人类和动物的各种疾病。
流产衣原体感染通常见于孕妇[11, 15, 17],开始时为流感样疾病,然后发展为血小板减少和凝血功能障碍,通常导致胎儿死亡。流产衣原体通过患病动物的尿、粪便、乳汁、羊水、胎盘、流产胎儿等途径排出体外。既往报道[14-15]直接接触流产衣原体可引起人类感染,也有病例报告[11, 17]描述居住或到过受地方性流产影响的农场或附近间接接触流产衣原体而引起的人类感染,这表明临床医生应特别注意与受感染畜群动物有过直接或间接接触的人群。目前,根据文献[11, 14],流产衣原体感染主要采用聚合酶链式反应(PCR)诊断,而本病例报告中通过BALF mNGS明确流产衣原体感染,且1例患者外周血mNGS也同时检出流产衣原体。NGS,又称高通量测序,可对标本中所有核酸进行测序[21-22],NGS具有检测速度快、精度高、成本低、覆盖范围广等特点[23]。理论上可以检测临床标本的所有病原体,尤其适用于非典型、罕见、新型病原体。2014年Wilson等在儿童脑脊液标本中应用NGS检测钩端螺旋体,这是NGS首次应用于传染病诊断[24]。mNGS的出现使我们发现病原体能力得到了提升,特别是鉴定新发病原体,Miao等[25]关于mNGS检测传染病病原体的回顾性研究中报道了mNGS的灵敏度和特异度分别为50.7%、85.7%,明显高于传统的检测方法,特别是在检测结核分枝杆菌、病毒、真菌和厌氧细菌,此外,mNGS的结果几乎不受既往使用抗菌药物的影响。仅通过血清学分析或细菌学技术可能漏诊流产衣原体,有报道对福尔马林固定石蜡包埋的胎盘材料进行mNGS,可检测出流产衣原体,所以mNGS的应用在某种程度上对疾病诊断非常有帮助。
流产衣原体虽然是人类肺炎罕见的病原体,但在全身感染后可引起严重的并发症,值得临床医生重视[26]。本次病例报告中,患者均高龄且具有基础疾病,流产衣原体感染后出现肺炎到呼吸衰竭、急性肾损伤等症状,临床医生应尽快识别并积极干预。本病例报告中有3例患者检出少量鹦鹉热衣原体,考虑与流产衣原体和鹦鹉热衣原体物种具有相似特征有关[19]。衣原体感染也容易合并其他病原体感染,继发呼吸衰竭后气管插管机械通气也容易并发呼吸机相关肺炎,故本病例选择以多西环素为基础的联合抗感染方案,经治疗后患者临床症状及炎症指标、呼吸衰竭、急性肾损伤和休克得到改善,4例患者最终都好转出院。
自2019年以来,由SARS-CoV-2引起的人类肺炎,使我们在临床疾病诊疗上不堪重负,而包括人畜共患细菌在内的其他病原体也可能导致人类肺炎发生,需要在临床上进行鉴别诊断。目前,我国已进入新型冠状病毒感染常态化,当患者SARS-CoV-2检测阴性,且既往有禽类及动物接触史时,此类接触史可以追溯到养殖畜牧业或宠物饲养,在临床病史评估期间详细了解与哺乳动物、鸟类和爬行动物接触的情况。
总之,在临床上加强对此类人畜共患疾病的认识和监测是非常有必要的,本次病例报告4例患者的流产衣原体非典型肺炎均非常严重,不及时正确诊疗可能导致不良临床结局。mNGS可以识别流产衣原体,缩短流产衣原体非典型肺炎的诊断时间,为抢救危重症患者争取时间,从而改善了患者预后。
本研究具有一定的局限性。首先,本次研究为单中心的回顾性研究,可能存在一定的偏倚。第二,本研究有3例(75.0%)患者检出少量序列数的鹦鹉热衣原体,尤其是病例2的BALF标本及外周血标本均有检出,不能排除存在混合感染的可能。第三,本研究样本量非常小,不能全面阐述流产衣原体非典型重症肺炎的全部特点。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Marrie TJ, Costain N, La Scola B, et al. The role of atypical pathogens in community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2012, 33(3): 244-256. DOI:10.1055/s-0032-1315636 |
| [2] |
Li ZC, Cao XA, Fu BQ, et al. Identification and characterization of Chlamydia abortus isolates from yaks in Qinghai, China[J]. Biomed Res Int, 2015, 2015: 658519. |
| [3] |
Li ZC, Liu P, Cao XA, et al. First report of Chlamydia abortus in farmed fur animals[J]. Biomed Res Int, 2018, 2018: 4289648. |
| [4] |
Campos-Hernández E, Vázquez-Chagoyán JC, Salem AZM, et al. Prevalence and molecular identification of Chlamydia abortus in commercial dairy goat farms in a hot region in Mexico[J]. Trop Anim Health Prod, 2014, 46(6): 919-924. DOI:10.1007/s11250-014-0585-6 |
| [5] |
Teankum K, Pospischil A, Janett F, et al. Prevalence of Chlamydiae in semen and genital tracts of bulls, rams and bucks[J]. Theriogenology, 2007, 67(2): 303-310. DOI:10.1016/j.theriogenology.2006.07.012 |
| [6] |
Ruhl S, Goy G, Casson N, et al. Parachlamydia acanthamoebae infection and abortion in small ruminants[J]. Emerg Infect Dis, 2008, 14(12): 1966-1968. DOI:10.3201/eid1412.080582 |
| [7] |
Salinas J, Ortega N, Borge C, et al. Abortion associated with Chlamydia abortus in extensively reared Iberian sows[J]. Vet J, 2012, 194(1): 133-134. DOI:10.1016/j.tvjl.2012.03.002 |
| [8] |
Szymańska-Czerwińska M, Mitura A, Zaręba K, et al. Poultry in Poland as Chlamydiaceae carrier[J]. J Vet Res, 2017, 61(4): 411-419. DOI:10.1515/jvetres-2017-0072 |
| [9] |
Walder G, Meusburger H, Hotzel H, et al. Chlamydophila abortus pelvic inflammatory disease[J]. Emerg Infect Dis, 2003, 9(12): 1642-1644. DOI:10.3201/eid0912.020566 |
| [10] |
Pospischil A, Thoma R, Hilbe M, et al. Abortion in woman caused by caprine Chlamydophila abortus (Chlamydia psittaci serovar 1)[J]. Swiss Med Wkly, 2002, 132(5/6): 64-66. |
| [11] |
Pichon N, Guindre L, Laroucau K, et al. Chlamydia abortus in pregnant woman with acute respiratory distress syndrome[J]. Emerg Infect Dis, 2020, 26(3): 628-629. DOI:10.3201/eid2603.191417 |
| [12] |
Walder G, Hotzel H, Brezinka C, et al. An unusual cause of sepsis during pregnancy: recognizing infection with Chlamy-dophila abortus[J]. Obstet Gynecol, 2005, 106(5 Pt 2): 1215-1217. |
| [13] |
Roberts W, Grist NR, Giroud P. Human abortion associated with infection by ovine abortion agent[J]. Br Med J, 1967, 4(5570): 37. DOI:10.1136/bmj.4.5570.37 |
| [14] |
Ortega N, Caro MR, Gallego MC, et al. Isolation of Chlamydia abortus from a laboratory worker diagnosed with atypical pneumonia[J]. Ir Vet J, 2016, 69: 8. |
| [15] |
Imkamp F, Albini S, Karbach M, et al. Zoonotic Chlamydiae as rare causes of severe pneumonia[J]. Swiss Med Wkly, 2022, 152: w30102. DOI:10.4414/SMW.2022.w30102 |
| [16] |
Liu MT, Wen Y, Ding HG, et al. Septic shock with Chlamydia abortus infection[J]. Lancet Infect Dis, 2022, 22(6): 912. DOI:10.1016/S1473-3099(21)00756-8 |
| [17] |
Burgener AV, Seth-Smith HMB, Kern-Baumann S, et al. A case study of zoonotic Chlamydia abortus infection: diagnostic challenges from clinical and microbiological perspectives[J]. Open Forum Infect Dis, 2022, 9(10): ofac524. DOI:10.1093/ofid/ofac524 |
| [18] |
Zhu CJ, Lv MJ, Huang JL, et al. Bloodstream infection and pneumonia caused by Chlamydia abortus infection in China: a case report[J]. BMC Infect Dis, 2022, 22(1): 181. DOI:10.1186/s12879-022-07158-z |
| [19] |
Longbottom D, Livingstone M, Ribeca P, et al. Whole genome de novo sequencing and comparative genomic analyses suggests that Chlamydia psittaci strain 84/2334 should be reclassified as Chlamydia abortus species[J]. BMC Genomics, 2021, 22(1): 159. DOI:10.1186/s12864-021-07477-6 |
| [20] |
Longbottom D, Coulter LJ. Animal chlamydioses and zoonotic implications[J]. J Comp Pathol, 2003, 128(4): 217-244. |
| [21] |
McCombie WR, McPherson JD, Mardis ER. Next-generation sequencing technologies[J]. Cold Spring Harb Perspect Med, 2019, 9(11): a036798. DOI:10.1101/cshperspect.a036798 |
| [22] |
Lecuit M, Eloit M. The potential of whole genome NGS for infectious disease diagnosis[J]. Expert Rev Mol Diagn, 2015, 15(12): 1517-1519. DOI:10.1586/14737159.2015.1111140 |
| [23] |
Steuernagel B, Taudien S, Gundlach H, et al. De novo 454 sequencing of barcoded BAC pools for comprehensive gene survey and genome analysis in the complex genome of barley[J]. BMC Genomics, 2009, 10: 547. DOI:10.1186/1471-2164-10-547 |
| [24] |
Wilson MR, Naccache SN, Samayoa E, et al. Actionable diagnosis of neuroleptospirosis by next-generation sequencing[J]. N Engl J Med, 2014, 370(25): 2408-2417. |
| [25] |
Miao Q, Ma YY, Wang QQ, et al. Microbiological diagnostic performance of metagenomic next-generation sequencing when applied to clinical practice[J]. Clin Infect Dis, 2018, 67(Suppl 2): S231-S240. |
| [26] |
Rohde G, Straube E, Essig A, et al. Chlamydial zoonoses[J]. Dtsch Arztebl Int, 2010, 107(10): 174-180. |



