肺炎克雷伯菌(Klebsiella pneumoniae, KP)是引起医院感染常见的革兰阴性杆菌[1]。随着碳青霉烯类抗生素的广泛应用,临床出现耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)播散流行[2]。VI型分泌系统(type VI secretion system, T6SS)是一种新的毒力因子,在KP中可通过分泌效应蛋白实现抗菌和抗宿主功能,与医院环境适应性、生物膜形成及宿主内定植能力密切相关,并能促进基因水平转移,以及毒力因子和耐药基因的传播[3-4]。
T6SS组成结构复杂,包含多种蛋白,其中内管蛋白Hcp和刺突蛋白VgrG是T6SS向靶细胞释放效应蛋白的关键成分,同时也是T6SS的关键分泌蛋白。IcmF是具有ATP酶活性的膜间蛋白,是T6SS的必要成分,参与效应蛋白进入靶细胞[5-7]。研究[7-9]证明这三种蛋白在T6SS发挥生理学功能中的重要性,并将编码此三种蛋白的基因同时阳性认定为T6SS阳性。
尽管T6SS在血流感染KP中的检出率已有相关报道[10],但其在CRKP中的检出率,及其和毒力基因、耐药基因之间的关系研究较少。因此,本研究回顾性分析安徽地区某省级综合性三级甲等医院2019年1月—2022年12月CRKP临床分离株的感染特征,检测T6SS在CRKP中的检出率,以及T6SS阳性CRKP毒力基因、耐药基因的检出率和生物膜形成能力,以期为CRKP的临床防控和治疗提供相关依据。
1 对象与方法 1.1 研究对象收集2019年1月—2022年12月安徽地区某省级综合性三级甲等医院临床分离的非重复CRKP菌株。判定标准为对至少一种碳青霉烯类抗生素耐药或携带碳青霉烯酶耐药基因的KP。同时收集CRKP来源患者的性别、年龄、基础疾病、抗菌药物使用情况和临床转归等临床资料。本研究经该院伦理委员会审查同意(批准号:PJ-YX2022-083)。
1.2 方法 1.2.1 菌株鉴定和药物敏感性(药敏)试验血琼脂平板培养细菌并分离纯化,应用Microflex-LT/SH型质谱分析仪(德国BRUKER公司)进行细菌鉴定,应用VITEK 2 Compact全自动细菌分析仪(法国BioMérieux公司)检测CRKP抗菌药物耐药性,结果判定参考美国临床实验室标准化协会(CLSI)2020年版标准[11]。
1.2.2 T6SS基因、毒力基因检测采用煮沸法提取菌株DNA模板,PCR检测T6SS关键基因hcp、icmF、vgrG,扩增条件及方法参见文献[5]。上述三个关键基因均阳性判定为T6SS阳性[5],并根据该结果将菌株分为T6SS阳性组和T6SS阴性组。同时采用PCR法检测毒力基因,包括iucA、allS、iroB、mrkD、rmpA、rmpA2、entB、wabG、fimH、peg344和ybtS,扩增条件及方法参见文献[12]。
1.2.3 分子分型、荚膜血清分型和耐药基因检测采用多位点序列分型(multilocus sequence typing, MLST)检测CRKP序列分型(sequence typing, ST),PCR法检测管家基因gapA、infB、mdh、pgi、phoE、rpoB和tonB,将序列提交至MLST数据库,最终确定ST型[13]。采用PCR法联合测序技术检测CRKP菌株荚膜wzi分型[14]。采用PCR法检测blaKPC、blaIMP、blaVIM、blaNDM和blaOXA-48 5种耐药基因,将序列提交至BLAST网站进行比对,最终确定碳青霉烯酶耐药基因分型。扩增条件及方法参见文献[15]。
1.2.4 生物膜形成试验采用96孔板结晶紫染色法评估生物膜形成能力[7]。随机选取T6SS阳性、阴性菌株各10株,制备成0.5麦氏比浊单位(McF)菌悬液,每孔中加入10 μL菌悬液和190 μL MHB肉汤,每个菌株设置3个重复孔,36℃培养48 h后弃去所有菌液并使用磷酸盐缓冲液(PBS)清洗3遍。干燥后采用200 μL 0.1%结晶紫染色30 min,PBS洗净多余染料后干燥。每孔加入无水乙醇后,采用酶标仪测量570 nm处吸光度,得出相对于对照的生物膜测量值。每板最后3个孔加入200 μL MHB肉汤作为阴性对照。
1.2.5 统计分析应用WHONET 2021软件分析菌株对抗菌药物的耐药率,应用GraphPad Prism 8.0软件作图,其他统计分析应用SPSS 21.0软件。计数资料比较采用卡方检验和Fisher确切概率法,计量资料比较采用t检验,以P≤0.05为差异有统计学意义。
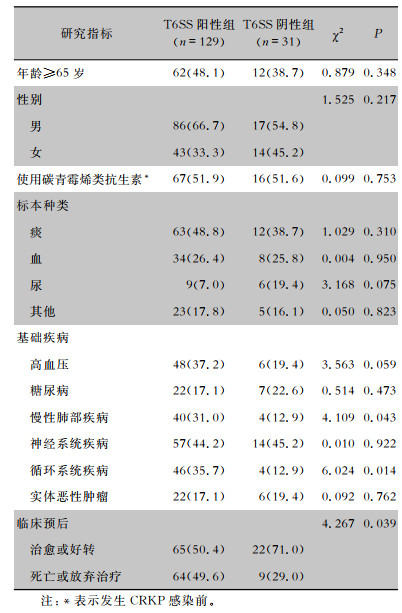
2 结果 2.1 菌株情况及临床患者感染特征共纳入非重复菌株160株。其中T6SS阳性菌株129株(80.6%),T6SS阴性菌株31株(19.4%)。标本来源为痰(75株,46.9%)、血(42株,26.3%)、尿(15株,9.4%)、脓及分泌物(14株,8.7%)、腹腔积液及关节腔液(8例,5.0%)、胆汁(3株,1.9%)、穿刺液(2株,1.3%)、尖端引流管(1株,0.6%)。T6SS阳性组与阴性组患者在性别、年龄、标本来源等方面差异均无统计学意义(均P>0.05)。T6SS阳性组患者患慢性肺部疾病、循环系统疾病比例均高于阴性组,其预后较T6SS阴性组患者差(均P<0.05)。见表 1。
| 表 1 T6SS阳性组与阴性组患者临床特征比较[例(%)] Table 1 Comparison of clinical characteristics between patients in T6SS-positive group and T6SS-negative group (No. of cases [%]) |
|
药敏试验结果显示,CRKP对多黏菌素B、替加环素、头孢他啶/阿维巴坦耐药率分别为3.1%、8.1%、25.6%,对其余药物耐药率均较高。T6SS阳性组和阴性组菌株对不同抗菌药物耐药率比较,差异均无统计学意义(均P>0.05)。见图 1。
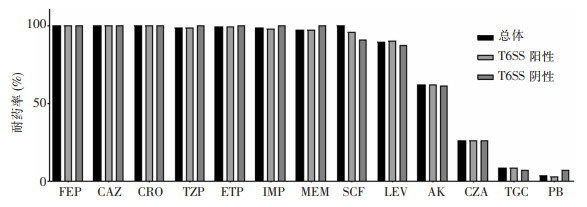 |
| 注:FEP为头孢吡肟,CAZ为头孢他啶,CRO为头孢曲松,TZP为哌拉西林/他唑巴坦,ETP为厄他培南,IMP为亚胺培南,MEM为美罗培南,SCF为头孢哌酮/舒巴坦,LEV为左氧氟沙星,AK为阿米卡星,CZA为头孢他啶/阿维巴坦,TGC为替加环素,PB为多黏菌素B。 图 1 T6SS阳性组和T6SS阴性组菌株对抗菌药物的耐药率 Figure 1 Antimicrobial resistance rates of strains in T6SS-positive group and T6SS-negative group |
PCR法检测碳青霉烯类耐药基因,blaKPC、blaIMP、blaNDM、blaOXA-48在CRKP中的检出率分别为80.6%、1.9%、17.5%、2.5%,未检测出blaVIM。检测出的blaKPC基因型均为KPC-2,blaNDM中检测出NDM-1、NDM-4、NDM-5、NDM-7。blaKPC、blaIMP、blaNDM检出率在T6SS阳性组和T6SS阴性组间差异均无统计学意义(均P>0.05),blaOXA-48在T6SS阴性组的检出率高于T6SS阳性组(P < 0.05)。见表 2。
| 表 2 T6SS阳性组和T6SS阴性组耐药基因分析[株(%)] Table 2 Antimicrobial resistance genes in T6SS-positive group and T6SS-negative group (No. of isolates [%]) |

|
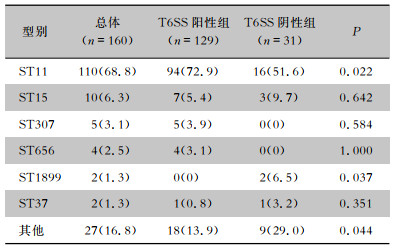
MLST结果显示,CRKP中以ST11型(68.8%)为主,其次为ST15型(6.3%)。T6SS阳性组中ST11型CRKP的占比高于T6SS阴性组(P < 0.05)。见表 3。
| 表 3 T6SS阳性组和T6SS阴性组分子分型分析[株(%)] Table 3 Molecular typing of T6SS-positive group and T6SS-negative group (No. of isolates [%]) |
|
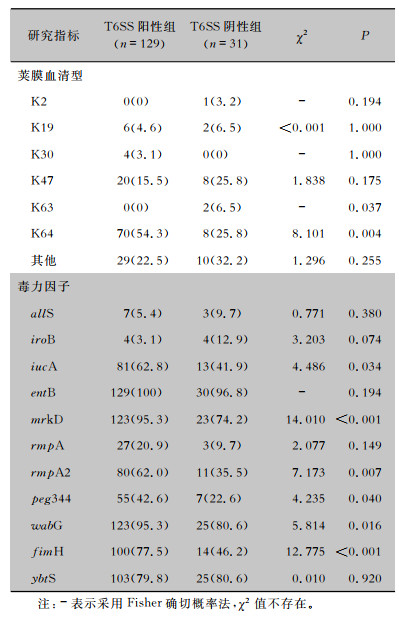
荚膜血清分型显示,CRKP中以K64、K47型为主,二者序列分型均为ST11型,且在ST11型CRKP中占比分别为70.9%、25.5%,K64-ST11型CRKP占比高于K47-ST11型(P < 0.05)。根据T6SS是否阳性分组,比较CRKP荚膜血清分型差异。T6SS阳性组中K64型70株(54.3%),K47型20株(15.5%),K19型6株(4.6%)。T6SS阴性组中K64型、K47型各8株(25.8%),K19型2株(6.5%)。T6SS阳性组K64型CRKP占比高于T6SS阴性组(P=0.004)。毒力因子检测结果显示,T6SS阳性组中iucA、mrkD、rmpA2、peg344、wabG、fimH检出率均高于T6SS阴性组(均P < 0.05)。见表 4。
| 表 4 T6SS阳性组和T6SS阴性组荚膜分型及毒力因子分析[株(%)] Table 4 Capsular serotype and virulence factors of T6SS-positive group and T6SS-negative group (No. of isolates [%]) |
|
随机选取T6SS阳性、阴性菌株各10株进行生物膜形成定量检测,结果显示相应生物膜形成量分别为0.082±0.015、0.044±0.008,阴性对照生物膜形成量为0.037±0.001。T6SS阳性组生物膜形成量高于T6SS阴性组,差异有统计学意义(P<0.001)。
3 讨论近年来,CRKP的检出率逐渐上升,并由于其多重耐药性迅速传播。CRKP获取毒力质粒后可转变为高毒力耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant hypervirulent Klebsiella pneumoniae, CR-hvKP),严重影响KP相关感染患者的预后。T6SS能促进毒力基因和耐药基因的水平转移,因此,本研究探索T6SS阳性CRKP临床感染特征,及其与毒力、耐药基因和生物膜形成之间的关系。
T6SS和毒力基因检测发现CRKP中T6SS检出率高达80.6%。T6SS阳性菌株iucA、mrkD、rmpA2、peg344、wabG、fimH检出率均高于T6SS阴性菌株(均P < 0.05),而这些基因与菌毛、荚膜、铁载体和脂多糖等常见的毒力因子密切相关。iucA编码铁载体气杆菌素,目前在大多数高毒力KP中存在;rmpA2是黏液表型调节因子,其表达会上调荚膜产生;fimH和mrkD分别参与编码1型和3型菌毛;wabG编码脂多糖产生的相关基因[16]; peg344编码未知功能的代谢转运蛋白,在高毒力KP中广泛流行,利用peg344阳性检测高毒力KP具有高灵敏度、特异度[17]。毒力基因检测结果提示T6SS阳性CRKP菌株携带更多的毒力基因,T6SS阳性CRKP可能拥有更强的毒力。
生物膜是细胞外基质包裹的细菌菌群,包括KP在内的多种微生物均具有生物膜形成能力。生物膜的形成可使KP免受免疫系统和抗菌药物对其的杀伤作用,且有多种毒力基因参与生物膜的形成[18]。因此,本研究对比T6SS阳性、阴性CRKP生物膜形成量,发现T6SS阳性组生物膜形成能力强于T6SS阴性组,提示T6SS有可能参与生物膜的形成,导致细菌在人体内定植,造成慢性感染。同时,临床资料统计结果显示,T6SS阳性组患者患慢性肺部疾病与心脏疾病的比例均高于T6SS阴性组(均P < 0.05),且预后更差,这表明T6SS阳性菌株可能具有更强的毒力。综合分析毒力基因、生物膜形成能力及患者预后等情况,T6SS阳性CRKP菌株可能在具备多重耐药特点的同时具有更强的毒力,因此,临床医务人员应加强对T6SS阳性CRKP的感染防控意识。
本研究对CRKP进行了ST型和荚膜血清分型检测,ST11型CRKP占比68.8%,且T6SS阳性CRKP中ST11型检出率高于T6SS阴性CRKP。根据荚膜血清分型将ST11型分为K64-ST11型和K47-ST11型,K64-ST11型检出率为70.9%,高于K47-ST11型(25.5%),且K64-ST11型在T6SS阳性组检出率高于T6SS阴性组(P < 0.05)。有研究[19]报道K64-ST11型菌株的毒力较K47-ST11型高,且K64-ST11型检出率逐渐增高,高于K47-ST11型,进一步证明了T6SS阳性菌株可能与高毒力有关。
随着抗菌药物的广泛、甚至是不规范使用,耐碳青霉烯类肠杆菌(CRE)的检出率逐渐上升。CRKP耐药机制中最主要的是携带碳青霉烯酶类耐药基因,其可以使β-内酰胺类抗生素失活,导致对绝大多数此类抗生素耐药[20]。常见的碳青霉烯酶分型包括A类丝氨酸酶(KPC型最常见),B类金属酶(NDM型、VIM型、IMP型等),D类丝氨酸酶(OXA型常见)。本研究结果显示,CRKP中最常见的碳青霉烯酶基因型为KPC,其次是NDM,而VIM、IMP、OXA-48较少见,其中以KPC-2最多,其次是NDM-1、NDM-5。T6SS阳性组和阴性组碳青霉烯类耐药基因和抗菌药物耐药率比较无明显差异,这与其他研究结果不同,可能因为本研究T6SS阳性组和阴性组均以ST11型CRKP为主,其缺乏R-M系统和CRISPR-Cas系统,更容易获得耐药性。
综上所述,本研究对于该地区T6SS在CRKP中的分布、相关感染特征、毒力基因、耐药基因、生物膜形成能力进行了分析,发现T6SS在CRKP中的检出率较高,且携带T6SS的CRKP毒力基因检出率更高,被认为与高毒力相关的基因iucA、rmpA、rmpA2、peg344在CRKP中的检出率也较高,CR-hvKP检出率的增加可能使临床治疗更加困难。但目前回顾性研究样本量不够,存在一定局限性,后续可以检测患者感染普通KP至CRKP过程中,T6SS的携带情况及表达量的变化,更客观地反映菌株产生耐药性的同时其毒力如何变化,为临床防治CRKP感染提供依据。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Lai CC, Yu WL. Klebsiella pneumoniae harboring carbapenemase genes in Taiwan: its evolution over 20 years, 1998-2019[J]. Int J Antimicrob Agents, 2021, 58(1): 106354. DOI:10.1016/j.ijantimicag.2021.106354 |
| [2] |
Della Rocca MT, Foglia F, Crudele V, et al. Antimicrobial resistance changing trends of Klebsiella pneumoniae isolated over the last 5 years[J]. New Microbiol, 2022, 45(4): 338-343. |
| [3] |
Li WZ, Liu XF, Tsui W, et al. Identification and comparative genomic analysis of type Ⅵ secretion systems and effectors in Klebsiella pneumoniae[J]. Front Microbiol, 2022, 13: 853744. DOI:10.3389/fmicb.2022.853744 |
| [4] |
殷冠坤, 靳龙阳, 王辉. 肺炎克雷伯菌和鲍曼不动杆菌Ⅵ型分泌系统研究进展[J]. 中华微生物学和免疫学杂志, 2021, 41(8): 640-644. Yin GK, Jin LY, Wang H. Advances in Klebsiella pneumoniae and Acinetobacter baumannii type Ⅵ secretion systems[J]. Chinese Journal of Microbiology and Immunology, 2021, 41(8): 640-644. |
| [5] |
Liu PL, Yang AW, Tang B, et al. Molecular epidemiology and clinical characteristics of the type Ⅵ secretion system in Klebsiella pneumoniae causing abscesses[J]. Front Microbiol, 2023, 14: 1181701. DOI:10.3389/fmicb.2023.1181701 |
| [6] |
Weber BS, Kinsella RL, Harding CM, et al. The secrets of Acinetobacter secretion[J]. Trends Microbiol, 2017, 25(7): 532-545. DOI:10.1016/j.tim.2017.01.005 |
| [7] |
Liao WJ, Huang HH, Huang QS, et al. Distribution of type VI secretion system (T6SS) in clinical Klebsiella pneumoniae strains from a Chinese hospital and its potential relationship with virulence and drug resistance[J]. Microb Pathog, 2022, 162: 105085. DOI:10.1016/j.micpath.2021.105085 |
| [8] |
Storey D, McNally A, Åstrand M, et al. Klebsiella pneumo-niae type VI secretion system-mediated microbial competition is PhoPQ controlled and reactive oxygen species dependent[J]. PLoS Pathog, 2020, 16(3): e1007969. DOI:10.1371/journal.ppat.1007969 |
| [9] |
Hsieh PF, Lu YR, Lin TL, et al. Klebsiella pneumoniae type VI secretion system contributes to bacterial competition, cell invasion, type-1 fimbriae expression, and in vivo colonization[J]. J Infect Dis, 2019, 219(4): 637-647. DOI:10.1093/infdis/jiy534 |
| [10] |
Zhang Y, Xu YH, Huang Y. Virulence genotype and correlation of clinical severeness with presence of the type Ⅵ secretion system in Klebsiella pneumoniae isolates causing bloodstream infections[J]. Infect Drug Resist, 2022, 15: 1487-1497. DOI:10.2147/IDR.S353858 |
| [11] |
Humphries R, Bobenchik AM, Hindler JA, et al. Overview of changes to the clinical and laboratory standards institute performance standards for antimicrobial susceptibility testing, M100, 31st edition[J]. J Clin Microbiol, 2021, 59(12): e0021321. DOI:10.1128/JCM.00213-21 |
| [12] |
Turton JF, Payne Z, Coward A, et al. Virulence genes in isolates of Klebsiella pneumoniae from the UK during 2016, including among carbapenemase gene-positive hypervirulent K1-ST23 and 'non-hypervirulent' types ST147, ST15 and ST383[J]. J Med Microbiol, 2018, 67(1): 118-128. DOI:10.1099/jmm.0.000653 |
| [13] |
杭修兵, 肖晓, 储雯雯, 等. 血流感染肺炎克雷伯菌临床特征、毒力基因及分子流行病学研究[J]. 中国抗生素杂志, 2022, 47(8): 839-844. Hang XB, Xiao X, Chu WW, et al. Clinical characteristics, virulence genes, and molecular epidemiology of Klebsiella pneumoniae in bloodstream infection[J]. Chinese Journal of Antibiotics, 2022, 47(8): 839-844. |
| [14] |
Wang J, Ma RJ, Pan F, et al. The molecular epidemiology of prevalent Klebsiella pneumoniae strains and humoral antibody responses against carbapenem-resistant K. pneumoniae infections among pediatric patients in Shanghai[J]. mSphere, 2022, 7(5): e0027122. DOI:10.1128/msphere.00271-22 |
| [15] |
何红, 黄紫嫣, 李军, 等. 改良Hodge试验、CNPt及mCIM筛选肺炎克雷伯菌产碳青霉烯酶的价值[J]. 中国感染控制杂志, 2019, 18(5): 375-379. He H, Huang ZY, Li J, et al. Value of modified Hodge test, Carba NP test, and modified carbapenem inactivation method for screening carbapenemase-producing Klebsiella pneumoniae[J]. Chinese Journal of Infection Control, 2019, 18(5): 375-379. DOI:10.12138/j.issn.1671-9638.20194448 |
| [16] |
Paczosa MK, Mecsas J. Klebsiella pneumoniae: going on the offense with a strong defense[J]. Microbiol Mol Biol Rev, 2016, 80(3): 629-661. DOI:10.1128/MMBR.00078-15 |
| [17] |
Yan C, Zhou Y, Du SH, et al. Recombinase-aided amplification assay for rapid detection of hypervirulent Klebsiella pneumoniae (hvKp) and characterization of the hvKp pathotype[J]. Microbiol Spectr, 2023, 11(2): e0398422. DOI:10.1128/spectrum.03984-22 |
| [18] |
Guerra MES, Destro G, Vieira B, et al. Klebsiella pneumo-niae biofilms and their role in disease pathogenesis[J]. Front Cell Infect Microbiol, 2022, 12: 877995. DOI:10.3389/fcimb.2022.877995 |
| [19] |
王伟, 康海全, 赵树龙, 等. KL47型和KL64型ST11碳青霉烯类耐药肺炎克雷伯菌分子流行病学特征[J]. 中华医院感染学杂志, 2022, 32(6): 819-823. Wang W, Kang HQ, Zhao SL, et al. Molecular epidemiological characteristics of ST11-KL47 and ST11-KL64 carbapenem-resistant Klebsiella pneumoniae[J]. Chinese Journal of Nosocomiology, 2022, 32(6): 819-823. |
| [20] |
Jee Y, Carlson J, Rafai E, et al. Antimicrobial resistance: a threat to global health[J]. Lancet Infect Dis, 2018, 18(9): 939-940. DOI:10.1016/S1473-3099(18)30471-7 |



