Impact of carbapenem-resistant Acinetobacter baumannii colonization on short-term mortality in COVID -19 ICU patients
-
摘要:
目的 探讨重症监护病房(ICU)耐碳青霉烯类鲍曼不动杆菌(CRAB)呼吸道定植对重型/危重型新型冠状病毒肺炎(简称新冠肺炎)患者28天病死率的影响。 方法 采用回顾性队列研究,收集2022年12月9日—2023年12月9日某三级中医医院3个综合ICU和呼吸科ICU收治的重型/危重型新冠肺炎患者的临床资料,依据入住ICU期间痰培养CRAB检出情况将患者分为呼吸道CRAB定植组和非CRAB定植组。绘制Kaplan-Meier生存曲线,比较两组患者入住ICU后28天病死率的差异。采用Cox比例风险模型探讨患者呼吸道CRAB定植与28天病死率的关系,并进行亚组分析。 结果 共纳入88例重型/危重型新冠肺炎患者,其中27例发生呼吸道CRAB定植(CRAB定植组),61例未发生呼吸道CRAB定植(非CRAB定植组);37例(42.0%)患者入住ICU后28天内死亡。Kaplan-Meier生存曲线显示,CRAB定植组患者28天病死率高于非CRAB定植组(66.7% VS 31.1%,P<0.001)。Cox单因素分析显示,CRAB定植组患者28天死亡风险为非CRAB定植组的2.91倍(HR=2.91,95%CI:1.52~5.58;P<0.05);经年龄、性别、基础疾病、白细胞计数、中性粒细胞与淋巴细胞比值、超敏C反应蛋白、呼吸频率、氧合指数、乳酸脱氢酶、尿素氮、肌酐、乳酸、D-二聚体协变量调整后,CRAB定植组患者死亡风险仍然高于非CRAB定植组(HR=2.54,95%CI:1.15~5.58;P<0.05)。亚组分析表明,ICU重型/危重型新冠肺炎患者呼吸道CRAB定植与28天病死率一定程度受性别、血清清蛋白、肌酐、D-二聚体水平影响(均交互P<0.05)。 结论 ICU重型/危重型新冠肺炎患者继发呼吸道CRAB定植后短期病死率明显升高,有效防控多重耐药菌定植及感染对保障患者预后至关重要。 Abstract:Objective To investigate the impact of respiratory colonization of carbapenem-resistant Acinetobacter baumannii (CRAB) on 28-day mortality of patients with severe/critical coronavirus disease 2019 (COVID -19) in intensive care unit (ICU). Methods Clinical data were collected from severe/critical COVID -19 patients admitted to general ICU and respiratory ICU in a tertiary Chinese medicine hospital from December 9, 2022 to December 9, 2023. According to the detection results of CRAB from sputum culture during ICU stay, patients were divided into respiratory CRAB colonization group and non-CRAB colonization group. Kaplan-Meier survival curve was plotted to compare the 28-day mortality between two groups of patients after ICU admission. Relationship between respiratory CRAB colonization and 28-day mortality was explored by Cox proportional hazards model, and subgroup analysis was performed. Results A total of 88 patients with severe/critical COVID -19 were included in analysis, out of which 27 had respiratory CRAB colonization (CRAB colonization group) and 61 didn't have respiratory CRAB colonization (non-CRAB colonization group); 37 patients (42.0%) died within 28 days after admission to the ICU. Kaplan-Meier survival curve showed that the 28-day mortality in CRAB group was higher than that in non-CRAB group (66.7% vs 31.1%, P < 0.001). Cox univariate analysis showed that the 28-day mortality risk of patients in the CRAB colonization group was 2.91 folds of those in the non-CRAB colonization group (HR=2.91, 95%CI: 1.52 -5.58; P < 0.05). After covariates adjusting for age, sex, underlying diseases, white blood cell count, neutrophil-to-lymphocyte ratio, hypersensitive C-reactive protein, respiratory frequency, oxygenation index, lactate dehydrogenase, urea nitrogen, creatinine, lactic acid, and D-dimer, the risk of death in the CRAB colonization group was still higher than that in the non-CRAB colonization group (HR=2.54, 95%CI: 1.15-5.58; P < 0.05). Subgroup analysis showed that respiratory CRAB colonization and 28-day mortality in severe/critical COVID -19 ICU patients was affected by gender, serum albumin, creatinine, and D-dimer levels (interaction P < 0.05 for all). Conclusion The short-term mortality of severe/critical COVID -19 patients in the ICU increases significantly after secondary colo- nization of respiratory CRAB. Effective prevention and control of colonization and infection by multidrug-resistant organisms are crucial for ensuring patient prognosis. -
鲍曼不动杆菌(Acinetobacter baumannii, AB)作为医院感染的主要致病菌之一,广泛分布于医院环境,易在患者皮肤、口腔、结膜、呼吸道、泌尿生殖道及胃肠道等部位定植[1]。耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant Acinetobacter bauma-nnii, CRAB)通常指对亚胺培南、美罗培南或多利培南任何一种碳青霉烯类抗生素耐药者[2]。新型冠状病毒感染(coronavirus disease 2019, COVID -19)流行以来,全球COVID -19继发细菌感染的发病率为0.6%~45%,并一定程度加速了细菌对抗菌药物耐药的危机[3-4]。AB是COVID -19最常见的继发感染细菌之一,91.2%的COVID -19患者分离出的AB株为CRAB[5]。新型冠状病毒肺炎(简称新冠肺炎)继发CRAB感染/定植的患者,其并发症、疾病严重程度和病死率增加更为明显[6]。国内COVID -19重症患者的预后研究多集中在预测模型的构建,探讨CRAB定植对新冠肺炎患者短期死亡的独立风险研究相对较少。本文旨在分析重症监护病房(ICU)呼吸道CRAB定植对重症/危重症新冠肺炎患者28天病死率的影响,为临床耐药菌感染防控方案制定的必要性提供依据。
1. 对象与方法
1.1 研究对象
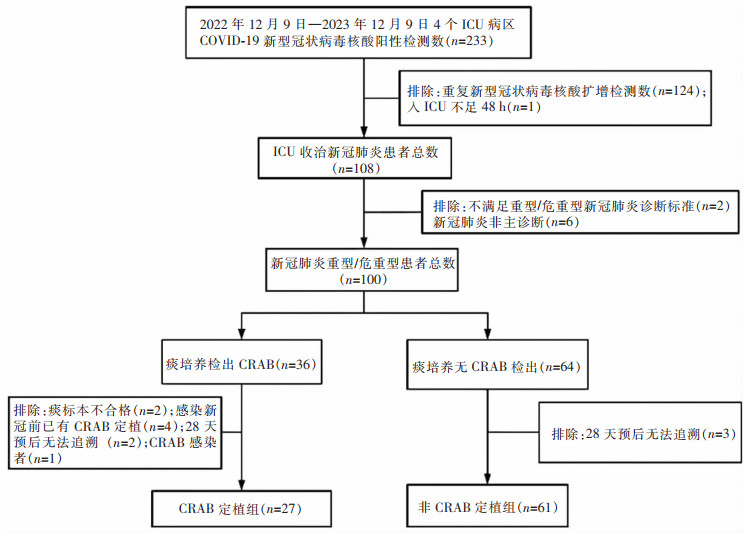
2022年12月9日—2023年12月9日,某院3个综合ICU和1个呼吸专科ICU收治的重症/危重症新冠肺炎为主诊断的患者,共88例。按照入住ICU期间合格痰标本中是否检出CRAB分为呼吸道CRAB定植组和非CRAB定植组。排除48 h内转出ICU,或自动出院且无再就诊记录,或无法追溯28天死亡结局的患者。患者入组筛选流程见图 1。
1.2 研究方法
1.2.1 数据收集
从杏林医院感染管理监测系统和凤凰医院病历信息系统回顾性收集患者的临床资料,包括姓名、性别、年龄、合并基础疾病、生命体征、氧合指数、二氧化碳分压、实验室指标、治疗措施、28天转归等。生命体征收集的是入ICU即刻数据,实验室指标首选入ICU 24 h内首次检测结果,未检测者以入ICU前24 h内急诊等科室实验室结果作为补充。
1.2.2 协变量筛选
参考既往文献、临床经验以及回顾性数据的可及性确定纳入筛选的变量,包括年龄、性别、吸烟史、白细胞计数、淋巴细胞计数、中性粒细胞与淋巴细胞比值、氧合指数、合并其他病原体感染、合并基础疾病、降钙素原、血小板、高敏肌钙蛋白Ⅰ、呼吸频率、血尿素氮、肌酸激酶同工酶、超敏C反应蛋白、总胆红素、血乳酸、丙氨酸转氨酶、天冬氨酸转氨酶、肌酐、D-二聚体、乳酸脱氢酶、血钙、血清清蛋白、机械通气、抗菌药物使用、糖皮质激素使用时长等[7-12]。调整变量的筛选根据临床意义,Cox单因素分析P<0.1或者对暴露和结局效应值影响>10%的变量[13],并进行变量间的共线性检验。
1.3 相关定义
(1) 诊断标准。依据《新冠病毒感染诊疗方案(试行第十版)》的诊断标准。重型:患者符合下列任何一条且不能以COVID -19以外其他原因解释。①出现气促,呼吸频率(RR)≥30次/min;②静息状态下,吸空气时指氧饱和度≤93%;③动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg;④临床症状进行性加重,肺部影像学显示24~48 h内病灶明显进展>50%。危重型:符合以下情况之一者。①出现呼吸衰竭, 且需要机械通气;②出现休克;③合并其他器官功能衰竭。(2)新冠肺炎继发呼吸道CRAB定植。入住ICU期间合格痰(含气管内抽吸物、支气管肺泡灌洗液)标本培养检出CRAB,COVID -19发病前无CRAB检出史,结合患者发热、白细胞计数、炎症标志物、血培养、影像学变化等症状、体征和辅助检查结果综合考虑排除CRAB感染患者[14-15]。
1.4 统计学分析
应用EXCEL软件建立数据库,应用北京风锐科林Free statistic统计软件(v1.9.2)进行统计分析。计数资料以例数或百分比表示,计量资料采用均数±标准差(x±s)或中位数(四分位数)[M(P25,P75)]描述;定性资料比较采用卡方检验或Fisher确切概率法;定量资料比较采用t检验或秩和检验。绘制两组患者28天病死率的Kaplan-Meier生存曲线,采用log-rank检验进行比较。采用Cox多因素回归分析呼吸道CRAB定植对患者28天病死率的影响;使用亚组分析探究在不同亚组中CRAB定植对28天病死率的影响并绘制森林图,结果用风险比(HR)、95%置信区间(CI)和交互P表示。对分类变量按照有或无区分亚组,对连续性变量按照具有临床意义的中高危界值区分亚组,排除区分亚组后事件数量过少,可能导致稀缺数据偏差的协变量。对于有异常值的数据,如D-二聚体>20 mg/L时以20 mg/L纳入统计,对于少量缺失的实验室数据以均值或中位数进行替换。统计数据均采用双侧检验,P≤0.05为差异有统计学意义。
2. 结果
2.1 一般资料
本研究共纳入88例患者,其中男性61例,女性27例;年龄20~105岁,平均(77.0±12.5)岁;37例(42.0%)患者入住ICU后28天内死亡。两组患者在合并流感/副流感病毒感染比例、降钙素原、血钙、天冬氨酸转氨酶、血糖水平,以及抗菌药物使用时长方面比较,差异均有统计学意义(均P<0.05)。见表 1。
表 1 两组重症/危重症新冠肺炎患者基线特征Table 1 Baseline characteristics of two groups of severe/critical COVID -19 patients变量 全部(n=88) CRAB组(n=27) 非CRAB组(n=61) t/χ2/Z P 人口学特征 性别[男,例(%)] 61(69.3) 20(74.1) 41(67.2) 0.414 0.520 年龄(x±s, 岁) 77.0±12.5 77.7±8.9 76.7±13.9 0.126 0.724 吸烟史[例(%)] / 0.616 不吸烟 67(76.1) 21(77.8) 46(75.4) 已戒烟 17(19.3) 4(14.8) 13(21.3) 吸烟 4(4.5) 2(7.4) 2(3.3) 合并感染病原体[例(%)] 流感或副流感病毒 6(6.8) 5(18.5) 1(1.6) / 0.010 支原体 5(5.7) 0(0) 5(8.2) / 0.318 EB病毒 8(9.1) 1(3.7) 7(11.5) / 0.426 合并基础疾病[例(%)] 慢性呼吸系统疾病 11(12.5) 3(11.1) 8(13.1) / 1.000 高血压 64(72.7) 22(81.5) 42(68.9) 1.505 0.220 糖尿病 34(38.6) 10(37.0) 24(39.3) 0.042 0.838 冠心病 32(36.4) 8(29.6) 24(39.3) 0.763 0.382 脑卒中 27(30.7) 11(40.7) 16(26.2) 1.853 0.173 恶性肿瘤 23(26.1) 6(22.2) 17(27.9) 0.309 0.578 生命体征(x±s) 体温(℃) 37.0±0.8 37.0±0.8 36.9±0.8 0.223 0.638 脉搏(次/min) 93.8±20.0 93.2±16.5 94.0±21.5 0.028 0.868 呼吸(次/min) 26.3±7.2 28.0±8.1 25.5±6.8 2.281 0.135 平均动脉压(mmHg) 96.4±16.3 94.6±18.9 97.2±15.2 0.500 0.481 氧合指数(x±s,mmHg) 139.9±68.0 141.2±73.3 139.4±66.2 0.013 0.909 二氧化碳分压(x±s, mmHg) 38.8±10.9 40.0±12.7 38.4±10.1 0.398 0.530 实验室指标 白细胞计数(x±s, ×109/L) 10.7±5.3 11.1±4.2 10.6±5.8 0.204 0.652 淋巴细胞计数(x±s, ×109/L) 0.6±0.4 0.6±0.3 0.6±0.4 0.251 0.618 中性粒细胞与淋巴细胞比值[M(P25,P75] 17.8(10.7, 28.8) 18.0(8.3, 29.3) 15.8(12.8, 25.0) 0.020 0.888 降钙素原[M(P25,P75), ng/mL] 0.3(0.1, 5.7) 0.6(0.2, 10.7) 0.2(0.1, 1.6) 4.350 0.037 超敏C反应蛋白[M(P25,P75), mg/L] 101.8(35.9, 155.8) 133.6(45.5, 154.6) 71.8(33.6, 154.6) 1.249 0.264 红细胞比积(x±s) 35.2±7.1 36.1±5.3 34.7±7.7 0.735 0.394 乳酸脱氢酶(x±s, U/L) 423.6±207.3 457.1±165.7 408.8±222.9 1.018 0.316 肌酸激酶同工酶[M(P25,P75), U/L] 13.5(7.8, 20.0) 14.0(7.5, 23.5) 13.0(8.0, 19.1) 0.408 0.523 血钾(x±s, mmol/L) 4.1±0.7 4.1±0.7 4.0±0.8 0.384 0.537 血钠(x±s, mmol/L) 138.8±7.7 140.7±9.9 138.0±6.5 2.264 0.136 血钙(x±s, mmol/L) 1.5±0.5 1.7±0.4 1.4±0.5 8.062 0.006 血清清蛋白(x±s, g/L) 30.8±4.6 29.5±4.7 31.4±4.5 3.208 0.077 血小板计数(x±s, ×109/L) 159.4±68.2 155.2±65.1 161.2±70.0 0.143 0.706 高敏肌钙蛋白Ⅰ[M(P25,P75), pg/mL] 56.0(16.8, 271.0) 126.2(28.8, 414.1) 40.1(16.6, 122.0) 3.357 0.067 尿素氮[M(P25,P75), mmol/L] 10.1(7.1, 16.3) 12.7(8.5, 19.2) 9.7(6.4, 16.1) 3.308 0.069 肌酐[M(P25,P75), μmol/L] 81.2(58.9, 164.5) 99.3(66.9, 170.6) 71.3(57.6, 138.6) 2.283 0.131 乳酸[M(P25,P75), mmol/L] 1.6(1.1, 2.4) 1.7(1.4, 3.2) 1.5(1.1, 2.2) 1.856 0.173 D-二聚体[M(P25,P75), mg/L] 2.5(1.5, 8.2) 2.4(1.8, 10.4) 2.9(1.2, 8.1) 0.189 0.664 丙氨酸转氨酶[M(P25,P75), U/L] 25.0(16.0, 38.8) 25.0(18.0, 33.5) 25.0(14.0, 41.0) 0.148 0.700 天冬氨酸转氨酶[M(P25,P75), U/L] 33.5(25.8, 55.2) 39.0(30.0, 70.0) 29.0(24.0, 55.0) 3.876 0.049 γ-谷氨酰转肽酶[M(P25,P75), U/L] 30.5(23.0, 55.5) 32.0(24.5, 76.0) 30.0(22.0, 54.0) 0.205 0.651 总胆红素(x±s, μmol/L] 14.6±11.0 14.5±7.8 14.7±12.3 0.006 0.940 血糖(x±s, mmol/L] 10.0±5.1 12.5±6.4 9.0±4.0 9.708 0.002 治疗措施 机械通气时长[M(P25,P75), d] 6.0(0, 11.2) 6.0(2.5, 7.5) 6.0(0, 14.0) 0.010 0.919 抗菌药物使用时长[M(P25,P75), d] 9.5(6.0, 14.0) 8.0(5.5, 10.0) 11.0(7.0, 19.0) 5.971 0.015 糖皮质激素使用时长[M(P25,P75), d] 4.0(0, 8.0) 3.0(0, 5.5) 5.0(1.0, 9.0) 1.745 0.187 死亡[例(%)] 37(42.0) 18(66.7) 19(31.1) 9.690 0.002 注:统计量一栏中“/”为使用Fisher确切概率法统计。 2.2 患者短期死亡的生存曲线分析
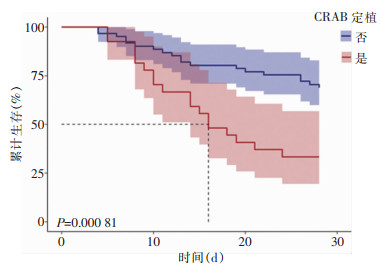
本组患者28天病死率为42.0%(37/88),其中CRAB定植组患者病死率为66.7%(18/27),非CRAB定植组患者病死率为31.1%(19/61)。Kaplan-Meier生存曲线显示,两组患者28天病死率比较,差异具有统计学意义(P<0.001)。见图 2。
2.3 患者短期死亡的Cox单因素分析
单因素分析结果显示,28天内死亡组与存活组患者在呼吸频率、氧合指数、白细胞计数、中性粒细胞与淋巴细胞比值、超敏C反应蛋白、乳酸脱氢酶、血清清蛋白、尿素氮、肌酐、D-二聚体、CRAB定植方面比较,差异均具有统计学意义(均P<0.05)。见表 2。
表 2 ICU重型/危重型新冠肺炎患者28天病死率的Cox单因素分析Table 2 Cox univariate analysis on 28-day mortality in severe/critical COVID -19 ICU patients变量 HR(95%CI) P 变量 HR(95%CI) P 性别 1.22(0.59~2.51) 0.599 超敏C反应蛋白 1.00(1.00~1.01) 0.021 年龄 1.02(0.99~1.05) 0.172 红细胞比积 0.97(0.92~1.01) 0.161 已戒烟* 0.61(0.24~1.57) 0.307 乳酸脱氢酶 1.00(1.00~1.00) < 0.001 吸烟* 1.20(0.29~5.04) 0.800 肌酸激酶同工酶 1.00(0.99~1.01) 0.467 流感/副流感病毒感染 0.70(0.17~2.90) 0.619 血钾 1.28(0.88~1.86) 0.204 支原体感染 0.42(0.06~3.09) 0.396 血钠 1.03(0.99~1.08) 0.166 EB病毒感染 0.54(0.13~2.25) 0.399 血钙 1.37(0.7~2.67) 0.362 慢性呼吸系统疾病史 0.56(0.17~1.81) 0.331 血清清蛋白 0.87(0.8~0.94) 0.001 高血压史 1.54(0.7~3.37) 0.281 血小板计数 0.99(0.99~1.00) 0.319 糖尿病史 0.90(0.47~1.76) 0.766 高敏肌钙蛋白Ⅰ 1.00(0.99~1.00) 0.506 冠心病史 0.75(0.37~1.52) 0.423 尿素氮 1.04(1.01~1.07) 0.008 脑卒中史 1.39(0.71~2.7) 0.333 肌酐 1.00(1.00~1.00) 0.01 恶性肿瘤史 0.86(0.41~1.82) 0.695 乳酸 1.14(0.99~1.32) 0.072 体温 1.24(0.83~1.86) 0.302 D-二聚体 1.09(1.05~1.14) < 0.001 脉搏 1.01(0.99~1.03) 0.238 丙氨酸转氨酶 0.99(0.99~1.01) 0.466 呼吸频率 1.05(1.00~1.09) 0.035 天冬氨酸转氨酶 1.00(0.99~1.00) 0.884 平均动脉压 0.99(0.97~1.01) 0.878 γ-谷氨酰转肽酶 1.00(0.99~1.00) 0.787 氧合指数 0.99(0.98~0.99) 0.041 总胆红素 1.01(0.98~1.04) 0.586 二氧化碳分压 0.98(0.94~1.01) 0.167 血糖 1.04(0.99~1.1) 0.137 白细胞计数 1.08(1.03~1.14) 0.002 机械通气时长 1.01(0.98~1.04) 0.599 淋巴细胞计数 0.95(0.38~2.35) 0.908 抗菌药物使用时长 0.97(0.94~1.02) 0.217 中性粒细胞与淋巴细胞比值 1.01(1.00~1.02) 0.046 糖皮质激素使用时长 0.96(0.90~1.02) 0.159 降钙素原 1.01(0.99~1.02) 0.374 呼吸道CRAB定植 2.91(1.52~5.58) 0.001 注:*表示与不吸烟组比较。 2.4 呼吸道CRAB定植与28天病死率的Cox多因素回归分析
Cox单因素分析显示,患者呼吸道CRAB定植与28天病死率成正相关(HR=2.91,95%CI: 1.52~5.58;P<0.05)。模型1调整了性别、年龄;模型2在模型1的基础上增加了变量合并慢性呼吸系统疾病及高血压、糖尿病、冠心病、脑卒中、恶性肿瘤病史;模型3在模型2的基础上增加了变量白细胞计数、中性粒细胞与淋巴细胞比值、超敏C反应蛋白、呼吸频率、氧合指数;模型4在模型3基础上增加了变量乳酸脱氢酶、尿素氮、肌酐、乳酸、D-二聚体;模型5在模型4基础上增加了变量血清清蛋白。Cox多因素回归分析结果显示,模型4中,CRAB定植与28天死亡的相关性依然稳健(HR=2.54,95%CI: 1.15~5.58;P<0.05);模型5中,CRAB定植对患者死亡结局的效应量有所下降(HR=1.99,95%CI: 0.87~4.53;P=0.101)。见表 3。
表 3 ICU重型/危重型新冠肺炎患者呼吸道CRAB定植与28天病死率的Cox多因素回归分析Table 3 Cox multivariate regression analysis on respiratory CRAB colonization and 28-day mortality in severe/critical COVID -19 ICU patients校正模型 HR(95%CI) P 未调整前 2.91(1.52~5.58) 0.001 调整模型1 2.92(1.66~5.90) 0.001 调整模型2 2.61(1.33~5.14) 0.005 调整模型3 2.51(1.24~5.08) 0.011 调整模型4 2.54(1.15~5.58) 0.021 调整模型5 1.99(0.87~4.53) 0.101 2.5 亚组分析
对所有调整的协变量进行亚组分析,结果显示分亚组后慢性呼吸系统疾病史、高血压史、冠心病史、脑卒中史、恶性肿瘤史、白细胞计数、超敏C反应蛋白、呼吸频率、氧合指数、乳酸脱氢酶的死亡发生事件数量过低,效应值过大,存在统计偏倚可能。其余变量纳入亚组分析并绘制森林图,见图 3。结果显示,患者呼吸道CRAB定植与28天病死率的相关性一定程度受性别、血清清蛋白、肌酐、D-二聚体水平影响(均交互P<0.05)。
3. 讨论
研究[16]显示,COVID -19继发细菌感染最常见的病原体为AB,AB对碳青霉烯类抗生素耐药率高达83.7%。CRAB感染的危重患者发生死亡的风险,COVID -19患者比非COVID -19患者高[17]。CRAB定植患者病死率,与CRAB感染患者比较差异无统计学意义,但高于AB敏感菌感染患者[18]。本研究中,30.7%的重型/危重型新冠肺炎患者发生了呼吸道CRAB定植,与文献[19]报道的AB定植发生率41.46%一致。患者28天短期病死率为42.0%,低于国外报道的64.7%~74.0%的病死率[20-21]。
本研究Cox多因素回归分析发现,呼吸道CRAB定植是重型/危重型新冠肺炎患者短期死亡的独立危险因素,可使患者28天病死率升高0.99~1.54倍,该结论与国外研究[21-22]结果一致。Montrucchio等[21]研究发现,与COVID -19患者病死率相关的危险因素是年龄(OR=1.070,95%CI: 1.028~1.115) 和CRAB定植(OR=5.463,95%CI: 1.572~18.988)。Boral等[22]研究也显示,患者气管抽吸物培养有细菌生长。本研究经全模型调整后虽然P>0.05,然而从统计学临床角度来看,尚不能简单地以0.05或0.01为P值界点评判研究变量之间是否具有相关性,应综合多方面因素进行考量[23]。在样本量较小的研究中,随着调整的协变量数量增多,势必会影响P值的稳定性[24]。本研究在调整10个以内变量的情况下P值仍有统计学意义。
亚组分析显示,性别、血清清蛋白、肌酐、D-二聚体水平与呼吸道CRAB定植和病死率之间可能存在交互作用。研究[8, 25]发现,男性比女性更容易受到严重COVID -19影响,肺部病灶的吸收也比女性慢。本研究中,当血清清蛋白中重度降低时,患者短期预后受到CRAB定植的影响程度有所下降。血清清蛋白低是CRAB患者死亡的主要危险因素之一,血清清蛋白水平越低,越不利于新型冠状病毒核酸检测转阴[26-27]。王铭等[28]构建的COVID -19患者重症风险早期预测模型中,肌酐和D-二聚体升高同样是患者疾病恶化的重要预测指标,本研究得出了相同的结论。
进一步分析疾病发生机制发现,良好的免疫功能可帮助机体清除新型冠状病毒,控制感染;但如果免疫系统被过度激活,就会产生极端的免疫反应,释放大量细胞因子,反过来攻击宿主。谢情情[29]通过AB感染诱导的宿主肺部免疫微环境研究发现,AB感染6 h后肺泡巨噬细胞处于免疫应答状态,有大量炎症因子通路激活,或与引发的“细胞因子风暴”共同作用,从而使病情加重。此外,男性患者更易出现超敏C反应蛋白增高,重症患者炎性因子明显升高预示着疾病更严重,提示新冠肺炎可能对男性造成的创伤更大[18]。血清清蛋白降低意味着机体免疫功能下降,从而降低对AB的抵抗力;低白蛋白血症还可以直接影响呼吸道上皮细胞的修复,导致呼吸肌肉萎缩、肺组织水肿等,进一步影响患者通气和换气功能。但Quinn等[30]通过体外研究发现,血清清蛋白可以诱导AB基因表达的改变,包括表面相关运动性增加,生物膜形成减少,对β-内酰胺类抗生素的耐药性增加等,反而促进AB适应环境变化;从保护因素变为损伤因素的血清清蛋白阈值尚需要更多的研究加以证实。D-二聚体是一种反映纤溶亢进和高凝状态的标志物,新冠肺炎患者大量炎症介质的释放会造成血管内皮细胞大量损伤,激活机体凝血机制,消耗凝血因子,D-二聚体越高的肺炎患者预后越差[31]。肾功能损伤程度与新冠肺炎患者住院病死率相关。一项超过1万例COVID -19病例的荟萃分析发现,慢性肾脏疾病是导致患者死亡的主要原因,但其机制尚未完全明确,考虑与新型冠状病毒中刺突糖蛋白(spike)与ACE2受体结合,肾脏近端小管功能障碍,肾小管管腔扩张、基底膜剥落、刷状缘变化,从而加重免疫损伤等有关[32-33]。
本研究的不足之处:①作为回顾性研究,因临床资料采集不全而影响到纳入分析变量的全面性,例如缺少白细胞介素-6、铁蛋白等指标。②样本量相对不足,与COVID -19患者新型冠状病毒核酸检测数急剧下降相关。本研究通过对比国内外COVID -19患者数据为结论提供支撑。③本研究病例来源于不同的ICU,无法完全调整医护诊疗措施、检验仪器等差异对实验室指标和患者结局产生的影响。国家新冠肺炎诊疗方案的及时出台一定程度保障了诊疗的相对同质化。
综上所述,本研究聚焦于呼吸道CRAB定植对重型/危重型新冠肺炎患者短期死亡的独立风险分析,为临床加强多重耐药菌感染防控,改善患者预后提供了循证依据。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 两组重症/危重症新冠肺炎患者基线特征
Table 1 Baseline characteristics of two groups of severe/critical COVID -19 patients
变量 全部(n=88) CRAB组(n=27) 非CRAB组(n=61) t/χ2/Z P 人口学特征 性别[男,例(%)] 61(69.3) 20(74.1) 41(67.2) 0.414 0.520 年龄(x±s, 岁) 77.0±12.5 77.7±8.9 76.7±13.9 0.126 0.724 吸烟史[例(%)] / 0.616 不吸烟 67(76.1) 21(77.8) 46(75.4) 已戒烟 17(19.3) 4(14.8) 13(21.3) 吸烟 4(4.5) 2(7.4) 2(3.3) 合并感染病原体[例(%)] 流感或副流感病毒 6(6.8) 5(18.5) 1(1.6) / 0.010 支原体 5(5.7) 0(0) 5(8.2) / 0.318 EB病毒 8(9.1) 1(3.7) 7(11.5) / 0.426 合并基础疾病[例(%)] 慢性呼吸系统疾病 11(12.5) 3(11.1) 8(13.1) / 1.000 高血压 64(72.7) 22(81.5) 42(68.9) 1.505 0.220 糖尿病 34(38.6) 10(37.0) 24(39.3) 0.042 0.838 冠心病 32(36.4) 8(29.6) 24(39.3) 0.763 0.382 脑卒中 27(30.7) 11(40.7) 16(26.2) 1.853 0.173 恶性肿瘤 23(26.1) 6(22.2) 17(27.9) 0.309 0.578 生命体征(x±s) 体温(℃) 37.0±0.8 37.0±0.8 36.9±0.8 0.223 0.638 脉搏(次/min) 93.8±20.0 93.2±16.5 94.0±21.5 0.028 0.868 呼吸(次/min) 26.3±7.2 28.0±8.1 25.5±6.8 2.281 0.135 平均动脉压(mmHg) 96.4±16.3 94.6±18.9 97.2±15.2 0.500 0.481 氧合指数(x±s,mmHg) 139.9±68.0 141.2±73.3 139.4±66.2 0.013 0.909 二氧化碳分压(x±s, mmHg) 38.8±10.9 40.0±12.7 38.4±10.1 0.398 0.530 实验室指标 白细胞计数(x±s, ×109/L) 10.7±5.3 11.1±4.2 10.6±5.8 0.204 0.652 淋巴细胞计数(x±s, ×109/L) 0.6±0.4 0.6±0.3 0.6±0.4 0.251 0.618 中性粒细胞与淋巴细胞比值[M(P25,P75] 17.8(10.7, 28.8) 18.0(8.3, 29.3) 15.8(12.8, 25.0) 0.020 0.888 降钙素原[M(P25,P75), ng/mL] 0.3(0.1, 5.7) 0.6(0.2, 10.7) 0.2(0.1, 1.6) 4.350 0.037 超敏C反应蛋白[M(P25,P75), mg/L] 101.8(35.9, 155.8) 133.6(45.5, 154.6) 71.8(33.6, 154.6) 1.249 0.264 红细胞比积(x±s) 35.2±7.1 36.1±5.3 34.7±7.7 0.735 0.394 乳酸脱氢酶(x±s, U/L) 423.6±207.3 457.1±165.7 408.8±222.9 1.018 0.316 肌酸激酶同工酶[M(P25,P75), U/L] 13.5(7.8, 20.0) 14.0(7.5, 23.5) 13.0(8.0, 19.1) 0.408 0.523 血钾(x±s, mmol/L) 4.1±0.7 4.1±0.7 4.0±0.8 0.384 0.537 血钠(x±s, mmol/L) 138.8±7.7 140.7±9.9 138.0±6.5 2.264 0.136 血钙(x±s, mmol/L) 1.5±0.5 1.7±0.4 1.4±0.5 8.062 0.006 血清清蛋白(x±s, g/L) 30.8±4.6 29.5±4.7 31.4±4.5 3.208 0.077 血小板计数(x±s, ×109/L) 159.4±68.2 155.2±65.1 161.2±70.0 0.143 0.706 高敏肌钙蛋白Ⅰ[M(P25,P75), pg/mL] 56.0(16.8, 271.0) 126.2(28.8, 414.1) 40.1(16.6, 122.0) 3.357 0.067 尿素氮[M(P25,P75), mmol/L] 10.1(7.1, 16.3) 12.7(8.5, 19.2) 9.7(6.4, 16.1) 3.308 0.069 肌酐[M(P25,P75), μmol/L] 81.2(58.9, 164.5) 99.3(66.9, 170.6) 71.3(57.6, 138.6) 2.283 0.131 乳酸[M(P25,P75), mmol/L] 1.6(1.1, 2.4) 1.7(1.4, 3.2) 1.5(1.1, 2.2) 1.856 0.173 D-二聚体[M(P25,P75), mg/L] 2.5(1.5, 8.2) 2.4(1.8, 10.4) 2.9(1.2, 8.1) 0.189 0.664 丙氨酸转氨酶[M(P25,P75), U/L] 25.0(16.0, 38.8) 25.0(18.0, 33.5) 25.0(14.0, 41.0) 0.148 0.700 天冬氨酸转氨酶[M(P25,P75), U/L] 33.5(25.8, 55.2) 39.0(30.0, 70.0) 29.0(24.0, 55.0) 3.876 0.049 γ-谷氨酰转肽酶[M(P25,P75), U/L] 30.5(23.0, 55.5) 32.0(24.5, 76.0) 30.0(22.0, 54.0) 0.205 0.651 总胆红素(x±s, μmol/L] 14.6±11.0 14.5±7.8 14.7±12.3 0.006 0.940 血糖(x±s, mmol/L] 10.0±5.1 12.5±6.4 9.0±4.0 9.708 0.002 治疗措施 机械通气时长[M(P25,P75), d] 6.0(0, 11.2) 6.0(2.5, 7.5) 6.0(0, 14.0) 0.010 0.919 抗菌药物使用时长[M(P25,P75), d] 9.5(6.0, 14.0) 8.0(5.5, 10.0) 11.0(7.0, 19.0) 5.971 0.015 糖皮质激素使用时长[M(P25,P75), d] 4.0(0, 8.0) 3.0(0, 5.5) 5.0(1.0, 9.0) 1.745 0.187 死亡[例(%)] 37(42.0) 18(66.7) 19(31.1) 9.690 0.002 注:统计量一栏中“/”为使用Fisher确切概率法统计。 表 2 ICU重型/危重型新冠肺炎患者28天病死率的Cox单因素分析
Table 2 Cox univariate analysis on 28-day mortality in severe/critical COVID -19 ICU patients
变量 HR(95%CI) P 变量 HR(95%CI) P 性别 1.22(0.59~2.51) 0.599 超敏C反应蛋白 1.00(1.00~1.01) 0.021 年龄 1.02(0.99~1.05) 0.172 红细胞比积 0.97(0.92~1.01) 0.161 已戒烟* 0.61(0.24~1.57) 0.307 乳酸脱氢酶 1.00(1.00~1.00) < 0.001 吸烟* 1.20(0.29~5.04) 0.800 肌酸激酶同工酶 1.00(0.99~1.01) 0.467 流感/副流感病毒感染 0.70(0.17~2.90) 0.619 血钾 1.28(0.88~1.86) 0.204 支原体感染 0.42(0.06~3.09) 0.396 血钠 1.03(0.99~1.08) 0.166 EB病毒感染 0.54(0.13~2.25) 0.399 血钙 1.37(0.7~2.67) 0.362 慢性呼吸系统疾病史 0.56(0.17~1.81) 0.331 血清清蛋白 0.87(0.8~0.94) 0.001 高血压史 1.54(0.7~3.37) 0.281 血小板计数 0.99(0.99~1.00) 0.319 糖尿病史 0.90(0.47~1.76) 0.766 高敏肌钙蛋白Ⅰ 1.00(0.99~1.00) 0.506 冠心病史 0.75(0.37~1.52) 0.423 尿素氮 1.04(1.01~1.07) 0.008 脑卒中史 1.39(0.71~2.7) 0.333 肌酐 1.00(1.00~1.00) 0.01 恶性肿瘤史 0.86(0.41~1.82) 0.695 乳酸 1.14(0.99~1.32) 0.072 体温 1.24(0.83~1.86) 0.302 D-二聚体 1.09(1.05~1.14) < 0.001 脉搏 1.01(0.99~1.03) 0.238 丙氨酸转氨酶 0.99(0.99~1.01) 0.466 呼吸频率 1.05(1.00~1.09) 0.035 天冬氨酸转氨酶 1.00(0.99~1.00) 0.884 平均动脉压 0.99(0.97~1.01) 0.878 γ-谷氨酰转肽酶 1.00(0.99~1.00) 0.787 氧合指数 0.99(0.98~0.99) 0.041 总胆红素 1.01(0.98~1.04) 0.586 二氧化碳分压 0.98(0.94~1.01) 0.167 血糖 1.04(0.99~1.1) 0.137 白细胞计数 1.08(1.03~1.14) 0.002 机械通气时长 1.01(0.98~1.04) 0.599 淋巴细胞计数 0.95(0.38~2.35) 0.908 抗菌药物使用时长 0.97(0.94~1.02) 0.217 中性粒细胞与淋巴细胞比值 1.01(1.00~1.02) 0.046 糖皮质激素使用时长 0.96(0.90~1.02) 0.159 降钙素原 1.01(0.99~1.02) 0.374 呼吸道CRAB定植 2.91(1.52~5.58) 0.001 注:*表示与不吸烟组比较。 表 3 ICU重型/危重型新冠肺炎患者呼吸道CRAB定植与28天病死率的Cox多因素回归分析
Table 3 Cox multivariate regression analysis on respiratory CRAB colonization and 28-day mortality in severe/critical COVID -19 ICU patients
校正模型 HR(95%CI) P 未调整前 2.91(1.52~5.58) 0.001 调整模型1 2.92(1.66~5.90) 0.001 调整模型2 2.61(1.33~5.14) 0.005 调整模型3 2.51(1.24~5.08) 0.011 调整模型4 2.54(1.15~5.58) 0.021 调整模型5 1.99(0.87~4.53) 0.101 -
[1] 杨启文, 吴安华, 胡必杰, 等. 临床重要耐药菌感染传播防控策略专家共识[J]. 中国感染控制杂志, 2021, 20(1): 1-14. doi: 10.12138/j.issn.1671-9638.20218124 Yang QW, Wu AH, Hu BJ, et al. Expert consensus on strate- gies for the prevention and control of spread of clinically important antimicrobial-resistant organisms[J]. Chinese Journal of Infection Control, 2021, 20(1): 1-14. doi: 10.12138/j.issn.1671-9638.20218124 [2] 丁丽, 陈佰义, 李敏, 等. 碳青霉烯类耐药革兰阴性菌联合药敏试验及报告专家共识[J]. 中国感染与化疗杂志, 2023, 23(1): 80-90. Ding L, Chen BY, Li M, et al. Expert consensus on antimicrobial synergy testing and reporting of carbapenem-resistant Gram-negative bacteria[J]. 2023, 23(1): 80-90. [3] Rangel K, De-Simone SG. Acinetobacter baumannii during COVID -19: what is the real pandemic?[J]. Pathogens, 2022, 12(1): 41. doi: 10.3390/pathogens12010041 [4] Langford BJ, Soucy JPR, Leung V, et al. Antibiotic resistance associated with the COVID -19 pandemic: a systematic review and Meta-analysis[J]. Clin Microbiol Infect, 2023, 29(3): 302-309. doi: 10.1016/j.cmi.2022.12.006 [5] Ellis RC, Roberts EK, Grier JT, et al. Acinetobacter bauma-nnii infections that are resistant to treatment: warning signs from the COVID -19 pandemic[J]. Future Microbiol, 2022, 17: 1345-1347. doi: 10.2217/fmb-2022-0153 [6] Chatterjee N, Nirwan PK, Srivastava S, et al. Trends in carbapenem resistance in pre-COVID and COVID times in a tertiary care hospital in North India[J]. Ann Clin Microbiol Antimicrob, 2023, 22(1): 1. doi: 10.1186/s12941-022-00549-9 [7] 孙国先, 刘微丽, 郑庆斌, 等. PCT与SDI比值对重症细菌性肺炎患者短期预后的预测价值[J]. 中国感染控制杂志, 2022, 21(9): 885-890. doi: 10.12138/j.issn.1671-9638.20222643 Sun GX, Liu WL, Zheng QB, et al. Predictive value of PCT/SDI ratio for short-term prognosis of patients with severe bacterial pneumonia[J]. Chinese Journal of Infection Control, 2022, 21(9): 885-890. doi: 10.12138/j.issn.1671-9638.20222643 [8] 李欣洁. 成人重症COVID -19患者临床转归影响因素研究[D]. 北京: 北京大学, 2022. Li XJ. Investigation of risk factors affecting disease clinical outcomes among adult severe COVID -19[D]. Beijing: Peking University, 2022. [9] 彭驰, 齐戈尧, 张晨旭, 等. 基于机器学习算法的新型冠状病毒肺炎患者院内结局预测[J]. 第二军医大学学报, 2021, 42(10): 1115-1123. Peng C, Qi GY, Zhang CX, et al. Prediction of in-hospital clinical outcomes of coronavirus disease 2019 patients based on machine learning algorithms[J]. Academic Journal of Second Military Medical University, 2021, 42(10): 1115-1123. [10] 杨惠安, 俞晓玲, 黄水文, 等. 国家早期预警评分2联合血乳酸预测重症社区获得性肺炎患者短期预后的价值[J]. 中国感染控制杂志, 2023, 22(2): 200-207. doi: 10.12138/j.issn.1671-9638.20233398 Yang HA, Yu XL, Huang SW, et al. Value of national early warning score 2 combined with blood lactic acid in predicting short-term prognosis of patients with severe community-ac-quired pneumonia[J]. Chinese Journal of Infection Control, 2023, 22(2): 200-207. doi: 10.12138/j.issn.1671-9638.20233398 [11] 刘自强, 缪锦峰, 邹琼, 等. 新型冠状病毒肺炎患者发生复合终点事件危险因素的Meta分析[J]. 临床荟萃, 2020, 35(9): 773-782. Liu ZQ, Miao JF, Zou Q, et al. Risk factors for composite end point events in patients with coronavirus disease 2019: a Meta-analysis[J]. Clinical Focus, 2020, 35(9): 773-782. [12] 黄明月. 安徽省新型冠状病毒肺炎病例临床特征与重症病例危险因素研究[D]. 合肥: 安徽医科大学, 2022. Huang MY. Study on the clinical characteristics and risk factors of severe COVID -19 cases in Anhui Province[D]. Hefei: Anhui Medical University, 2022. [13] Jaddoe VWV, de Jonge LL, Hofman A, et al. First trimester fetal growth restriction and cardiovascular risk factors in school age children: population based cohort study[J]. BMJ, 2014, 348: g14. doi: 10.1136/bmj.g14 [14] Bartal C, Rolston KVI, Nesher L. Carbapenem-resistant Acinetobacter baumannii: colonization, infection and current treatment options[J]. Infect Dis Ther, 2022, 11(2): 683-694. doi: 10.1007/s40121-022-00597-w [15] Zeng M, Xia J, Zong ZY, et al. Guidelines for the diagnosis, treatment, prevention and control of infections caused by carbapenem-resistant Gram-negative bacilli[J]. J Microbiol Immunol Infect, 2023, 56(4): 653-671. doi: 10.1016/j.jmii.2023.01.017 [16] Mumcuoġlu İ, Çaġlar H, Erdem D, et al. Secondary bacte-rial infections of the respiratory tract in COVID -19 patients[J]. J Infect Dev Ctries, 2022, 16(7): 1131-1137. doi: 10.3855/jidc.16724 [17] Alenazi TA, Shaman MSB, Suliman DM, et al. The impact of multidrug-resistant Acinetobacter baumannii infection in critically ill patients with or without COVID -19 infection[J]. Healthcare (Basel), 2023, 11(4): 487. [18] 张华容, 吕宇, 江小燕. 耐碳青霉烯类鲍曼不动杆菌重症监护感染患者30天死亡风险及其危险因素研究[J]. 华西医学, 2023, 38(3): 358-363. Zhang HR, Lv Y, Jiang XY. 30-day mortality risk and risk factors of patients with carbapenem resistant Acinetobacter baumannii in intensive care unit[J]. West China Medical Journal, 2023, 38(3): 358-363. [19] 李旋. 重症COVID -19患者合并鲍曼不动杆菌感染的临床特征分析及M-ROSE的临床应用价值[D]. 苏州: 苏州大学, 2023. Li X. Analysis of clinical characteristics of severe COVID -19 patients with Acinetobacter baumannii infection and the clinical application value of M-ROSE[D]. Suzhou: Soochow University, 2023. [20] Hafiz TA, Alghamdi SS, Mubaraki MA, et al. A two-year retrospective study of multidrug-resistant Acinetobacter baumannii respiratory infections in critically Ill patients: clinical and microbiological findings[J]. J Infect Public Health, 2023, 16(3): 313-319. doi: 10.1016/j.jiph.2023.01.004 [21] Montrucchio G, Corcione S, Lupia T, et al. The burden of carbapenem-resistant Acinetobacter baumannii in ICU COVID -19 patients: a regional experience[J]. J Clin Med, 2022, 11(17): 5208. doi: 10.3390/jcm11175208 [22] Boral J, Genç Z, Pınarlık F, et al. The association between Acinetobacter baumannii infections and the COVID -19 pandemic in an intensive care unit[J]. Sci Rep, 2022, 12(1): 20808. doi: 10.1038/s41598-022-25493-8 [23] Mansournia MA, Nazemipour M. Recommendations for accurate reporting in medical research statistics[J]. Lancet, 2024, 403(10427): 611-612. doi: 10.1016/S0140-6736(24)00139-9 [24] Agoritsas T, Merglen A, Shah ND, et al. Adjusted analyses in studies addressing therapy and harm: users' guides to the medical literature[J]. JAMA, 2017, 317(7): 748-759. doi: 10.1001/jama.2016.20029 [25] 熊金蓉, 朱耀国, 刘胜军, 等. 不同性别新型冠状病毒肺炎患者临床特征的比较[J]. 武汉大学学报(医学版), 2021, 42(1): 15-18. Xiong JR, Zhu YG, Liu SJ, et al. Comparison of the clinical characteristics of COVID -19 patients between different genders[J]. Medical Journal of Wuhan University, 2021, 42(1): 15-18. [26] 何磊, 姜道彬. 耐碳青酶烯类鲍曼不动杆菌感染患者死亡危险因素调查[J]. 广西医科大学学报, 2020, 37(5): 917-921. He L, Jiang DB. Investigation on risk factors of death in patients with carbapenem-resistant Acinetobacter baumannii infection[J]. Journal of Guangxi Medical University, 2020, 37(5): 917-921. [27] 杨舒雯, 许雪, 汪逸轩, 等. 长期未转阴新型冠状病毒肺炎患者血清白蛋白水平与病毒转阴的因果关系探索[J]. 传染病信息, 2022, 35(5): 399-403. Yang SW, Xu X, Wang YX, et al. Exploration on the causal relationship between serum albumin level and virus negative conversion in patients with long-term non-converted COVID -19[J]. Infectious Disease Information, 2022, 35(5): 399-403. [28] 王铭, 程振豪, 胡苗, 等. 基于XGBoost的COVID -19患者重症风险早期预测模型的建立与评价[J]. 陆军军医大学学报, 2022, 44(3): 195-202. Wang M, Cheng ZH, Hu M, et al. Early prediction model for disease progression of COVID -19 patients based on XGBoost: establishment and evaluation[J]. Journal of Army Medical University, 2022, 44(3): 195-202. [29] 谢情情. 鲍曼不动杆菌感染诱导的宿主肺部免疫微环境动态变化研究[D]. 济南: 山东大学, 2023. Xie QQ. Dynamic changes of host pulmonary immune microenvironment induced by Acinetobacter baumannii infection[D]. Jinan: Shandong University, 2023. [30] Quinn B, Rodman N, Jara E, et al. Human serum albumin alters specific genes that can play a role in survival and persis-tence in Acinetobacter baumannii[J]. Sci Rep, 2018, 8(1): 14741. doi: 10.1038/s41598-018-33072-z [31] 曹志龙, 韩旭东, 张素燕, 等. NLR、D-二聚体、CRP、PCT对新型冠状病毒肺炎病情进展的预测价值[J]. 交通医学, 2020, 34(5): 463-466, 469. Cao ZL, Han XD, Zhang SY, et al. The value of NLR, D-dimer, CRP and PCT in predicting the progression of COVID -19 patients[J]. Medical Journal of Communications, 2020, 34(5): 463-466, 469. [32] 夏文亚, 甘言刚, 陈安珉, 等. SⅡ、NLR、肌酐和CRP对新冠肺炎患者并发AKI的预测价值[J]. 徐州医科大学学报, 2021, 41(10): 753-758. Xia WY, Gan YG, Chen AM, et al. Predictive value of SⅡ, NLR, creatinine and CRP on COVID -19 patients with AKI[J]. Journal of Xuzhou Medical University, 2021, 41(10): 753-758. [33] Fang XY, Li S, Yu H, et al. Epidemiological, comorbidity factors with severity and prognosis of COVID -19: a systematic review and Meta-analysis[J]. Aging (Albany NY), 2020, 12(13): 12493-12503.

 下载:
下载: