Diagnostic criteria and their evolution for invasive fungal disease in non-neutropenia patients
-
摘要: 侵袭性真菌病(IFD)是一组由真菌引起的严重感染性疾病, 近年来发病率呈上升趋势。传统上, IFD的诊断标准主要针对中性粒细胞缺乏(粒缺)患者, 然而, 临床实践发现, 越来越多IFD患者的基础疾病并非粒缺, 更多是慢性阻塞性肺疾病(COPD)、重症病毒性肺炎、糖尿病等非粒缺患者, 其临床特征、影像学表现、实验室检查、诊断标准都与粒缺患者存在明显不同。本文对非粒缺患者IFD诊断标准及其变迁, 尤其是与粒缺患者的差异进行全面阐述, 以期为临床正确诊断IFD提供参考。Abstract: Invasive fungal disease (IFD) is a group of serious infectious diseases caused by fungi. In recent years, its incidence has shown an upward trend. Traditionally, the diagnostic criteria for IFD primarily target patients with neutropenia. However, in clinical practice, more and more IFD patients do not have neutropenia as their underlying disease. Instead, they are non-neutropenic patients with high-risk factors such as chronic obstructive pulmonary di-sease (COPD), severe viral pneumonia, and diabetes, etc. Their clinical features, imaging manifestations, laboratory tests, and diagnostic criteria are significantly different from those of neutropenic patients. This article comprehensively expounds the diagnostic criteria and their evolution for IFD in non-neutropenic patients, especially highligh-ting the differences from neutropenic patients, so as to provide a reference for the correct clinical diagnosis of IFD.
-
Keywords:
- invasive fungal disease /
- neutropenia /
- non-neutropenia /
- diagnostic criteria
-
侵袭性真菌病(invasive fungal disease, IFD)是一组由真菌引起的严重感染性疾病,近年来发病率呈上升趋势,尤其在免疫功能受损人群中更为常见。近期,流行性感冒(简称流感)后继发曲霉感染的暴发流行显著提升了临床各科医生对真菌病的认识。传统IFD诊断标准主要针对中性粒细胞缺乏(简称“粒缺”)患者,特别是血液系统恶性肿瘤和异基因骨髓干细胞移植的患者。然而,随着临床实践的发展,越来越多IFD患者的基础疾病为慢性阻塞性肺疾病(COPD)、重症病毒性肺炎、糖尿病等非粒缺状态患者。这些患者在临床特征、影像学表现、实验室检查及诊断标准方面均与粒缺患者存在明显不同,进而导致抗真菌治疗策略的调整。本文系统梳理非粒缺患者IFD诊断标准及其变迁,重点对比其与粒缺患者的差异及潜在机制,以期为临床规范、正确诊断IFD提供参考。
1. 流行病学
世界卫生组织(WHO)于2022年首次发布的《真菌重点病原谱清单》(FPPL)[1]将临床重点真菌病原体分为三个优先等级。①严重优先级(4种):新生隐球菌、耳念珠菌、烟曲霉和白念珠菌。②高度优先级(7种):光滑念珠菌、组织胞浆菌属、真菌性足菌肿病原体、毛霉目、镰刀菌属、热带念珠菌、近平滑念珠菌。③中等优先级(8种):赛多孢霉属、多育节荚孢霉、球孢子菌属、克柔念珠菌、格特隐球菌、马尔尼菲篮状菌、耶氏肺孢子菌,副球孢子菌属。该清单为IFD防治策略的制定提供了重要参考。
多年来,人们关注血液病患者罹患IFD,是因为粒缺为继发真菌感染的确切高危状态。但中国2011年一项历时10年(1997—2008年)的回顾性调查显示,474例临床确诊的肺真菌病,排前5位的依次是肺曲霉病、肺念珠菌病、肺隐球菌病、肺孢子菌病、肺毛霉病,基础疾病以实体肿瘤、COPD、肺结核、糖尿病为主[2]。最新全球严重真菌病的发病率和死亡率的调查[3]结果显示,2013—2023年全球每年IFD新发病例超过655万例,相关死亡达375万例。其中两个重要发现值得关注:①年发病率依次为侵袭性曲霉病(IA)、慢性肺曲霉病(CPA)、念珠菌血症/侵袭性念珠菌病(IC)、肺孢子菌肺炎(PJP)、隐球菌脑膜炎和毛霉病等,IA发病率居首位,但第2位是CPA,这与国内感染界的认知存在差异,似乎国内CPA的发病率非常低(国内暂无此方面的流行病学数据,真实情况不清楚)。②IA的高危因素中COPD和入住重症监护病房(ICU)重症患者两者合计占比超90%,而基础疾病为血液系统恶性肿瘤的占比非常低。造成此差异的可能机制包括:非血液病患者IFD临床表现不典型,患者基础疾病多样,实验室检测敏感性不足,抗真菌药物可及性差,临床医生对真菌感染的认识不足,以及相关指南的影响。除IA之外,IC也应引起临床的关注,全球每年超过1 565 000例患者罹患IC,致病菌仍以白念珠菌为主,其次为近平滑念珠菌、热带念珠菌、光滑念珠菌及克柔念珠菌;近年严重耐药的耳念珠菌也应引起重视[3]。
病死率的评估结果符合一般认知:IA的年粗死亡人数最高,其次为念珠菌血症/IC,随后是CPA、PJP、隐球菌脑膜炎等[3]。值得注意的是,非粒缺患者IFD病死率高于粒缺患者。一项单中心回顾性研究[4]结果显示,1998—2003年88例IA患者住院期间,非粒缺患者的病死率高于粒缺患者(89% VS 60%,P=0.007),其中慢性呼吸道疾病亚组的病死率最高(89%),治疗差异可能与非粒缺患者诊断延迟、抗真菌治疗延误有关。接受抗真菌治疗与未治疗的比例如下:血液系统疾病合并IA为10 ∶1,COPD与ICU重症患者合并IA分别为1 ∶5和1 ∶3,念珠菌血症为9 ∶1,IC为1 ∶5。COPD、ICU重症患者合并IA,以及IC未治疗比例高,这种治疗差异与非粒缺患者诊断延误,没有诊断的金标准,以及缺乏针对各种不同基础疾病的IFD患者诊治指南等相关[3, 5]。
上述流行病学特征提示,非粒缺患者IFD具有危险因素多样、临床特征不典型、实验室检查敏感性低,以及诊断与治疗都存在延误的特点,需要临床认真思考诊断标准存在的问题与改进的方向,建立针对性的诊断标准和治疗规范。
2. 危险(宿主)因素
2.1 危险(宿主)因素的变迁
传统观点认为,侵袭性肺曲霉病(IPA)的宿主危险因素主要集中在血液系统疾病,如粒缺、异基因骨髓干细胞移植、血液系统恶性肿瘤、移植物抗宿主病等,仅少数与糖皮质激素应用、T淋巴细胞或B淋巴细胞免疫抑制剂治疗等有关。随着人口老龄化和免疫抑制治疗人群增多,大量循证医学证据表明,非粒缺患者多样化的基础疾病已成为IPA的重要危险因素。COPD[6]、重症病毒性肺炎[流感和新型冠状病毒感染(COVID-19)][7-9]、糖尿病[10]等本身就是罹患IPA的独立危险因素。COPD伴IPA的危险因素可分为两类[6]:疾病本身相关因素,包括肺功能差、过去3个月内发生重度急性加重;治疗相关因素包括糖皮质激素、广谱抗菌药物的应用。我国研究[11]发现,综合评估肺功能GOLD Ⅲ-Ⅳ级、近1个月内使用广谱抗菌药物>10 d、近3个月使用糖皮质激素(泼尼松)>265 mg、血清清蛋白<30 g/L(营养不良),可用于预测COPD患者IPA的发生风险。呼吸道病毒感染也是IA的重要危险因素。一项回顾性队列研究纳入432例入住ICU的流感患者,结果显示,流感是罹患IPA的独立危险因素[7]。类似地,重症COVID -19患者也易合并IPA和肺毛霉病(PM)[8]。Bassetti等[12]定义非粒缺ICU成人感染IA的危险因素为流感、COVID -19、中重度COPD、失代偿性肝硬化、未控制的人类免疫缺陷病毒(HIV)感染、实体肿瘤。对于IC,危险因素包括使用广谱抗菌药物、糖皮质激素和其他免疫调节药物,输血,念珠菌定植,中心静脉置管,全肠外营养等[5]。主要集中在两点:一是免疫功能低下导致全身性感染的风险增加,二是念珠菌的定植加上皮肤黏膜屏障的破坏。此外,根据免疫功能损伤程度,非粒缺患者IFD危险因素可分为高、中、低风险(见表 1)[8, 13],同一患者可能同时存在多种不同危险因素,从而使IFD易感性的判定更为困难,需综合评估感染风险。
表 1 罹患IFD危险因素分级Table 1 Classification of risk factors for IFD风险等级 危险因素 高风险 ·中性粒细胞减少症(<500中性粒细胞/mm3) ·血液恶性肿瘤 ·同种异体骨髓移植 ·机械通气 中风险 ·长期使用糖皮质激素治疗(特别是>3周或高剂量) ·自体骨髓移植 ·COPD ·肝硬化 ·实体器官癌症 ·HIV感染 ·肺移植 ·需要免疫制剂治疗的全身性疾病 ·使用广谱抗菌药物治疗 ·入院时呼吸衰竭 低风险 ·严重烧伤 ·其他器官移植受者(如接受心脏、肾脏或肝脏移植) ·持续时间<7 d的糖皮质激素治疗 ·ICU住院时间延长(>21 d) ·营养不良 ·心脏术后情况 2.2 不同真菌病的危险因素差异
不同真菌导致IFD的危险因素同样存在差异。如IA最常见于粒缺患者,毛霉病最常见于糖尿病酮症酸中毒患者,IC最常见于皮肤黏膜屏障破坏患者,而我国肺隐球菌病一半以上见于无明显基础疾病的患者。表 2列出不同侵袭性肺部真菌病(IPFD)对应的高危因素[14],可供参考。
表 2 不同IPFD的高危因素Table 2 High risk factors for different IPFDsIPFD类型 高危因素 IPA 血液系统恶性肿瘤、再生障碍性贫血、造血干细胞移植受者、肺移植受者、重症流感或严重COVID -19、慢性肉芽肿性疾病、使用大剂量糖皮质激素或长期使用免疫抑制剂治疗、结构性肺损伤、COPD、既往肺结核、支气管扩张、结节病 肺隐球菌病 HIV感染、肺结核、肝病、糖尿病、肾病、恶性肿瘤患者,接受糖皮质激素或免疫抑制剂治疗,接触土壤或鸟类粪便者,健康个体也常罹患本病 PJP HIV感染患者、器官移植受者、白血病和淋巴瘤患者、自身免疫疾病、使用大剂量糖皮质激素、长期使用免疫抑制剂和肿瘤患者 肺毛霉病 糖尿病、血液恶性肿瘤、实体器官或造血干细胞移植受者 地方性真菌病 地方性真菌病流行区的旅行史或居民(如马尔尼菲篮状菌多见于两广和云南地区,组织胞浆菌多见于长江流域),HIV感染患者及其他免疫功能受损人群 念珠菌肺炎 入住ICU、留置中心静脉导管、全胃肠外营养、急性肾损伤、脓毒性休克病史、氨基糖苷类抗菌药物暴露 其他少见真菌病 血液系统恶性肿瘤、入住ICU、长期使用抗菌药物、留置中心静脉导管、具有特定遗传易感性的人群 3. 临床特征与发病机制
3.1 临床特征
与粒缺比较,非粒缺患者IFD的临床表现常不典型。一项研究[4]比较88例IA患者的临床特征,发现非粒缺患者发热、咳嗽、胸痛较少见,而呼吸困难相对多见。非粒缺患者的影像学也很少出现晕轮征、楔形改变和空气新月征等特征性病变,常见实变、结节、空洞、树芽征、中央型支气管扩张等非特征性改变[15-17]。实验室血清半乳甘露聚糖检测(GM)试验阳性率不高,仅仅支气管肺泡灌洗液(BALF)中GM阳性有较大参考价值。研究[18]评估128例临床疑似非粒缺IPA患者BALF和血清GM检测结果,显示BALF GM检测具有更高的诊断价值。
3.2 发病机制
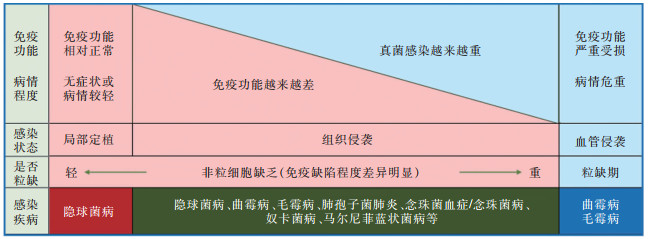
粒缺属于典型的重度免疫缺陷,易罹患IFD且病情危重;但非粒缺患者的基础疾病多样,免疫受损程度差异极大,从基本正常到严重缺陷,尤其轻到中度免疫受损的变异度大,从而导致疾病严重程度、临床特征存在明显差异[15, 19]。见图 1。
最典型的是曲霉病,根据免疫受损的程度不同,可以表现为:①急性IA(AIA),包括IPA、肺外曲霉病,见于重度免疫抑制患者(尤其是粒缺患者);②CPA,包括慢性坏死性肺曲霉病(CNPA)/亚急性IPA(SIPA)、慢性纤维化性肺曲霉病(CFPA)、慢性空洞性肺曲霉病(CCPA)、曲霉球,见于轻中度免疫抑制患者;③非IA,包括甲曲霉病、耳曲霉病,曲霉角膜炎、鼻窦炎,见于轻度免疫抑制患者;④变态反应性曲霉病,包括变应性鼻窦炎、严重哮喘,最重要的是变应性支气管-肺曲霉病(ABPA),见于对曲霉严重过敏的患者[20]。
4. 诊断标准及其变迁
4.1 诊断标准的历史发展
2002年Ascioglu等[21]提出了IFD的诊断框架,将诊断分为三级:确诊(proven,宿主因素+临床特征+微生物学+组织病理学)、临床诊断(probable,宿主因素+临床特征+微生物学)和拟诊(possible,宿主因素+临床特征)。2008年欧洲癌症研究和治疗组织/侵袭性真菌感染协作组(EORTC/MSG)明确了侵袭性真菌感染(IFI)疾病定义,目的是为临床研究提供IFI不同诊断级别的定义(确诊、临床诊断、拟诊)[22],此定义的初始目的并不是指导临床实践,而是为了流行病学调查,评价抗真菌药物和实验室诊断试验,最常见的临床研究对象就是容易入选的粒缺继发IA的病例。从此点可以看出,初始的IFD诊断标准是更适合IA的。此标准提出后对临床实践诊断IFD起了积极的作用,也得到了临床的大力推广应用。
4.2 非粒缺患者诊断标准的变迁
EORTC/MSG提出的IFD分层诊断标准自2008年发布以来,在全球范围内得到广泛应用。然而,随着临床实践的发展,内科、感染科、呼吸科、老年科及ICU医生逐渐发现,IA的高发人群非传统的粒缺患者,通常是非粒缺患者,无血液系统疾病患者群体。随后越来越多的循证医学证据也证实,非粒缺与粒缺患者IFD的诊疗思路存在较大差异,原有的EORTC/MSG诊断标准并不完全适用于非粒缺患者[23]。如IA传统上主要见于经典高危人群(如血液病或实体器官移植患者),而非粒缺(如ICU、COPD)患者罹患IPA时很少见到典型的影像学特征(如晕轮征或空气新月征),基于非培养的检测方法(如GM试验和分子生物学检测)非粒缺患者比经典高危人群的准确性更低;又如临床怀疑IC而患者既不符合确诊标准也不符合临床诊断标准时,确认IC更加困难[12]。特别是重症患者,由于血流动力学不稳定、机械通气或凝血机制障碍,导致活检获取感染部位标本行组织学、病理学检查“确诊”难以做到。另一方面,不同真菌感染应用同一诊断标准亦存在许多问题,从而开始提出不同的基础疾病(如COPD、ICU重症患者等) 合并IFD应有各自的诊断标准;同样,不同真菌感染(如曲霉、肺孢子菌等)也应有相应的诊断标准。
此后,新的指南与专家共识不断发布,给临床提供了极大地帮助与指导。美国、欧洲、中国等都有更为详细的、针对性的共识指南问世及更新,特别是针对非粒缺患者IFD的诊治。一是以疾病为基础合并IFD的指南:COPD合并曲霉感染[6]、病毒性肺炎(流感和COVID -19)合并真菌感染[8-9, 16]、糖尿病合并真菌感染、ICU重症患者合并真菌感染[12]、器官移植受者合并真菌感染等;二是以致病真菌为基础的指南:曲霉病指南[20]、CPA指南、念珠菌病指南[5, 24]、肺孢子菌病指南、隐球菌病指南[25]、毛霉病指南[26-27]、少见真菌病指南[28-30]等。对于非粒缺重症患者,符合确诊标准的IFD,如活检组织真菌病理学阳性或无菌部位标本真菌培养阳性,则不论其免疫功能状态如何、有无宿主危险因素和特征性影像学改变。符合临床诊断标准的IPA,只要BALF曲霉培养阳性,结合显微镜检发现分叉的菌丝,也不需要具备宿主危险因素,影像学改变可以是非特异性的。应用此标准诊断IPA的灵敏度高达92%,特异度达61%[31]。在IFD的实验室诊断中,目前国际指南对分子生物学检测[主要是聚合酶链式反应(PCR)、DNA测序]的临床应用价值仍采取谨慎的态度,需在确诊患者中进一步验证,是未来研究的重要方向[12]。临床医生可以参考相应指南提供的细致而精准的各种IFD诊断标准。
以2024年由欧洲临床微生物学和感染病学会危重症患者感染研究组(ESGCIP)、欧洲临床微生物和感染病学会真菌感染研究组(EFISG)、欧洲重症监护医学学会(ESICM)等多个国际组织共同制定发布的《重症监护病房成年患者侵袭性真菌病(FUNDICU)共识定义》为例,该共识为非粒缺ICU患者IFD诊断提供的新框架和诊疗思路[12]。非粒缺ICU患者IA的确诊标准为至少有以下一种[11]:①通过活检或针吸从正常无菌部位或肺部获得的标本,组织学或细胞病理学证据显示存在组织侵袭;结合与曲霉相符的菌丝检测(通过培养或PCR证实)。②从与感染过程一致的病变处或正常无菌部位(通过活检或针吸)获得的标本中培养出曲霉属。临床诊断IPA和临床诊断气管支气管曲霉病(TBA)的定义需满足以下条件:至少一种相符的症状或体征,至少一种ICU宿主因素,至少一项临床标准,至少一项真菌学标准。具体标准为有以下合并症状和体征之一:①接受适当的抗菌药物治疗至少3 d后仍持续发热(≥38.3℃);②使用抗菌药物且无其他明显原因的情况下,退热至少48 h后再次发热;③胸膜炎性胸痛;④胸膜摩擦音;⑤呼吸困难;⑥咳血;⑦尽管有适当的抗菌药物治疗和通气支持,呼吸功能不全仍在恶化。有至少一种以下ICU宿主因素:①流感;②COVID -19;③中度或重度COPD;④失代偿性肝硬化;⑤HIV感染未得到控制且CD4+T淋巴细胞计数<200/mm3;⑥实体肿瘤。有至少一种临床标准:①支气管镜检查中存在气管支气管溃疡,和/或结节、假膜、斑块、焦痂(用于诊断TBA);②胸部CT显示存在肺部浸润,或非其他原因导致的空洞(用于诊断IPA)。有至少一项真菌学标准:①BALF中显微镜下检出霉菌成分;②BALF中曲霉培养阳性;③血清GM>0.5 ODI;④BALF GM≥1.0 ODI。其中,临床诊断(probable)一定是建立在综合评估的基础之上。
4.3 非粒缺患者诊断分级的变迁
近年来,不断有临床研究探讨非粒缺患者是否需要“拟诊”这个级别的诊断标准,因为在没有典型宿主因素、临床表现不典型和诊断标志物敏感性低的情况下,要区分是真菌定植还是感染更加困难;同时难以控制的混杂因素也容易导致临床过度早期经验性治疗。临床研究也证实“拟诊”有可能导致难以接受的风险(如对极大比例非感染患者进行经验性治疗,尤其是IC拟诊患者)。因此,2024年发布的国际成人ICU患者IFD定义[12]在诊断IA和IC时不再使用拟诊的诊断标准。当然,定义也指出并不反对在特殊情况下(如COVID -19相关性肺曲霉病)采用其他指南制定的拟诊标准进行判定。此外,对于非粒缺患者,由于存在血管侵袭期的延迟(甚至不发生),无论是成人ICU患者还是重症病毒性肺炎(流感或COVID -19)都建议将继发的IA细分为更精准的IPA/TBA,并分别给出诊断标准以利于临床治疗[9, 12]。
从以上指南可以看出,非粒缺患者有更多的机会、也更需要实施有创检查(特别是支气管镜检查)以获得更可靠的感染部位标本,进行更精准的病原学检测。临床医生诊断IFD,需具有更高的警觉性,进行更多维度的详细分析(危险因素、临床表现、影像学特征和微生物学证据),制定更加精准的诊断标准,结合临床进行综合判断。
5. 诊断路径和流程
非粒缺患者IFD的诊断路径应关注以下要点[15]。(1)提高警惕:关注不同的危险因素;(2)影像改变:认识非典型表现;(3)病原检测:注重经气管镜检查获取标本;(4)诊断流程:根据不同基础疾病和不同病原体采用差异化诊断策略。具体诊断流程包括:熟悉不同基础疾病罹患IFD的危险因素和不同真菌感染的特殊危险因素;对于疑似IFD的非粒缺患者,应尽早行病灶部位的CT检查(尤其是胸部CT),即使表现不典型也不能除外;实验室检测血清GM试验敏感性低,推荐BALF GM检测,必要时采用分子生物学技术;特别强调气管镜检查镜下观察气道病变和获取BALF进行病原学检测的重要性;熟悉并借鉴不同真菌感染指南和共识的诊疗路径指导临床实践。
非粒缺患者IFD诊断思路有别于粒缺患者,需要更为精确的诊断标准与临床思维[15]。未来研究方向应包括完善更适合非粒缺患者的诊断标准和开发新的生物标志物,优化影像学诊断标准,提高对非典型表现的识别能力,探索新的分子诊断技术在IFD中的应用,建立针对不同基础疾病的特殊人群诊断流程,开展多中心临床研究,验证现有诊断标准在不同人群中的适用性,将有助于提高此类患者的早期诊断率和治疗成功率。
利益冲突:所有作者均声明不存在利益冲突。
-
表 1 罹患IFD危险因素分级
Table 1 Classification of risk factors for IFD
风险等级 危险因素 高风险 ·中性粒细胞减少症(<500中性粒细胞/mm3) ·血液恶性肿瘤 ·同种异体骨髓移植 ·机械通气 中风险 ·长期使用糖皮质激素治疗(特别是>3周或高剂量) ·自体骨髓移植 ·COPD ·肝硬化 ·实体器官癌症 ·HIV感染 ·肺移植 ·需要免疫制剂治疗的全身性疾病 ·使用广谱抗菌药物治疗 ·入院时呼吸衰竭 低风险 ·严重烧伤 ·其他器官移植受者(如接受心脏、肾脏或肝脏移植) ·持续时间<7 d的糖皮质激素治疗 ·ICU住院时间延长(>21 d) ·营养不良 ·心脏术后情况 表 2 不同IPFD的高危因素
Table 2 High risk factors for different IPFDs
IPFD类型 高危因素 IPA 血液系统恶性肿瘤、再生障碍性贫血、造血干细胞移植受者、肺移植受者、重症流感或严重COVID -19、慢性肉芽肿性疾病、使用大剂量糖皮质激素或长期使用免疫抑制剂治疗、结构性肺损伤、COPD、既往肺结核、支气管扩张、结节病 肺隐球菌病 HIV感染、肺结核、肝病、糖尿病、肾病、恶性肿瘤患者,接受糖皮质激素或免疫抑制剂治疗,接触土壤或鸟类粪便者,健康个体也常罹患本病 PJP HIV感染患者、器官移植受者、白血病和淋巴瘤患者、自身免疫疾病、使用大剂量糖皮质激素、长期使用免疫抑制剂和肿瘤患者 肺毛霉病 糖尿病、血液恶性肿瘤、实体器官或造血干细胞移植受者 地方性真菌病 地方性真菌病流行区的旅行史或居民(如马尔尼菲篮状菌多见于两广和云南地区,组织胞浆菌多见于长江流域),HIV感染患者及其他免疫功能受损人群 念珠菌肺炎 入住ICU、留置中心静脉导管、全胃肠外营养、急性肾损伤、脓毒性休克病史、氨基糖苷类抗菌药物暴露 其他少见真菌病 血液系统恶性肿瘤、入住ICU、长期使用抗菌药物、留置中心静脉导管、具有特定遗传易感性的人群 -
[1] World Health Organization. WHO fungal priority pathogens list to guide research, development and public health action[EB/OL]. (2022-10-25)[2025-03-28]. https://www.who.int/publications/i/item/9789240060241. [2] 刘又宁, 佘丹阳, 孙铁英, 等. 中国1998年至2007年临床确诊的肺真菌病患者的多中心回顾性调查[J]. 中华结核和呼吸杂志, 2011, 34(2): 86-90. Liu YN, She DY, Sun TY, et al. A multicentre retrospective study of pulmonary mycosis clinically proven from 1998 to 2007[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2011, 34(2): 86-90. [3] Denning DW. Global incidence and mortality of severe fungal disease[J]. Lancet Infect Dis, 2024, 24(7): e428-e438. doi: 10.1016/S1473-3099(23)00692-8 [4] Cornillet A, Camus C, Nimubona S, et al. Comparison of epidemiological, clinical, and biological features of invasive aspergillosis in neutropenic and nonneutropenic patients: a 6-year survey[J]. Clin Infect Dis, 2006, 43(5): 577-584. doi: 10.1086/505870 [5] Cornely OA, Sprute R, Bassetti M, et al. Global guideline for the diagnosis and management of candidiasis: an initiative of the ECMM in cooperation with ISHAM and ASM[J/OL]. Lancet Infect Dis. (2025-02-13)[2025-03-28]. https://doi.org/10.1016/s1473-3099(24)00749-7. [6] 中华医学会呼吸病学分会. 慢性阻塞性肺疾病伴肺曲霉病诊治和管理专家共识[J]. 中华结核和呼吸杂志, 2024, 47(7): 604-622. Chinese Thoracic Society of Chinese Medical Association. Expert consensus on the diagnosis and treatment of pulmonary Aspergillosis in patients with chronic obstructive pulmonary disease[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2024, 47(7): 604-622. [7] Schauwvlieghe AFAD, Rijnders BJA, Philips N, et al. Invasive aspergillosis in patients admitted to the intensive care unit with severe influenza: a retrospective cohort study[J]. Lancet Respir Med, 2018, 6(10): 782-792. doi: 10.1016/S2213-2600(18)30274-1 [8] 中国医师协会呼吸医师分会危重症学组, 中华医学会呼吸病学分会. 重症新型冠状病毒感染合并侵袭性肺曲霉病和肺毛霉病诊治专家共识[J]. 中华结核和呼吸杂志, 2024, 47(1): 10-23. Critical Care Medicine Group of Chinese Association of Chest Physicians, Chinese Thoracic Society. Expert consensus on dia- gnosis and treatment of severe COVID -19 associated pulmonary Aspergillosis and mucormycosis[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2024, 47(1): 10-23. [9] Feys S, Carvalho A, Clancy CJ, et al. Influenza-associated and COVID -19-associated pulmonary Aspergillosis in critically ill patients[J]. Lancet Respir Med, 2024, 12(9): 728-742. doi: 10.1016/S2213-2600(24)00151-6 [10] 夏初, 许向华, 黄怡. 糖尿病合并侵袭性肺真菌感染的研究进展[J]. 中华结核和呼吸杂志, 2021, 44(2): 128-131. Xia C, Xu XH, Huang Y. Research progress of diabetes complicated with invasive lung fungal infection[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(2): 128-131. [11] Gu Y, Ye XP, Liu YX, et al. A risk-predictive model for invasive pulmonary aspergillosis in patients with acute exacerbation of chronic obstructive pulmonary disease[J]. Respir Res, 2021, 22(1): 176. doi: 10.1186/s12931-021-01771-3 [12] Bassetti M, Giacobbe DR, Agvald-Ohman C, et al. Invasive fungal diseases in adult patients in intensive care unit (FUNDICU): 2024 consensus definitions from ESGCIP, EFISG, ESICM, ECMM, MSGERC, ISAC, and ISHAM[J]. Intensive Care Med, 2024, 50(4): 502-515. doi: 10.1007/s00134-024-07341-7 [13] Gu Y, Ye XP, Wang Y, et al. Clinical features and prognostic analysis of patients with Aspergillus isolation during acute exacerbation of chronic obstructive pulmonary disease[J]. BMC Pulm Med, 2021, 21(1): 69. doi: 10.1186/s12890-021-01427-4 [14] 世界华人医学真菌专业委员会. 侵袭性肺真菌病诊断路径专家共识(2024版)[J]. 中华检验医学杂志, 2025, 48(4): 459-468. World Society of Chinese Medical Mycology. Expert consensus on the diagnostic pathway for invasive pulmonary fungal di-sease (2024)[J]. Chinese Journal of Laboratory Medicine, 2025, 48(4): 459-468. [15] 施毅. 非粒缺患者侵袭性肺真菌病诊疗思路[J]. 中国临床研究, 2023, 36(4): 481-486. Shi Y. Ideas for diagnosis and treatment of invasive pulmonary fungal diseases in patients with non-granulocytosis[J]. Chinese Journal of Clinical Research, 2023, 36(4): 481-486. [16] Koehler P, Bassetti M, Chakrabarti A, et al. Defining and managing COVID -19-associated pulmonary Aspergillosis: the 2020 ECMM/ISHAM consensus criteria for research and clinical guidance[J]. Lancet Infect Dis, 2021, 21(6): e149-e162. doi: 10.1016/S1473-3099(20)30847-1 [17] Verweij PE, Rijnders BJA, Brüggemann RJM, et al. Review of influenza-associated pulmonary Aspergillosis in ICU patients and proposal for a case definition: an expert opinion[J]. Intensive Care Med, 2020, 46(8): 1524-1535. doi: 10.1007/s00134-020-06091-6 [18] Haydour Q, Alahdab F, Farah M, et al. Management and dia-gnosis of psychogenic cough, habit cough, and tic cough: a systematic review[J]. Chest, 2014, 146(2): 355-372. doi: 10.1378/chest.14-0795 [19] Nucci M, Nouér SA, Cappone D, et al. Early diagnosis of invasive pulmonary Aspergillosis in hematologic patients: an opportunity to improve the outcome[J]. Haematologica, 2013, 98(11): 1657-1660. doi: 10.3324/haematol.2013.094359 [20] Garcia-Vidal C, Alastruey-Izquierdo A, Aguilar-Guisado M, et al. Executive summary of clinical practice guideline for the management of invasive diseases caused by Aspergillus: 2018 update by the GEMICOMED-SEIMC/REIPI[J]. Enferm Infecc Microbiol Clin (Engl Ed), 2019, 37(8): 535-541. doi: 10.1016/j.eimc.2018.03.018 [21] Ascioglu S, Rex JH, de Pauw B, et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an internatio-nal consensus[J]. Clin Infect Dis, 2002, 34(1): 7-14. doi: 10.1086/323335 [22] De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group[J]. Clin Infect Dis, 2008, 46(12): 1813-1821. doi: 10.1086/588660 [23] 张英芳, 黄琳娜, 詹庆元. 重症监护室中侵袭性肺曲霉菌病的诊断标准: 因人而异[J]. 内科急危重症杂志, 2022, 28(5): 361-367. Zhang YF, Huang LN, Zhan QY. Diagnostic criteria for invasive pulmonary Aspergillosis in intensive care unit: varying from person to person[J]. Journal of Critical Care in Internal Medicine, 2022, 28(5): 361-367. [24] 中国成人念珠菌病诊断与治疗专家共识组. 中国成人念珠菌病诊断与治疗专家共识[J]. 中国医学前沿杂志(电子版), 2020, 12(1): 35-50. Expert Consensus Group on Diagnosis and Treatment of Adult Candidiasis in China. Chinese consensus on the diagnosis and management of adult candidiasis[J]. Chinese Journal of the Frontiers of Medical Science(Electronic version), 2020, 12(1): 35-50. [25] Chang CC, Harrison TS, Bicanic TA, et al. Global guideline for the diagnosis and management of cryptococcosis: an initiative of the ECMM and ISHAM in cooperation with the ASM[J]. Lancet Infect Dis, 2024, 24(8): e495-e512. [26] Alexander BD, Lamoth F, Heussel CP, et al. Guidance on ima- ging for invasive pulmonary Aspergillosis and mucormycosis: from the imaging working group for the revision and update of the consensus definitions of fungal disease from the EORTC/MSGERC[J]. Clin Infect Dis, 2021, 72(S2): S79-S88. [27] 中国医药教育协会真菌病专业委员会, 中国毛霉病专家共识工作组. 中国毛霉病临床诊疗专家共识(2022)[J]. 中华内科杂志, 2023, 62(6): 597-605. Medical Mycology Society of Chinese Medicine and Education Association, Chinese Mucormycosis Expert Consensus Group. Expert consensus on diagnosis and management of mucormycosis in China[J]. Chinese Journal of Internal Medicine, 2023, 62(6): 597-605. [28] Thompson GR 3rd, Le T, Chindamporn A, et al. Global guideline for the diagnosis and management of the endemic mycoses: an initiative of the European Confederation of Medical Mycology in cooperation with the International Society for Human and Animal Mycology[J]. Lancet Infect Dis, 2021, 21(12): e364-e374. [29] Chen SCA, Perfect J, Colombo AL, et al. Global guideline for the diagnosis and management of rare yeast infections: an initiative of the ECMM in cooperation with ISHAM and ASM[J]. Lancet Infect Dis, 2021, 21(12): e375-e386. [30] Hoenigl M, Salmanton-García J, Walsh TJ, et al. Global guideline for the diagnosis and management of rare mould infections: an initiative of the European Confederation of Medical Mycology in cooperation with the International Society for Human and Animal Mycology and the American Society for Microbiology[J]. Lancet Infect Dis, 2021, 21(8): e246-e257. [31] Heylen J, Vanbiervliet Y, Maertens J, et al. Acute invasive pulmonary Aspergillosis: clinical presentation and treatment[J]. Semin Respir Crit Care Med, 2024, 45(1): 69-87.

 下载:
下载:
